Tăng triglycerid máu (HTG) là nguyên nhân quan trọng gây viêm tụy cấp [1-3]. Việc nhận biết sớm bệnh viêm tụy do HTG gây ra trên lâm sàng (HTGP) là rất quan trọng để đưa ra liệu pháp điều trị thích hợp và ngăn ngừa các đợt tiếp theo [1,2,4-6].
DỊCH TỄ HỌC
Tỷ lệ hiện mắc – Viêm tụy do tăng triglycerid máu (HTGP) gây ra từ 1 đến 35% tổng số trường hợp viêm tụy cấp và lên tới 56% trường hợp viêm tụy khi mang thai [1,3-5,7]. Có sự khác biệt về nhân khẩu học giữa bệnh nhân mắc HTGP và các nguyên nhân khác gây viêm tụy [8,9]. Điều này đã được minh họa trong một nghiên cứu tiền cứu gồm 400 trường hợp viêm tụy cấp liên tiếp. Trong nghiên cứu này, bệnh nhân mắc HTGP có độ tuổi trẻ hơn (44 so với 52), chủ yếu là nam giới (65 so với 45%) và có tiền sử béo phì (57% so với 34%) hoặc tiểu đường (38 so với 17%) so với bệnh nhân viêm tụy cấp không tăng triglycerid máu (HTG) [9].
Nguy cơ và mức độ nghiêm trọng của viêm tụy – Nguy cơ viêm tụy cấp tăng dần khi nồng độ triglyceride trong huyết thanh trên 500 mg/dL (5,6 mmol/L), với nguy cơ tăng rõ rệt với mức trên 1000 mg/dL (11,3 mmol/L) [2 ,10-14]. Nguy cơ phát triển viêm tụy cấp là khoảng 5% với triglyceride huyết thanh >1000 mg/dL (11,3 mmol/L) và 10 đến 20% với triglyceride >2000 mg/dL (22,6 mmol/L) [15] . Trong một nghiên cứu tiền cứu trên 116.500 cá nhân có mức triglyceride từ 443 mg/dL đến 885 mg/dL, tỷ lệ mắc bệnh viêm tụy cấp là 0,12% [16] .
Nguy cơ viêm tụy cấp cũng tăng theo số đợt viêm tụy cấp trước đó. Trong một nghiên cứu đoàn hệ hồi cứu lớn khác với 7.119.195 bệnh nhân, trong đó 4158 (0,058%) có một hoặc nhiều đợt viêm tụy cấp trong một năm trước đó, tỷ lệ mắc bệnh viêm tụy cấp là <1%, nhưng tăng rõ rệt sau mỗi đợt viêm tụy trước đó. viêm tụy cấp và ở mức triglyceride thấp hơn [16].
Mức độ tăng triglyceride có liên quan đến mức độ nghiêm trọng của viêm tụy cấp [5,8,9,14,17]. Tuy nhiên, các yếu tố khác như hoạt động lipase tuyến tụy, hiệu quả làm sạch axit béo (FA) từ huyết thanh và mức độ nghiêm trọng của tổn thương tuyến tụy tiềm ẩn cũng có khả năng ảnh hưởng đến mức độ nghiêm trọng của viêm tụy cấp [8,14,18] . Trong một nghiên cứu hồi cứu trên 1539 bệnh nhân bị viêm tụy cấp, trong đó 461 (30%) có mức triglyceride tăng cao trên 150 mg/dL, tỷ lệ viêm tụy cấp nặng tăng lên khi mức triglyceride tăng [8] . Trong số 112 bệnh nhân bị tăng triglycerid máu nặng (HTG), tụ dịch hoại tử cấp tính và hoại tử tuyến tụy phát triển lần lượt ở 32 bệnh nhân (29%) và 39 bệnh nhân (35%) [8] . Hơn nữa, tỷ lệ bệnh nhân bị suy tạng dai dẳng, suy đa cơ quan và hội chứng đáp ứng viêm hệ thống dai dẳng tăng theo mức độ HTG.
Căn nguyên
Cả rối loạn chuyển hóa lipoprotein nguyên phát (di truyền) và thứ phát đều có liên quan đến viêm tụy do tăng triglycerid máu (HTGP).
Tăng triglycerid máu nguyên phát – Rối loạn lipid máu mang tính chất gia đình có liên quan đến tăng triglycerid máu nặng (HTG) và có liên quan đến nhiều nguy cơ viêm tụy cấp [19].
Chylomicron máu gia đình thường xuất hiện ở trẻ nhỏ. Nguyên nhân là do sự giảm hoạt động của lipoprotein lipase (LPL) do thiếu hụt sản phẩm gen LPL hoặc chất điều chỉnh LPL được mã hóa bởi các gen APOC2, APOA5, GPIHBP1 và LMF1 [20] hoặc các nguy cơ di truyền phức tạp [21]. Bệnh nhân mắc chứng chylomicron máu gia đình có thể bị viêm tụy cấp mà không có tình trạng trầm trọng hơn. Bệnh thường biểu hiện sớm trong đời, nhưng việc chẩn đoán thường bị trì hoãn và độ tuổi chẩn đoán trung bình là 24 tuổi [22]. Bệnh nhân bị viêm tụy cấp tiến triển thành viêm tụy cấp tái phát và viêm tụy mãn tính; một tập hợp con sẽ phát triển bệnh tiểu đường Loại 3c.
HTG mang tính chất gia đình là một nguyên nhân hiếm gặp của HTGP vì nồng độ triglycerid lipoprotein mật độ rất thấp (VLDL) không có chylomicron hiếm khi đạt đến mức khiến nguy cơ này tăng lên. HTG gia đình là một rối loạn di truyền phức tạp trong đó sự tương tác của nhiều gen nhạy cảm với các thành phần môi trường góp phần tạo nên kiểu hình. Các biến thể di truyền gây bệnh có xu hướng mắc HTG không tương quan hoàn hảo với kiểu hình và các gen và biến thể mới tiếp tục được công nhận [23,24]. Bệnh nhân thường có biểu hiện viêm tụy cấp ở tuổi trưởng thành. HTGP thường bị thúc đẩy bởi rượu và một bữa ăn nhiều chất béo hoặc bắt đầu dùng thuốc gây ra HTG.
Bệnh nhân tăng lipid máu hỗn hợp (chylomicron cao và VLDL) có nguy cơ cao bị viêm tụy cấp. Tuy nhiên, những bệnh nhân bị tăng lipid máu hỗn hợp không có nồng độ triglycerid huyết thanh tăng đủ cao để gây viêm tụy cấp nếu không có các yếu tố môi trường hoặc nội tiết tố góp phần. Rối loạn này phản ánh động học bão hòa trong đó xảy ra quá trình loại bỏ triglyceride qua trung gian LPL. Tuy nhiên, đây là một rối loạn di truyền phức tạp thường được kết hợp với các yếu tố mắc phải ảnh hưởng đến việc sản xuất và bài tiết VLDL hoặc giảm hoạt động LPL được gọi là hội chứng chylomicronemia đa yếu tố (MFCS) [25].
Tăng triglycerid thứ phát – Nhiều tình trạng khác nhau có thể làm tăng triglycerid và dẫn đến HTGP, đặc biệt ở những người có nguy cơ di truyền tiềm ẩn [26].
● Đái tháo đường – Đái tháo đường được kiểm soát kém (loại 1 và 2) và nhiễm toan ceton do đái tháo đường (DKA) có thể gây ra HTGP [1,27-29]. Viêm tụy ở DKA thường xảy ra với nhiễm toan chuyển hóa nặng được đặc trưng bởi pH huyết thanh thấp (<7,1) và khoảng trống anion cao [29]. Tăng triglycerid huyết thanh rõ rệt có thể xảy ra trong giai đoạn DKA, nhưng điều này không bình thường vì quá trình oxy hóa axit béo tự do (FFA) và hình thành thể xeton tăng nhiều hơn sản xuất triglycerid và bài tiết VLDL trong bối cảnh này. Tuy nhiên, việc thiếu insulin dẫn đến quá trình phân giải lipid ở mô mỡ và giải phóng FFA. Việc tăng cung cấp FFA đến gan có thể dẫn đến sản lượng VLDL cao, cùng với sự ức chế LPL ở các mô ngoại biên, dẫn đến tăng triglycerid máu.
●Thuốc – Bổ sung hormone bằng estrogen đường uống và chất điều biến thụ thể estrogen chọn lọc, tamoxifen , có thể làm tăng mức triglyceride trong huyết thanh [30,31]. Các loại thuốc khác có liên quan đến tăng nồng độ triglycerid huyết thanh bao gồm clomiphene , thuốc ức chế điểm kiểm soát miễn dịch, thuốc ức chế protease, thuốc kháng retrovirus, propofol , olanzapine , mirtazapine , retinoids, thuốc lợi tiểu thiazide và thuốc chẹn beta [32].
●Mang thai – Mặc dù mang thai làm tăng lượng triglyceride trong huyết thanh và đạt đỉnh điểm trong tam cá nguyệt thứ ba, nhưng tổng mức triglyceride trong huyết thanh hiếm khi vượt quá 300 mg/dL (3,3 mmol/L), nồng độ không đủ để gây viêm tụy cấp. Các trường hợp HTG do mang thai không do di truyền, không có tính chất gia đình đã được báo cáo nhưng rất hiếm [33]. Hầu hết các trường hợp HTGP xảy ra trong thai kỳ đều do nguyên nhân di truyền của HTG.
●Rượu – Rượu có thể làm tăng mức triglyceride ở những bệnh nhân mắc chứng tăng lipid máu tiềm ẩn [2]. Ở hầu hết các bệnh nhân khác, tăng triglycerid khi uống rượu là thoáng qua và có thể là một hiện tượng phụ hơn là nguyên nhân gây viêm tụy [34]. Rượu, với liều > 60 gram mỗi ngày, làm tăng nồng độ triglyceride trong huyết thanh theo cách phụ thuộc vào liều lượng [35]. Trong một nghiên cứu trên khoảng 8000 nam và nữ, tỷ lệ nồng độ triglyceride trong huyết thanh trên 227 mg/dL (2,5 mmol/L) tăng từ 8 đến 20% khi tăng lượng rượu uống từ ba đến chín ly trở lên mỗi ngày [36].
BỆNH SINH
Bản thân triglyceride dường như không độc hại. Đúng hơn, chính sự phân hủy triglyceride thành axit béo độc hại (FA) bởi lipase tuyến tụy là nguyên nhân gây nhiễm độc mỡ trong viêm tụy cấp [37,38]. Mức độ nghiêm trọng của viêm tụy cấp ở bệnh nhân tăng triglycerid máu (HTG) phụ thuộc vào phản ứng viêm do chính viêm tụy gây ra, cộng với tổn thương do nhiễm độc mỡ do thủy phân triglycerid.
Trong hầu hết các trường hợp, HTG chỉ thoáng qua và trở lại gần bình thường trong vòng hai đến ba ngày, tùy thuộc vào nguyên nhân và cách xử lý tối ưu [39]. Tuy nhiên, HTG nặng, cộng với nồng độ lipase cao (>3 lần giới hạn trên của mức bình thường) có liên quan đến nồng độ FA rất cao và có thể trở nên phức tạp hơn do tình trạng viêm toàn thân do viêm tụy cấp, kích hoạt trực tiếp thụ thể giống thu phí (TLR) 2 và TLR4 bởi các axit béo tự do (FFA) và nhiễm độc mỡ trực tiếp [37,40]. Không có dấu ấn sinh học rõ ràng để xác định tác động của nhiễm độc mỡ độc lập với viêm tụy cấp với mức triglyceride bình thường, nhưng một số nghiên cứu đã ghi nhận sự giảm nồng độ canxi huyết thanh trong những trường hợp nặng hơn [40,41].
Viêm tụy không trực tiếp gây tăng triglycerid máu. Có thể ở một số bệnh nhân (chỉ số khối cơ thể [BMI] >40), sự căng thẳng của phản ứng viêm nghiêm trọng đối với viêm tụy cấp sẽ gây ra một số mức tăng triglyceride, nhưng không thể loại trừ chế độ ăn uống bừa bãi trước khi bắt đầu viêm tụy cấp.
ĐẶC ĐIỂM LÂM SÀNG
Biểu hiện lâm sàng – Biểu hiện ban đầu của viêm tụy do tăng triglycerid máu (HTGP) tương tự như viêm tụy cấp do các nguyên nhân khác, với biểu hiện đau bụng dữ dội vùng thượng vị kéo dài, thường lan ra sau lưng, buồn nôn và nôn. Hầu hết người lớn mắc HTGP đều có triệu chứng ở độ tuổi 50-60 năm của cuộc đời. Tuy nhiên, những bệnh nhân mắc một số rối loạn di truyền nhất định về HTG có thể phát triển các cơn viêm tụy cấp ở thời thơ ấu hoặc thanh thiếu niên.
Kết quả khám thực thể gợi ý tăng triglycerid máu tiềm ẩn (HTG) có thể xuất hiện ở bệnh nhân mắc HTGP. Chúng bao gồm các u xanthoma phun trào trên các bề mặt duỗi của cánh tay, chân, mông và lưng do tăng chylomicron máu dai dẳng và gan lách to do thâm nhiễm mỡ [42-44]. Bệnh mỡ máu võng mạc có thể gặp ở những bệnh nhân có nồng độ triglyceride vượt quá 4000 mg/dL (45 mmol/L). Trong tình trạng này, các tiểu động mạch và tĩnh mạch võng mạc, và thường là cả đáy mắt, phát triển màu hồng nhạt do sự tán xạ ánh sáng bởi các chylomicron lớn. Thị lực không bị ảnh hưởng và bệnh võng mạc nhiễm mỡ máu có thể hồi phục khi giảm mức triglyceride [42-44].
Kết quả xét nghiệm — Ở mức triglyceride cao, huyết thanh trở thành màu sữa (màu trắng đục) (hình 1). Nồng độ triglyceride tăng cao có thể làm thay đổi các phép đo thông thường về natri, glucose, amylase và lipoprotein mật độ thấp. Lượng triglyceride dư thừa trong mẫu huyết thanh có thể thay thế nước có chứa natri và gây ra giả hạ natri máu [45]. Mức triglyceride trong huyết thanh >500 mg/dL (5,6 mmol/L) có thể gây ra mức amylase bình thường giả, có thể do sự can thiệp của kết quả đo nhiệt lượng. Pha loãng hàng loạt mẫu amylase huyết thanh có thể làm giảm sự can thiệp của triglyceride [45,46].
CHẨN ĐOÁN
Nên nghi ngờ viêm tụy do tăng triglycerid máu (HTGP) ở bệnh nhân viêm tụy cấp và có các yếu tố nguy cơ tăng triglycerid máu (HTG). Mức triglyceride trong huyết thanh >500 mg/dL (5,6 mmol/L) là cần thiết để HTG được coi là nguyên nhân cơ bản của viêm tụy cấp [6]. Triglyceride huyết thanh nên được đo sớm trong quá trình viêm tụy cấp, chẳng hạn như ở khoa cấp cứu hoặc khi nhập viện. Việc phát hiện sớm HTG rất quan trọng để thiết lập chẩn đoán, bắt đầu các phương pháp điều trị cụ thể và cải thiện tiên lượng bằng cách giảm nguy cơ rối loạn chức năng đa cơ quan. Các yếu tố nguy cơ đối với HTG bao gồm bệnh tiểu đường được kiểm soát kém, nghiện rượu, béo phì, mang thai, viêm tụy trước đó và tiền sử cá nhân hoặc gia đình mắc HTG [1,2,4,15,47].
Bản thân viêm tụy cấp không gây ra HTG đáng kể. Mặc dù có thể ở một số bệnh nhân (ví dụ: chỉ số khối cơ thể [BMI] >40), căng thẳng của phản ứng viêm nặng đối với viêm tụy cấp có thể gây ra sự gia tăng triglyceride trong huyết thanh, mối quan hệ giữa mức triglyceride tồn tại từ trước và sự huy động phản ứng của triglyceride từ các kho dự trữ chất béo, theo hiểu biết của chúng tôi, vẫn chưa được xác định.

Mẫu máu của bệnh nhân có mức triglyceride là 1200 mg/dL trong ống tách huyết thanh. Am J Gastroenterol 2009; 104:984.
Chẩn đoán viêm tụy cấp ở bệnh nhân HTG cũng giống như các nguyên nhân khác của viêm tụy cấp và cần có 2 trong 3 tiêu chuẩn sau: khởi phát cấp tính, đau vùng thượng vị dai dẳng, dữ dội, thường lan ra sau lưng; tăng lipase huyết thanh hoặc amylase lên ba lần hoặc cao hơn giới hạn trên của mức bình thường; và các phát hiện đặc trưng của viêm tụy cấp trên hình ảnh học (chụp cắt lớp vi tính có cản quang, chụp cộng hưởng từ hoặc siêu âm qua ổ bụng). Việc chẩn đoán viêm tụy cấp sẽ được thảo luận chi tiết một cách riêng biệt.
QUẢN LÝ BAN ĐẦU
Quản lý bệnh nhân viêm tụy do tăng triglycerid máu (HTGP) bao gồm điều trị viêm tụy cấp và giảm nồng độ triglycerid huyết thanh với mục tiêu ngăn ngừa viêm tụy hoại tử và suy nội tạng. Ở những bệnh nhân mắc HTGP, việc duy trì mức triglyceride dưới 500 mg/dL (5,6 mmol/L) có thể giúp cải thiện lâm sàng [2]. Cách tiếp cận của chúng tôi đối với liệu pháp ban đầu đối với bệnh tăng triglycerid máu (HTG) ở bệnh nhân mắc HTGP dựa trên mức độ nghiêm trọng của viêm tụy cấp và sự hiện diện của các đặc điểm lâm sàng đáng lo ngại (Xem thuật toán 1) [41,48-54].
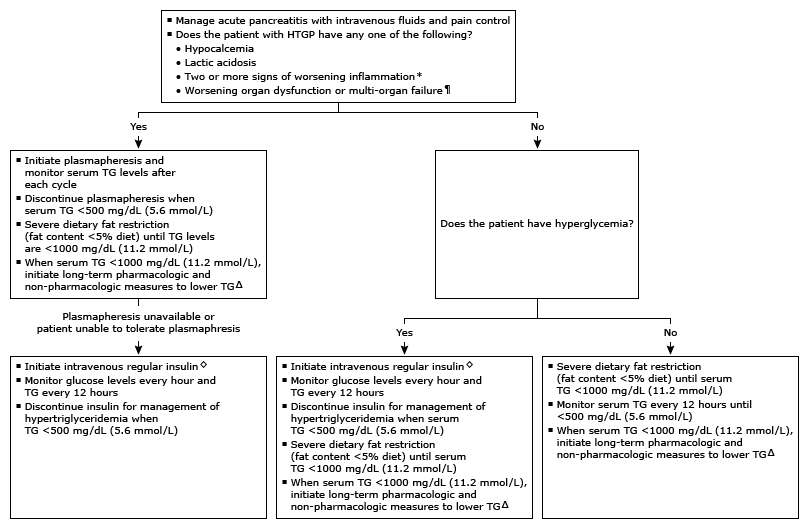
* Dấu hiệu tình trạng viêm nặng hơn bao gồm:
- Nhiệt độ >38,5°C hoặc <35,0°C
- Nhịp tim >90 nhịp/phút
- Nhịp thở >20 nhịp/phút hoặc PaCO2 < 32 mmHg
- Số lượng bạch cầu >12.000 tế bào/mL, <4000 tế bào/mL hoặc >10% dạng (dải) chưa trưởng thành
¶ Như được định nghĩa bởi hệ thống tính điểm Marshall sửa đổi cho rối loạn chức năng cơ quan.
Đánh giá các đặc điểm đáng lo ngại
– Các đặc điểm đáng lo ngại ở bệnh nhân mắc HTGP bao gồm:
●Hạ canxi máu
●Nhiễm axit lactic
●Dấu hiệu viêm toàn thân trầm trọng hơn (hai hoặc nhiều hơn):
•Nhiệt độ >38,5°C hoặc <35,0°C
•Nhịp tim >90 nhịp/phút
•Nhịp thở > 20 nhịp thở/phút hoặc áp suất riêng phần của carbon dioxide (PaCO 2) <32 mmHg
•Số lượng tế bào bạch cầu (WBC) >12.000 tế bào/mL, <4000 tế bào/mL hoặc >10% dạng (dải) chưa trưởng thành
●Dấu hiệu rối loạn chức năng cơ quan xấu đi hoặc suy đa cơ quan được xác định theo hệ thống tính điểm Marshall sửa đổi cho rối loạn chức năng cơ quan (bảng 1)
| Hệ thống cơ quan | Điểm | ||||
| 0 | 1 | 2 | 3 | 4 | |
| Hô hấp ( PaO2/FiO2 ) | >400 | 301-400 | 201-300 | 101-200 | 101 |
| Thận* | |||||
| (creatinine huyết thanh, micromol/L) | 134 | 134-169 | 170-310 | 311-439 | >439 |
| (creatinine huyết thanh, mg/dL) | <1,4 | 1,4-1,8 | 1,9-3,6 | 3,6-4,9 | >4.9 |
| Tim mạch (huyết áp tâm thu, mmHg) ¶ | >90 | <90, đáp ứng chất lỏng | <90, không đáp ứng với chất lỏng | <90, pH <7,3 | <90, pH <7,2 |
| Đối với những bệnh nhân không thở máy, FiO 2 có thể được ước tính từ bên dưới: | |||||
| Oxy bổ sung (L/phút) | FiO2 ( phần trăm) | ||||
| Không khí trong phòng | 21 | ||||
| 2 | 25 | ||||
| 4 | 30 | ||||
| 6-8 | 40 | ||||
| 9-10 | 50 | ||||
¶ Không dùng thuốc hỗ trợ tăng co bóp cơ tim.
Các biện pháp chung ở tất cả bệnh nhân
●Điều trị viêm tụy cấp – Xử trí ban đầu cho bệnh nhân viêm tụy cấp bao gồm chăm sóc hỗ trợ bằng bù dịch và kiểm soát cơn đau. Việc quản lý viêm tụy cấp sẽ được thảo luận chi tiết một cách riêng biệt.
●Hạn chế chất béo trong chế độ ăn uống – Khi bệnh nhân mắc HTGP có thể dung nạp dinh dưỡng qua đường miệng, chất béo trong chế độ ăn nên được hạn chế nghiêm ngặt (<5% chất béo) cho đến khi mức triglyceride <1000 mg/dL (11,3 mmol/L) [55] . Khi đó, mức triglyceride lúc đói chủ yếu là, nếu không nói là hoàn toàn, là lipoprotein mật độ rất thấp (VLDL), chứ không phải chylomicron. Tại thời điểm này, các loại thuốc làm giảm triglyceride VLDL, ví dụ như fibrate, axit béo omega-3 liều cao hoặc statin liều cao, sẽ làm giảm thêm triglyceride trong hội chứng chylomicronemia đa yếu tố (MFCS) <500 mg/dL.
●Loại bỏ các nguyên nhân thứ phát của HTG – Nên ngừng sử dụng các loại thuốc có thể làm tăng triglyceride.
Các biện pháp bổ sung ở những bệnh nhân được chọn
Lọc huyết tương – Chúng tôi bảo lưu việc sử dụng phương pháp lọc huyết tương ở những bệnh nhân mắc HTGP có các đặc điểm đáng lo ngại [56].
●Hiệu quả – Bằng chứng hỗ trợ việc sử dụng phương pháp lọc huyết tương ở bệnh nhân mắc HTGP là từ các nghiên cứu quan sát; thiếu các thử nghiệm ngẫu nhiên [54,57-70]. Một đợt điều trị huyết tương đã được báo cáo là làm giảm mức triglyceride từ 50 đến 80%. Tuy nhiên, các nghiên cứu chưa chứng minh được sự cải thiện kết quả ở bệnh nhân mắc HTGP. Một nghiên cứu tiến cứu về phương pháp tách huyết tương, kiểm tra 60 bệnh nhân mắc HTGP đã trải qua phương pháp tách huyết tương, không tìm thấy sự khác biệt thống kê về tỷ lệ tử vong, biến chứng toàn thân hoặc tại chỗ giữa những người được điều trị huyết tương và nhóm đối chứng trước đây. Điều này được cho là có liên quan đến sự chậm trễ trong việc bắt đầu quá trình lọc huyết tương. Tuy nhiên, lợi ích của việc bắt đầu sớm phương pháp tách huyết tương đã không được chứng minh một cách nhất quán [71,72].
Lọc huyết tương dường như không cải thiện kết quả trong các trường hợp HTGP không biến chứng [73]. Trong một nghiên cứu bao gồm 67 bệnh nhân không có rối loạn chức năng đa cơ quan, không có lợi ích đáng kể nào đối với tỷ lệ tử vong hoặc thời gian nằm viện khi sử dụng phương pháp lọc huyết tương bổ sung để quản lý nội khoa, ngay cả khi bệnh nhân có mức triglyceride tăng cao nghiêm trọng.
●Theo dõi và thời gian điều trị – Ở những bệnh nhân được điều trị bằng phương pháp lọc huyết tương, nên đo triglyceride sau mỗi chu kỳ lọc huyết tương [74]. Chúng tôi tiếp tục lọc huyết tương cho đến khi mức triglyceride dưới 1000 mg/dL (11,3 mmol/L). Một loạt bảy bệnh nhân có mức triglyceride trung bình là 1407 mg/dL (15,8 mmol/L) đã báo cáo mức triglyceride trung bình giảm xuống 683 mg/dL (51%) sau một lần trao đổi huyết tương [64] . Trong một báo cáo trường hợp khác, triglyceride đã giảm từ 2410 (27,2 mmol/L) xuống 138 mg/dL (1,5 mmol/L) sau ba ngày chỉ điều trị huyết tương [69].
Insulin — Chúng tôi sử dụng insulin tiêm tĩnh mạch (IV) ở những bệnh nhân có các đặc điểm đáng lo ngại của HTGP được chỉ định lọc huyết tương nhưng không có sẵn hoặc không thể dung nạp được. Vì insulin có thể làm giảm cả mức triglyceride và glucose, chúng tôi cũng sử dụng insulin ở bệnh nhân mắc HTGP mắc bệnh tiểu đường để kiểm soát tình trạng tăng đường huyết, tức là glucose huyết tương >180 mg/dL [75] .
Ở những bệnh nhân có đặc điểm đáng lo ngại của HTGP, chúng tôi thường bắt đầu truyền tĩnh mạch insulin thông thường (Regular) với tốc độ 0,1 đến 0,3 đơn vị/kg/giờ đồng thời theo dõi chặt chẽ mức đường huyết. Ở những bệnh nhân có mức đường huyết từ 150 đến 200 mg/dL, chúng tôi truyền dịch dextrose 5% riêng biệt để ngăn ngừa hạ đường huyết do truyền insulin. Nồng độ triglyceride nên được theo dõi mỗi 12 giờ. Nên đo glucose huyết thanh mỗi giờ và điều chỉnh lượng insulin/5% dextrose truyền cho phù hợp. Nên ngừng tiêm insulin khi nồng độ triglyceride <500 mg/dL (5,6 mmol/L).
Nhiều chế độ điều trị insulin khác đã được báo cáo là làm giảm mức triglyceride xuống <500 mg/dL (5,6 mmol/L) trong 3,5 đến 4 ngày [51-53,76]. Insulin tiêm tĩnh mạch có thể hiệu quả hơn insulin tiêm dưới da trong những trường hợp HTGP nặng [51,52] và dễ điều chỉnh hơn so với tiêm insulin dưới da [77]. Insulin IV được truyền liên tục cho thấy có hiệu quả ở những bệnh nhân mắc HTGP nặng có và không có đái tháo đường týp 2 [78].
Insulin làm giảm sản xuất triglyceride VLDL và cũng làm giảm mức triglyceride trong huyết thanh bằng cách tăng cường hoạt động của lipoprotein lipase (LPL), một loại enzyme làm tăng tốc độ chuyển hóa chylomicron và VLDL thành glycerol và axit không béo (FFA) [79,80] . Insulin cũng ức chế lipase nhạy cảm với hormone trong tế bào mỡ, đây là enzyme chủ chốt để phá vỡ triglyceride của tế bào mỡ và giải phóng axit béo (FA) vào tuần hoàn. Insulin làm giảm mức triglyceride, nhưng mục tiêu của liệu pháp insulin trong viêm tụy cấp nặng liên quan đến HTG nặng là đảo ngược sự giải phóng FA từ tế bào mỡ do căng thẳng, để thúc đẩy sản xuất triglyceride nội bào trong tế bào mỡ, thúc đẩy chuyển hóa FA trong tế bào nhạy cảm với insulin, giảm kháng insulin ngoại biên và chủ yếu là để điều chỉnh tình trạng tăng đường huyết. Ở chuột, insulin cũng được chứng minh là làm giảm mức độ nghiêm trọng của viêm tụy cấp và cải thiện khả năng phục hồi [81]. Để đạt được sự đảo ngược quá trình chuyển hóa trung gian trong bối cảnh này, chúng tôi sử dụng các phác đồ đã được thiết lập tốt dùng cho nhiễm toan đái tháo đường để duy trì mức insulin tiêm tĩnh mạch cao và bảo vệ bệnh nhân khỏi bị hạ đường huyết [77] .
Ở những bệnh nhân không có biểu hiện đáng lo ngại, không có tăng đường huyết, thiếu bằng chứng ủng hộ việc sử dụng insulin. Một nghiên cứu hồi cứu về những bệnh nhân nhập viện dùng HTGP được quản lý hỗ trợ, cung cấp nước NPO và IV. Truyền insulin chỉ được sử dụng ở 12 bệnh nhân để kiểm soát tình trạng tăng đường huyết đồng thời [72]. Mức triglyceride trung bình giảm từ 4018 mg/dL khi đến khám xuống còn 1177 mg/dL trong vòng 48 giờ, giảm khoảng 70%. Hơn nữa, kết quả tương tự đối với các phân nhóm chỉ dùng NPO và phân nhóm truyền insulin.
Những phương pháp điều trị ít hiệu quả
● Heparin – Chúng tôi không sử dụng heparin do tính chất thoáng qua của việc giảm mức triglyceride, khả năng nhiễm độc mỡ do giải phóng FFA vào nội mạch từ quá trình thủy phân các lipoprotein giàu triglyceride qua trung gian LPL do heparin gây ra [82] và tăng nguy cơ chảy máu . Sự thoái hóa này góp phần làm cạn kiệt thêm lượng dự trữ LPL trong huyết tương và có thể dẫn đến sự gia tăng mức độ VLDL và chylomicron triglycerid [83].
QUẢN LÝ TIẾP THEO
Đánh giá các yếu tố nguy cơ có thể thay đổi được – Bệnh nhân bị viêm tụy do tăng triglycerid máu (HTGP) nên được đánh giá các nguyên nhân thứ phát gây tăng triglycerid máu (HTG) [84-89]. Đối với những bệnh nhân mắc HTG không liên quan rõ ràng đến nguyên nhân thứ phát, các thành viên trong gia đình nên được sàng lọc mức triglyceride lúc đói.
Quản lý lipid – Bệnh nhân hồi phục sau HTGP cần điều trị lâu dài để ngăn ngừa viêm tụy cấp tái phát và ngăn ngừa các biến chứng khác của HTG [10]. Điều này bao gồm cả liệu pháp dùng thuốc (ví dụ, gemfibrozil uống 600 mg hai lần mỗi ngày) và điều chỉnh chế độ ăn uống với việc hạn chế hàm lượng chất béo ở mức 10 đến 15% trong chế độ ăn và tránh đường cô đặc. Các biện pháp can thiệp không dùng thuốc khác bao gồm giảm cân ở bệnh nhân béo phì, tập thể dục nhịp điệu, tránh dùng các loại thuốc làm tăng nồng độ triglyceride trong huyết thanh và kiểm soát đường huyết nghiêm ngặt ở bệnh nhân tiểu đường.
Nguồn: Uptodate; Dịch: Bs Lê Đình Sáng
TÀI LIỆU THAM KHẢO
- Fortson MR, Freedman SN, Webster PD 3rd. Clinical assessment of hyperlipidemic pancreatitis. Am J Gastroenterol 1995; 90:2134.
- Toskes PP. Hyperlipidemic pancreatitis. Gastroenterol Clin North Am 1990; 19:783.
- Zhu Y, Pan X, Zeng H, et al. A Study on the Etiology, Severity, and Mortality of 3260 Patients With Acute Pancreatitis According to the Revised Atlanta Classification in Jiangxi, China Over an 8-Year Period. Pancreas 2017; 46:504.
- Chang CC, Hsieh YY, Tsai HD, et al. Acute pancreatitis in pregnancy. Zhonghua Yi Xue Za Zhi (Taipei) 1998; 61:85.
- Koutroumpakis E, Slivka A, Furlan A, et al. Management and outcomes of acute pancreatitis patients over the last decade: A US tertiary-center experience. Pancreatology 2017; 17:32.
- Berglund L, Brunzell JD, Goldberg AC, et al. Evaluation and treatment of hypertriglyceridemia: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2012; 97:2969.
- Olesen SS, Harakow A, Krogh K, et al. Hypertriglyceridemia is often under recognized as an aetiologic risk factor for acute pancreatitis: A population-based cohort study. Pancreatology 2021; 21:334.
- Wan J, He W, Zhu Y, et al. Stratified analysis and clinical significance of elevated serum triglyceride levels in early acute pancreatitis: a retrospective study. Lipids Health Dis 2017; 16:124.
- Nawaz H, Koutroumpakis E, Easler J, et al. Elevated serum triglycerides are independently associated with persistent organ failure in acute pancreatitis. Am J Gastroenterol 2015; 110:1497.
- Preiss D, Tikkanen MJ, Welsh P, et al. Lipid-modifying therapies and risk of pancreatitis: a meta-analysis. JAMA 2012; 308:804.
- Lindkvist B, Appelros S, Regnér S, Manjer J. A prospective cohort study on risk of acute pancreatitis related to serum triglycerides, cholesterol and fasting glucose. Pancreatology 2012; 12:317.
- Sandhu S, Al-Sarraf A, Taraboanta C, et al. Incidence of pancreatitis, secondary causes, and treatment of patients referred to a specialty lipid clinic with severe hypertriglyceridemia: a retrospective cohort study. Lipids Health Dis 2011; 10:157.
- Murphy MJ, Sheng X, MacDonald TM, Wei L. Hypertriglyceridemia and acute pancreatitis. JAMA Intern Med 2013; 173:162.
- Lloret Linares C, Pelletier AL, Czernichow S, et al. Acute pancreatitis in a cohort of 129 patients referred for severe hypertriglyceridemia. Pancreas 2008; 37:13.
- Scherer J, Singh VP, Pitchumoni CS, Yadav D. Issues in hypertriglyceridemic pancreatitis: an update. J Clin Gastroenterol 2014; 48:195.
- Sanchez RJ, Ge W, Wei W, et al. The association of triglyceride levels with the incidence of initial and recurrent acute pancreatitis. Lipids Health Dis 2021; 20:72.
- Pascual I, Sanahuja A, García N, et al. Association of elevated serum triglyceride levels with a more severe course of acute pancreatitis: Cohort analysis of 1457 patients. Pancreatology 2019; 19:623.
- Balachandra S, Virlos IT, King NK, et al. Hyperlipidaemia and outcome in acute pancreatitis. Int J Clin Pract 2006; 60:156.
- Fredrickson DS. An international classification of hyperlipidemias and hyperlipoproteinemias. Ann Intern Med 1971; 75:471.
- Goldberg RB, Chait A. A Comprehensive Update on the Chylomicronemia Syndrome. Front Endocrinol (Lausanne) 2020; 11:593931.
- Dron JS, Wang J, Cao H, et al. Severe hypertriglyceridemia is primarily polygenic. J Clin Lipidol 2019; 13:80.
- Blom DJ, O’Dea L, Digenio A, et al. Characterizing familial chylomicronemia syndrome: Baseline data of the APPROACH study. J Clin Lipidol 2018; 12:1234.
- Surendran RP, Visser ME, Heemelaar S, et al. Mutations in LPL, APOC2, APOA5, GPIHBP1 and LMF1 in patients with severe hypertriglyceridaemia. J Intern Med 2012; 272:185.
- Hegele RA, Ban MR, Hsueh N, et al. A polygenic basis for four classical Fredrickson hyperlipoproteinemia phenotypes that are characterized by hypertriglyceridemia. Hum Mol Genet 2009; 18:4189.
- Brahm AJ, Hegele RA. Chylomicronaemia–current diagnosis and future therapies. Nat Rev Endocrinol 2015; 11:352.
- Vipperla K, Somerville C, Furlan A, et al. Clinical Profile and Natural Course in a Large Cohort of Patients With Hypertriglyceridemia and Pancreatitis. J Clin Gastroenterol 2017; 51:77.
- Havel RJ. Familial dysbetalipoproteinemia. New aspects of pathogenesis and diagnosis. Med Clin North Am 1982; 66:441.
- Rivellese AA, De Natale C, Di Marino L, et al. Exogenous and endogenous postprandial lipid abnormalities in type 2 diabetic patients with optimal blood glucose control and optimal fasting triglyceride levels. J Clin Endocrinol Metab 2004; 89:2153.
- Nair S, Yadav D, Pitchumoni CS. Association of diabetic ketoacidosis and acute pancreatitis: observations in 100 consecutive episodes of DKA. Am J Gastroenterol 2000; 95:2795.
- Goldenberg NM, Wang P, Glueck CJ. An observational study of severe hypertriglyceridemia, hypertriglyceridemic acute pancreatitis, and failure of triglyceride-lowering therapy when estrogens are given to women with and without familial hypertriglyceridemia. Clin Chim Acta 2003; 332:11.
- Alagozlu H, Cindoruk M, Unal S. Tamoxifen-induced severe hypertriglyceridaemia and acute pancreatitis. Clin Drug Investig 2006; 26:297.
- Ashfaq A, Thalambedu N, Atiq MU. Acute Pancreatitis Secondary to Pembrolizumab-Induced Hypertriglyceridemia. Cureus 2023; 15:e38315.
- Eskandar O, Eckford S, Roberts TL. Severe, gestational, non-familial, non-genetic hypertriglyceridemia. J Obstet Gynaecol Res 2007; 33:186.
- Haber PS, Wilson JS, Apte MV, et al. Lipid intolerance does not account for susceptibility to alcoholic and gallstone pancreatitis. Gastroenterology 1994; 106:742.
- Taskinen MR, Nikkilä EA, Välimäki M, et al. Alcohol-induced changes in serum lipoproteins and in their metabolism. Am Heart J 1987; 113:458.
- Whitfield JB, Hensley WJ, Bryden D, Gallagher H. Some laboratory correlates of drinking habits. Ann Clin Biochem 1978; 15:297.
- Navina S, Acharya C, DeLany JP, et al. Lipotoxicity causes multisystem organ failure and exacerbates acute pancreatitis in obesity. Sci Transl Med 2011; 3:107ra110.
- Yang F, Wang Y, Sternfeld L, et al. The role of free fatty acids, pancreatic lipase and Ca+ signalling in injury of isolated acinar cells and pancreatitis model in lipoprotein lipase-deficient mice. Acta Physiol (Oxf) 2009; 195:13.
- Dominguez-Muñoz JE, Malfertheiner P, Ditschuneit HH, et al. Hyperlipidemia in acute pancreatitis. Relationship with etiology, onset, and severity of the disease. Int J Pancreatol 1991; 10:261.
- Deng LH, Xue P, Xia Q, et al. Effect of admission hypertriglyceridemia on the episodes of severe acute pancreatitis. World J Gastroenterol 2008; 14:4558.
- Alagözlü H, Cindoruk M, Karakan T, Unal S. Heparin and insulin in the treatment of hypertriglyceridemia-induced severe acute pancreatitis. Dig Dis Sci 2006; 51:931.
- Durrington P. Dyslipidaemia. Lancet 2003; 362:717.
- Nayak KR, Daly RG. Images in clinical medicine. Eruptive xanthomas associated with hypertriglyceridemia and new-onset diabetes mellitus. N Engl J Med 2004; 350:1235.
- Kumar J, Wierzbicki AS. Images in clinical medicine. Lipemia retinalis. N Engl J Med 2005; 353:823.
- Howard JM, Reed J. Pseudohyponatremia in acute hyperlipemic pancreatitis. A potential pitfall in therapy. Arch Surg 1985; 120:1053.
- Fallat RW, Vester JW, Glueck CJ. Suppression of amylase activity by hypertriglyceridemia. JAMA 1973; 225:1331.
- Yadav D, Pitchumoni CS. Issues in hyperlipidemic pancreatitis. J Clin Gastroenterol 2003; 36:54.
- Jain D, Zimmerschied J. Heparin and insulin for hypertriglyceridemia-induced pancreatitis: case report. ScientificWorldJournal 2009; 9:1230.
- Henzen C, Röck M, Schnieper C, Heer K. [Heparin and insulin in the treatment of acute hypertriglyceridemia-induced pancreatitis]. Schweiz Med Wochenschr 1999; 129:1242.
- Berger Z, Quera R, Poniachik J, et al. [heparin and insulin treatment of acute pancreatitis caused by hypertriglyceridemia. Experience of 5 cases]. Rev Med Chil 2001; 129:1373.
- Jabbar MA, Zuhri-Yafi MI, Larrea J. Insulin therapy for a non-diabetic patient with severe hypertriglyceridemia. J Am Coll Nutr 1998; 17:458.
- Mikhail N, Trivedi K, Page C, et al. Treatment of severe hypertriglyceridemia in nondiabetic patients with insulin. Am J Emerg Med 2005; 23:415.
- Tamez-Pérez HE, Sáenz-Gallegos R, Hernández-Rodríguez K, et al. [Insulin therapy in patients with severe hypertriglyceridemia]. Rev Med Inst Mex Seguro Soc 2006; 44:235.
- Betteridge DJ, Bakowski M, Taylor KG, et al. Treatment of severe diabetic hypertriglyceridaemia by plasma exchange. Lancet 1978; 1:1368.
- Chait A, Eckel RH. The Chylomicronemia Syndrome Is Most Often Multifactorial: A Narrative Review of Causes and Treatment. Ann Intern Med 2019; 170:626.
- Ipe TS, Pham HP, Williams LA 3rd. Critical updates in the 7th edition of the American Society for Apheresis guidelines. J Clin Apher 2018; 33:78.
- Furuya T, Komatsu M, Takahashi K, et al. Plasma exchange for hypertriglyceridemic acute necrotizing pancreatitis: report of two cases. Ther Apher 2002; 6:454.
- Stefanutti C, Di Giacomo S, Labbadia G. Timing clinical events in the treatment of pancreatitis and hypertriglyceridemia with therapeutic plasmapheresis. Transfus Apher Sci 2011; 45:3.
- Kyriakidis AV, Raitsiou B, Sakagianni A, et al. Management of acute severe hyperlipidemic pancreatitis. Digestion 2006; 73:259.
- Bae JH, Baek SH, Choi HS, et al. Acute pancreatitis due to hypertriglyceridemia: report of 2 cases. Korean J Gastroenterol 2005; 46:475.
- Bolan C, Oral EA, Gorden P, et al. Intensive, long-term plasma exchange therapy for severe hypertriglyceridemia in acquired generalized lipoatrophy. J Clin Endocrinol Metab 2002; 87:380.
- Chen JH, Yeh JH, Lai HW, Liao CS. Therapeutic plasma exchange in patients with hyperlipidemic pancreatitis. World J Gastroenterol 2004; 10:2272.
- Iskandar SB, Olive KE. Plasmapheresis as an adjuvant therapy for hypertriglyceridemia-induced pancreatitis. Am J Med Sci 2004; 328:290.
- Kadikoylu G, Yavasoglu I, Bolaman Z. Plasma exchange in severe hypertriglyceridemia a clinical study. Transfus Apher Sci 2006; 34:253.
- Kyriakidis AV, Karydakis P, Neofytou N, et al. Plasmapheresis in the management of acute severe hyperlipidemic pancreatitis: report of 5 cases. Pancreatology 2005; 5:201.
- Lennertz A, Parhofer KG, Samtleben W, Bosch T. Therapeutic plasma exchange in patients with chylomicronemia syndrome complicated by acute pancreatitis. Ther Apher 1999; 3:227.
- Mao EQ, Tang YQ, Zhang SD. Formalized therapeutic guideline for hyperlipidemic severe acute pancreatitis. World J Gastroenterol 2003; 9:2622.
- Yeh JH, Chen JH, Chiu HC. Plasmapheresis for hyperlipidemic pancreatitis. J Clin Apher 2003; 18:181.
- Kohli RS, Bleibel W, Shetty A, Dhanjal U. Plasmapheresis in the treatment of hypertriglyceridemic pancreatitis with ARDS. Dig Dis Sci 2006; 51:2287.
- Click B, Ketchum AM, Turner R, et al. The role of apheresis in hypertriglyceridemia-induced acute pancreatitis: A systematic review. Pancreatology 2015; 15:313.
- Gubensek J, Buturovic-Ponikvar J, Romozi K, Ponikvar R. Factors affecting outcome in acute hypertriglyceridemic pancreatitis treated with plasma exchange: an observational cohort study. PLoS One 2014; 9:e102748.
- Berberich AJ, Ziada A, Zou GY, Hegele RA. Conservative management in hypertriglyceridemia-associated pancreatitis. J Intern Med 2019; 286:644.
- Webb CB, Leveno M, Quinn AM, Burner J. Effect of TPE vs medical management on patient outcomes in the setting of hypertriglyceridemia-induced acute pancreatitis with severely elevated triglycerides. J Clin Apher 2021; 36:719.
- Gavva C, Sarode R, Agrawal D, Burner J. Therapeutic plasma exchange for hypertriglyceridemia induced pancreatitis: A rapid and practical approach. Transfus Apher Sci 2016; 54:99.
- Ali AS. Insulin can be used to treat severe hypertriglyceridaemia in pregnant women without diabetes. BMJ Case Rep 2021; 14.
- Marić N, Mačković M, Bakula M, et al. Hypertriglyceridemia-induced pancreatitis treated with continuous insulin infusion-Case series. Clin Endocrinol (Oxf) 2022; 96:139.
- Kitabchi AE, Umpierrez GE, Miles JM, Fisher JN. Hyperglycemic crises in adult patients with diabetes. Diabetes Care 2009; 32:1335.
- Rawla P, Sunkara T, Thandra KC, Gaduputi V. Hypertriglyceridemia-induced pancreatitis: updated review of current treatment and preventive strategies. Clin J Gastroenterol 2018; 11:441.
- Eckel RH. Lipoprotein lipase. A multifunctional enzyme relevant to common metabolic diseases. N Engl J Med 1989; 320:1060.
- Goldberg IJ. Lipoprotein lipase and lipolysis: central roles in lipoprotein metabolism and atherogenesis. J Lipid Res 1996; 37:693.
- Dai J, Jiang M, Hu Y, et al. Dysregulated SREBP1c/miR-153 signaling induced by hypertriglyceridemia worsens acute pancreatitis and delays tissue repair. JCI Insight 2021; 6.
- Näsström B, Olivecrona G, Olivecrona T, Stegmayr BG. Lipoprotein lipase during continuous heparin infusion: tissue stores become partially depleted. J Lab Clin Med 2001; 138:206.
- Weintraub M, Rassin T, Eisenberg S, et al. Continuous intravenous heparin administration in humans causes a decrease in serum lipolytic activity and accumulation of chylomicrons in circulation. J Lipid Res 1994; 35:229.
- Sleth JC, Lafforgue E, Servais R, et al. [A case of hypertriglycideremia-induced pancreatitis in pregnancy: value of heparin]. Ann Fr Anesth Reanim 2004; 23:835.
- Loo CC, Tan JY. Decreasing the plasma triglyceride level in hypertriglyceridemia-induced pancreatitis in pregnancy: a case report. Am J Obstet Gynecol 2002; 187:241.
- Achard JM, Westeel PF, Moriniere P, et al. Pancreatitis related to severe acute hypertriglyceridemia during pregnancy: treatment with lipoprotein apheresis. Intensive Care Med 1991; 17:236.
- Yamauchi H, Sunamura M, Takeda K, et al. Hyperlipidemia and pregnancy associated pancreatitis with reference to plasma exchange as a therapeutic intervention. Tohoku J Exp Med 1986; 148:197.
- Gürsoy A, Kulaksizoglu M, Sahin M, et al. Severe hypertriglyceridemia-induced pancreatitis during pregnancy. J Natl Med Assoc 2006; 98:655.
- Lykkesfeldt G, Bock JE, Pedersen FD, et al. Excessive hypertriglyceridemia and pancreatitis in pregnancy. Association with deficiency of lipoprotein lipase. Acta Obstet Gynecol Scand 1981; 60:79.

BÌNH LUẬN