Mục tiêu học tập:
- Hiểu dịch tễ học toàn cầu và các phương thức lây truyền của virus viêm gan B (HBV)
- Mô tả diễn biến tự nhiên và các giai đoạn lâm sàng của nhiễm HBV
- Nhận biết các biểu hiện lâm sàng và biến chứng của nhiễm HBV cấp tính và mãn tính
- Giải thích các xét nghiệm chẩn đoán nhiễm HBV và mức độ nghiêm trọng của bệnh gan
- Đánh giá các lựa chọn điều trị hiện tại đối với nhiễm HBV mạn tính
- Xác định các chiến lược ngăn ngừa lây truyền HBV và bệnh gan liên quan đến HBV
Giới thiệu:
Nhiễm virus viêm gan B (HBV) là một vấn đề sức khỏe cộng đồng toàn cầu, ước tính có khoảng 296 triệu người trên toàn thế giới đang sống chung với nhiễm HBV mạn tính [1]. HBV là nguyên nhân hàng đầu gây viêm gan mạn tính, xơ gan và ung thư biểu mô tế bào gan (HCC), dẫn đến tỷ lệ mắc bệnh và tử vong đáng kể. Mặc dù đã có vắc-xin hiệu quả và các liệu pháp kháng vi-rút mạnh, HBV vẫn là gánh nặng lớn về sức khỏe, đặc biệt là ở các khu vực lưu hành bệnh như Châu Á và Châu Phi.
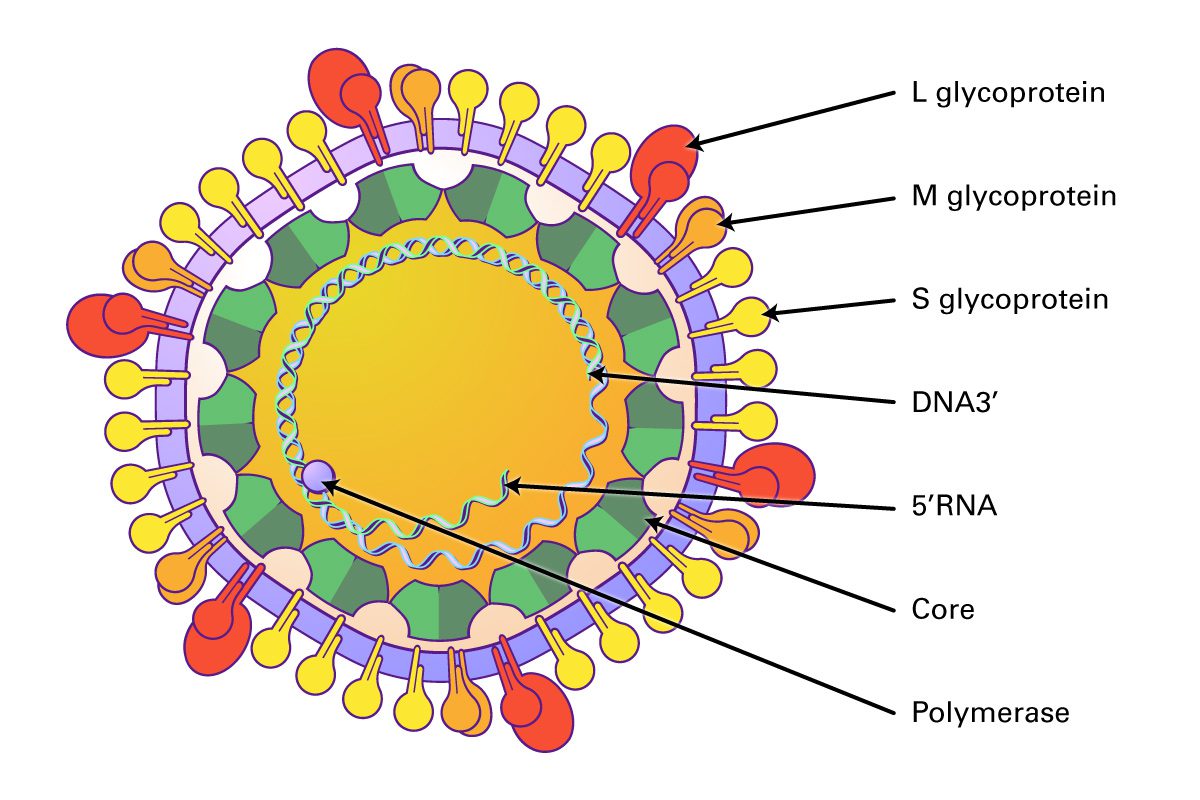
Cấu trúc của virus viêm gan B
Virus viêm gan B (HBV) là một loại virus DNA phức tạp, có vỏ bọc thuộc họ Hepadnaviridae. Cấu trúc của nó bao gồm một số thành phần chính:
- Vỏ bọc: Lớp ngoài cùng của virus là lớp vỏ lipid kép có nguồn gốc từ màng tế bào chủ. Gắn bên trong lớp vỏ này là ba loại protein bề mặt: a. Protein bề mặt viêm gan B lớn (LHBs) b. Protein bề mặt viêm gan B loại trung (MHB) c. Protein bề mặt viêm gan B nhỏ (SHB) Những protein bề mặt này đóng vai trò quan trọng trong sự xâm nhập, lắp ráp và tạo miễn dịch của virus.
- Nucleocapsid: Bao bọc bên trong lớp vỏ là nucleocapsid 2 mặt hoặc hạt lõi, bao gồm nhiều bản sao của protein lõi viêm gan B (HBc). Protein cốt lõi rất cần thiết cho quá trình lắp ráp và đóng gói bộ gen của virus.
- Bộ gen của virus: Bên trong nucleocapsid là bộ gen của virus, bao gồm một phân tử DNA vòng tròn (rcDNA) sợi đôi, có chiều dài khoảng 3,2 kb. RCDNA có một chuỗi trừ (-) hoàn chỉnh và một chuỗi cộng (+) không đầy đủ, có một khoảng trống trên chuỗi cộng. Đầu 5′ của sợi âm được liên kết cộng hóa trị với polymerase của virus.
- Polymerase: HBV polymerase là một enzyme đa chức năng được gắn cộng hóa trị vào đầu 5′ của chuỗi âm của RCDNA. Nó sở hữu các hoạt động DNA polymerase phụ thuộc DNA, enzyme sao chép ngược và RNase H, rất cần thiết cho sự nhân lên của virus.
- Kháng nguyên e viêm gan B (HBeAg): HBeAg là một protein hòa tan, phi cấu trúc được tiết ra bởi các tế bào bị nhiễm bệnh. Nó có nguồn gốc từ gen tiền lõi/lõi và đóng vai trò là dấu hiệu đánh dấu sự nhân lên tích cực của virus. Sự hiện diện của HBeAg trong huyết thanh cho thấy khả năng lây nhiễm cao.
- Protein viêm gan B x (HBx): HBx là một protein nhỏ, đa chức năng, cần thiết cho sự nhân lên của virus và có liên quan đến sự phát triển của ung thư biểu mô tế bào gan liên quan đến HBV. Nó điều chỉnh các quá trình tế bào khác nhau, bao gồm phiên mã, truyền tín hiệu và apoptosis.
Ngoài virion trưởng thành có khả năng lây nhiễm (hạt Dane), các tế bào bị nhiễm HBV còn tạo ra hai loại hạt dưới virus:
- Các hạt hình cầu: Đây là những hạt vỏ rỗng, không lây nhiễm, bao gồm chủ yếu là SHB và thiếu nucleocapsid và bộ gen của virus.
- Các hạt dạng sợi: Đây cũng là các hạt không lây nhiễm, dạng sợi hoặc hình ống có chứa SHB và lượng LHB và MHB khác nhau.
Cả các hạt hình cầu và dạng sợi đều được sản xuất với số lượng lớn so với các hạt Dane truyền nhiễm và được cho là có vai trò trong việc trốn tránh hệ miễn dịch và sự tồn tại của nhiễm HBV.
Hiểu cấu trúc và các thành phần của HBV là rất quan trọng để làm sáng tỏ chu kỳ nhân lên, cơ chế bệnh sinh của nó và sự phát triển các liệu pháp kháng vi-rút và vắc-xin hiệu quả.
Cấu trúc của virus viêm gan B (HBV) đặt ra một số thách thức khiến việc phát triển phác đồ điều trị trở nên khó khăn. Những lý do chính tại sao hiện nay không có cách chữa khỏi bệnh viêm gan B là:
- Sự tồn tại của cccDNA: HBV thiết lập một nhóm DNA vòng tròn đóng cộng hóa trị (cccDNA) ổn định trong nhân tế bào gan bị nhiễm bệnh. CccDNA đóng vai trò là khuôn mẫu để phiên mã virus và tồn tại ngay cả trong quá trình điều trị bằng thuốc kháng vi-rút. Các chất chống vi-rút hiện tại, chẳng hạn như chất tương tự nucleos(t)ide, ức chế sự nhân lên của vi-rút nhưng không trực tiếp nhắm mục tiêu hoặc loại bỏ cccDNA. Kết quả là, virus có thể hoạt động trở lại sau khi ngừng điều trị, khiến việc điều trị khỏi hoàn toàn trở nên khó khăn.
- Sự tích hợp của virus: HBV DNA có thể tích hợp vào bộ gen của tế bào chủ, dẫn đến việc sản xuất các protein của virus, chẳng hạn như kháng nguyên bề mặt viêm gan B (HBsAg), ngay cả khi virus không hoạt động nhân lên. DNA HBV tích hợp không được nhắm mục tiêu bởi các liệu pháp chống vi-rút hiện tại và có thể góp phần vào sự phát triển của ung thư biểu mô tế bào gan (HCC).
- Trốn tránh hệ thống miễn dịch: HBV đã phát triển các chiến lược để trốn tránh phản ứng miễn dịch của vật chủ, điều này rất quan trọng để loại bỏ virus. Kháng nguyên e viêm gan B (HBeAg) và một lượng lớn các hạt dưới virus (các hạt hình cầu và dạng sợi) có thể đóng vai trò là mồi nhử miễn dịch, làm suy yếu và định hướng sai hệ thống miễn dịch. Ngoài ra, HBV polymerase thiếu hoạt động hiệu đính, dẫn đến tỷ lệ đột biến cao và xuất hiện các biến thể trốn thoát miễn dịch.
- Đáp ứng miễn dịch hạn chế: Nhiễm HBV mạn tính được đặc trưng bởi phản ứng tế bào T yếu và không hiệu quả. Các tế bào T cạn kiệt biểu hiện các thụ thể ức chế, chẳng hạn như PD-1, làm giảm khả năng loại bỏ vi rút của chúng. Khôi phục phản ứng mạnh mẽ và chức năng của tế bào T là một thách thức lớn trong việc đạt được phương pháp chữa khỏi bệnh viêm gan B.
- Kích hoạt lại virus: HBV có thể gây nhiễm trùng tiềm ẩn ở gan, có khả năng tái hoạt động trong thời gian ức chế miễn dịch, chẳng hạn như trong quá trình hóa trị hoặc điều trị ức chế miễn dịch. Sự hiện diện của cccDNA và DNA virus tích hợp cho phép virus hoạt động trở lại thậm chí nhiều năm sau khi tình trạng nhiễm trùng đã được giải quyết rõ ràng.
- Thiếu thuốc kháng vi-rút tác dụng trực tiếp: Không giống như vi-rút viêm gan C (HCV), trong đó thuốc kháng vi-rút tác dụng trực tiếp (DAA) đã cách mạng hóa tỷ lệ điều trị và chữa khỏi, hiện tại không có DAA nào được phê duyệt nhắm mục tiêu cụ thể vào protein HBV hoặc cccDNA. Sự phát triển của các tác nhân như vậy là một lĩnh vực nghiên cứu tích cực nhưng đã bị cản trở bởi cấu trúc và vòng đời phức tạp của HBV.
Bất chấp những thách thức này, nghiên cứu đang tiến hành vẫn tập trung vào việc phát triển các liệu pháp mới có thể đạt được phương pháp chữa trị chức năng cho bệnh viêm gan B, đặc trưng là mất HBsAg kéo dài và HBV DNA không thể phát hiện được. Các chiến lược đang được khám phá bao gồm nhắm mục tiêu cccDNA, tăng cường phản ứng miễn dịch và xác định các mục tiêu chống vi-rút mới. Tuy nhiên, cấu trúc đặc biệt và vòng đời của HBV tiếp tục đặt ra những trở ngại đáng kể trong việc tìm kiếm phác đồ điều trị triệt căn.
Dịch tễ học:
Tỷ lệ nhiễm HBV trên toàn cầu rất khác nhau, với tỷ lệ cao nhất được quan sát thấy ở châu Phi cận Sahara và Đông Á, nơi 5-10% dân số trưởng thành bị nhiễm mạn tính [2]. Ngược lại, tỷ lệ nhiễm HBV mạn tính thấp hơn 1% ở Tây Âu và Bắc Mỹ [2]. Trên toàn cầu, kiểu gen HBV A và D chiếm ưu thế, tiếp theo là kiểu gen B và C, phổ biến hơn ở châu Á [3]. Các con đường lây truyền HBV chính khác nhau tùy theo vùng địa lý và tỷ lệ lưu hành. Ở những khu vực có tỷ lệ mắc bệnh cao, lây truyền chu sinh từ mẹ bị nhiễm sang con và lây truyền ngang trong thời thơ ấu là phương thức lây nhiễm chính [4]. Ở các quốc gia có tỷ lệ nhiễm thấp, HBV chủ yếu lây lan qua quan hệ tình dục và tiêm chích ma túy [4]. Lây truyền liên quan đến chăm sóc sức khỏe có thể xảy ra ở bất kỳ môi trường nào, điều này nhấn mạnh tầm quan trọng của các biện pháp phòng ngừa phổ quát và thực hành tiêm an toàn.
Diễn biến tự nhiên:
Diễn biến tự nhiên của nhiễm HBV rất phức tạp và thay đổi, bị ảnh hưởng bởi các yếu tố như tuổi nhiễm bệnh, yếu tố virus và đáp ứng miễn dịch của vật chủ. Nhiễm HBV cấp tính thường không có triệu chứng hoặc nhẹ ở trẻ em và thanh niên nhưng có thể gây viêm gan có triệu chứng ở người lớn tuổi. Phần lớn (90-95%) nhiễm trùng cấp tính ở người trưởng thành có hệ miễn dịch bình thường là tự giới hạn, với sự thanh thải kháng nguyên bề mặt HBV (HBsAg) trong vòng 6 tháng [5]. Tuy nhiên, lây truyền chu sinh dẫn đến nhiễm HBV mạn tính ở 90% trẻ sinh ra từ bà mẹ có HBeAg dương tính [5].
Nhiễm HBV mạn tính là một quá trình động có thể được chia thành bốn giai đoạn dựa trên tình trạng HBeAg, nồng độ HBV DNA, nồng độ ALT và mô học gan (Bảng 1) [6]. Giai đoạn dung nạp miễn dịch, đặc trưng bởi nồng độ HBV DNA cao, ALT bình thường và tình trạng viêm gan ở mức tối thiểu, có thể kéo dài hàng thập kỷ ở những người nhiễm bệnh chu sinh. Giai đoạn hoạt động miễn dịch, hay viêm gan B mạn tính dương tính với HBeAg, được đánh dấu bằng ALT tăng cao, nồng độ HBV DNA cao và viêm gan hoạt động. Chuyển đổi huyết thanh từ HBeAg sang anti-HBe đánh dấu sự chuyển đổi sang giai đoạn mang không hoạt động, với HBV DNA thấp hoặc không thể phát hiện được và ALT bình thường. Tuy nhiên, một số bệnh nhân có thể bước vào giai đoạn viêm gan B mạn tính HBeAg âm tính với nồng độ HBV DNA và ALT dao động và xơ gan tiến triển. Các giai đoạn này không nhất thiết phải tuần tự và có thể xảy ra chuyển đổi huyết thanh ngược.
Bảng 1. Đặc điểm của các giai đoạn nhiễm HBV mạn tính [6]
| Giai đoạn | HBsAg | HBeAg | ADN HBV (IU/mL) | ALT | Mô học gan |
|---|---|---|---|---|---|
| Dung nạp miễn dịch | + | + | >10^7 | Bình thường | Viêm và xơ hóa tối thiểu |
| Hoạt động miễn dịch (viêm gan B mãn tính có HBeAg dương tính) | + | + | 10^4-10^7 | Cao | Viêm và xơ hóa từ trung bình đến nặng |
| Người mang virus không hoạt động | + | – | <2.000 | Bình thường | Viêm và xơ hóa tối thiểu |
| Viêm gan B mạn tính HBeAg âm tính | + | – | >2.000 | Cao | Viêm và xơ hóa thay đổi |
Biểu hiện lâm sàng:
Nhiễm HBV cấp tính không có triệu chứng ở 70% người trưởng thành, trong khi số còn lại có thể gặp các triệu chứng không đặc hiệu như mệt mỏi, buồn nôn, đau bụng và vàng da [7]. Viêm gan tối cấp, đặc trưng bởi bệnh não gan và rối loạn đông máu, xảy ra ở 0,1-0,5% số ca nhiễm trùng cấp tính và có tỷ lệ tử vong cao [7].
Nhiễm HBV mạn tính thường không có triệu chứng trong nhiều thập kỷ. Khi xuất hiện, các triệu chứng thường nhẹ và không đặc hiệu, chẳng hạn như mệt mỏi và khó chịu ở hạ sườn phải. Sự phát triển của xơ gan có thể dẫn đến các dấu hiệu tăng áp lực tĩnh mạch cửa và mất bù gan, bao gồm cổ trướng, chảy máu do giãn tĩnh mạch và bệnh não. HCC có thể xảy ra ở cả bệnh nhân xơ gan và không xơ gan có HBV mạn tính, nhấn mạnh sự cần thiết phải theo dõi thường xuyên. Các biểu hiện ngoài gan của nhiễm HBV bao gồm viêm đa động mạch, viêm cầu thận và cryoglobulin máu hỗn hợp, mặc dù những biểu hiện này ít phổ biến hơn so với nhiễm HCV [8].
Chẩn đoán:
Chẩn đoán nhiễm HBV dựa vào các dấu hiệu huyết thanh và virus học. Ba dấu hiệu huyết thanh HBV chính là HBsAg, kháng thể bề mặt viêm gan B (anti-HBs) và kháng thể lõi viêm gan B tổng số (anti-HBc). HBsAg là dấu hiệu đặc trưng của nhiễm trùng cấp tính hoặc mãn tính, trong khi anti-HBs biểu thị khả năng miễn dịch do tiêm chủng hoặc nhiễm trùng đã khỏi. Anti-HBc xuất hiện sớm trong nhiễm trùng cấp tính và tồn tại suốt đời. Sự hiện diện của IgM anti-HBc giúp phân biệt nhiễm trùng cấp tính và mãn tính. Trong HBV mạn tính, các dấu hiệu bổ sung bao gồm kháng nguyên viêm gan B e (HBeAg) và kháng thể (anti-HBe), cung cấp thông tin về sự nhân lên của virus và giai đoạn bệnh (Bảng 2) [9].
Bảng 2. Giải thích các dấu hiệu huyết thanh của HBV [9]
| HBsAg | Kháng thể HBc | Anti-HBs | Diễn dịch |
|---|---|---|---|
| – | – | – | Dễ bị tổn thương |
| – | – | + | Miễn dịch nhờ tiêm chủng |
| – | + | + | Miễn dịch do nhiễm trùng tự nhiên |
| – | + | – | Anti-HBc đơn độc (nhiễm trùng, suy giảm miễn dịch hoặc dương tính giả) |
| + | + | – | Nhiễm HBV cấp tính hoặc mãn tính |
Ở những bệnh nhân mắc HBV mạn tính, việc định lượng nồng độ HBV DNA là điều cần thiết để xác định mức độ hoạt động của bệnh, hướng dẫn các quyết định điều trị và theo dõi phản ứng kháng virus. Khuyến cáo nên sử dụng các xét nghiệm dựa trên PCR nhạy cảm với giới hạn phát hiện thấp hơn là 10-20 IU/mL [10]. Kiểu gen HBV có thể cung cấp thông tin tiên lượng và hướng dẫn lựa chọn liệu pháp kháng vi-rút, đặc biệt là với peginterferon [10].
Tất cả bệnh nhân nhiễm HBV mạn tính cần được đánh giá toàn diện về mức độ nghiêm trọng của bệnh gan. Các đánh giá được đề xuất bao gồm các xét nghiệm sinh hóa gan (ALT, AST, bilirubin, albumin), công thức máu toàn phần và các dấu hiệu chức năng tổng hợp (INR) [10]. Các phương pháp không xâm lấn để đánh giá tình trạng xơ hóa, chẳng hạn như đo độ đàn hồi thoáng qua (FibroScan) và bảng dấu ấn sinh học huyết thanh (FIB-4, APRI), ngày càng được sử dụng thay cho sinh thiết gan [11]. Bệnh nhân xơ gan nên được sàng lọc các biến chứng, bao gồm HCC, giãn tĩnh mạch và loãng xương.
Điều trị:
Dưới đây là những khuyến nghị chi tiết hơn và hướng dẫn điều trị cập nhật đối với bệnh viêm gan B, dựa trên hướng dẫn mới nhất của Hiệp hội Nghiên cứu Bệnh Gan Hoa Kỳ (AASLD) [1] và Hiệp hội Nghiên cứu Gan Châu Âu (EASL) [2] :
Chỉ định điều trị:
Quyết định bắt đầu điều trị bằng thuốc kháng vi-rút dựa trên sự kết hợp giữa tình trạng HBeAg, nồng độ HBV DNA, nồng độ ALT và sự hiện diện của xơ gan hoặc hoạt động mô học đáng kể. AASLD khuyến nghị xem xét điều trị trong các tình huống sau [1]:
- Viêm gan B mạn tính hoạt động miễn dịch (HBeAg dương tính hoặc âm tính) với HBV DNA ≥2.000 IU/mL và ALT tăng cao
- Bệnh nhân trên 40 tuổi có HBV mạn tính HBeAg âm tính, HBV DNA ≥2.000 IU/mL và ALT bình thường, thậm chí không có bằng chứng rõ ràng về bệnh xơ gan
- Bệnh nhân có HBV DNA ≥20.000 IU/mL và ALT >2 lần giới hạn trên của mức bình thường, bất kể tình trạng HBeAg
- Bệnh nhân xơ gan còn bù và có thể phát hiện được HBV DNA, bất kể mức ALT
- Bệnh nhân xơ gan mất bù, bất kể nồng độ HBV DNA hay ALT
Hướng dẫn EASL có các khuyến nghị tương tự nhưng sử dụng ngưỡng HBV DNA cao hơn (>20.000 IU/mL) cho bệnh nhân dương tính với HBeAg và ngưỡng thấp hơn (>2.000 IU/mL) cho bệnh nhân âm tính với HBeAg [2].
Lựa chọn thuốc kháng vi-rút:
Entecavir, tenofovir disoproxil fumarate (TDF) và tenofovir alafenamide (TAF) là những thuốc hàng đầu được ưu tiên điều trị HBV mạn tính do hiệu lực cao và nguy cơ kháng thuốc thấp [1,2]. Việc lựa chọn giữa các thuốc này phụ thuộc vào các yếu tố như chức năng thận, mật độ khoáng của xương và chi phí. TAF ít gây độc cho thận và xương hơn so với TDF và được ưu tiên sử dụng ở những bệnh nhân có nguy cơ mắc các biến chứng này [3]. Pegylat interferon có thể được xem xét ở những bệnh nhân chọn lọc, đặc biệt là những bệnh nhân trẻ bị nhiễm kiểu gen A, ALT cao và nồng độ HBV DNA thấp [1].
Bảng 3. Các loại thuốc điều trị kháng virus viêm gan B
| Chất chống vi-rút | Tên biệt dược | Nhóm | Liều lượng | Chỉ định | Đặc điểm chính | Tác dụng phụ | Giám sát | Chống chỉ định | Quá trình điều trị |
|---|---|---|---|---|---|---|---|---|---|
| Entecavir (ETV) | Baraclude | Chất tương tự nucleoside | 0,5 mg mỗi ngày (chưa từng điều trị) 1 mg mỗi ngày (đã từng dùng lamivudine) | Điều trị đầu tiên đối với HBV mạn tính | – Hiệu lực cao – Nguy cơ kháng thuốc thấp – Dung nạp tốt | – Nhiễm toan lactic (hiếm) – Suy thận | – Chức năng thận – Triệu chứng nhiễm toan lactic | – Quá mẫn với entecavir | – Điều trị lâu dài – Có thể cân nhắc ngừng thuốc sau khi chuyển đổi huyết thanh HBeAg và ức chế virus kéo dài |
| Tenofovir disoproxil fumarate (TDF) | Viread | Chất tương tự nucleotide | 300 mg mỗi ngày | Điều trị đầu tiên đối với HBV mạn tính | – Hiệu lực cao
– Nguy cơ kháng thuốc thấp – Dung nạp tốt |
– Suy thận – Mất mật độ xương – Nhiễm axit lactic (hiếm) | – Chức năng thận – Mật độ khoáng xương – Triệu chứng nhiễm toan lactic | – Quá mẫn với tenofovir – Suy thận nặng (CrCl < 30 mL/phút) | – Điều trị lâu dài – Có thể cân nhắc ngừng thuốc sau khi chuyển đổi huyết thanh HBeAg và ức chế virus kéo dài |
| Tenofovir alafenamide (TAF) | Vemlidy | Chất tương tự nucleotide | 25 mg mỗi ngày | Điều trị đầu tiên đối với HBV mạn tính | – Hiệu lực cao – Nguy cơ kháng thuốc thấp – Ít độc tính trên thận và xương hơn so với TDF | – Đau đầu – Đau bụng – Buồn nôn – Tiêu chảy | – Chức năng thận – Mật độ khoáng xương – Triệu chứng nhiễm toan lactic | – Quá mẫn với tenofovir – Suy gan nặng (Child-Pugh C) | – Điều trị lâu dài – Có thể cân nhắc ngừng thuốc sau khi chuyển đổi huyết thanh HBeAg và ức chế virus kéo dài |
| Lamivudin (LAM) | Epivir, Zeffix, Heptodin | Chất tương tự nucleoside | 100 mg mỗi ngày | – Điều trị bậc hai đối với HBV mạn tính – Liệu pháp phối hợp với adefovir ở bệnh nhân HBV kháng lamivudine | – Hiệu lực vừa phải – Nguy cơ kháng thuốc cao – Dung nạp tốt | – Nhiễm toan lactic (hiếm) – Suy thận | – Chức năng thận – Triệu chứng nhiễm toan lactic | – Quá mẫn với lamivudine | – Điều trị lâu dài – Không nên ngừng thuốc do nguy cơ kháng thuốc cao |
| Adefovir Dipivoxil (ADV) | Hepsera | Chất tương tự nucleotide | 10 mg mỗi ngày | – Điều trị bậc hai đối với HBV mạn tính – Điều trị phối hợp với lamivudine ở bệnh nhân HBV kháng lamivudine | – Hiệu lực vừa phải – Nguy cơ kháng thuốc trung bình – Độc thận ở liều cao hơn | – Suy thận – Hội chứng Fanconi – Nhiễm toan lactic (hiếm) | – Chức năng thận – Phosphat huyết thanh – Triệu chứng nhiễm toan lactic | – Quá mẫn với adefovir – Suy thận nặng (CrCl < 30 mL/phút) | – Điều trị lâu dài – Không nên ngừng thuốc do nguy cơ kháng thuốc |
| Telbivudine (LdT) | Sebivo, Tyzeka | Chất tương tự nucleoside | 600 mg mỗi ngày | Điều trị bậc hai đối với HBV mạn tính | – Hiệu lực vừa phải – Nguy cơ kháng thuốc trung bình – Dung nạp tốt | – Bệnh cơ – Bệnh thần kinh ngoại biên – Nhiễm toan lactic (hiếm) – Suy thận | – Chức năng thận – Creatin kinase
– Triệu chứng nhiễm toan lactic |
– Quá mẫn với telbivudine – Bệnh cơ hoặc bệnh thần kinh ngoại biên | – Điều trị lâu dài – Không nên ngừng thuốc do nguy cơ kháng thuốc |
| Pegylat interferon-alpha (PEG-IFN) | Pegasys (PEG-IFN-2a), PegIntron (PEG-IFN-2b) | điều hòa miễn dịch | 180 mcg hàng tuần (PEG-IFN-2a) 1,5 mcg/kg hàng tuần (PEG-IFN-2b) | – Liệu pháp giới hạn đối với HBV mạn tính – Cân nhắc đối với bệnh nhân trẻ nhiễm kiểu gen A, ALT cao và HBV DNA thấp | – Thời gian hữu hạn – Khả năng mất HBeAg và HBsAg – Tác dụng phụ đáng kể | – Triệu chứng giống cúm – Đau cơ – Mệt mỏi – Trầm cảm – Giảm tế bào | – Công thức máu toàn phần – Chức năng tuyến giáp – Sức khỏe tâm thần – Rối loạn tự miễn dịch | – Xơ gan mất bù – Trầm cảm nặng hoặc bệnh tâm thần – Bệnh tự miễn – Mang thai – Giảm tế bào chất nặng | – Thời gian hữu hạn (48 tuần) – Có thể xem xét ngừng thuốc nếu không có phản hồi sau 24 tuần |
CrCl: Độ thanh thải creatinin; ALT: Alanine aminotransferase; HBeAg: Kháng nguyên e viêm gan B; HBsAg: Kháng nguyên bề mặt viêm gan B
Lưu ý: Việc lựa chọn thuốc kháng vi-rút nên được cá nhân hóa dựa trên các yếu tố như tình trạng HBeAg, nồng độ HBV DNA, mức ALT, sự hiện diện của bệnh xơ gan, tiền sử điều trị trước đó, bệnh đi kèm (ví dụ như suy thận, loãng xương) và sở thích của bệnh nhân. Điều trị kết hợp với nhiều thuốc kháng vi-rút thường không được khuyến khích do thiếu lợi ích đã được chứng minh và tăng nguy cơ tác dụng phụ. Tuy nhiên, trong những trường hợp đã xác nhận kháng thuốc kháng vi-rút, việc bổ sung một tác nhân thứ hai có đặc điểm kháng thuốc bổ sung có thể là cần thiết để đạt được sự ức chế vi-rút. Thời gian điều trị thường kéo dài đối với các chất tương tự nucleos(t)ide, vì thường tái phát khi ngừng thuốc. Liệu pháp hữu hạn bằng PEG-IFN có thể được xem xét ở một số bệnh nhân chọn lọc, nhưng phần lớn sẽ cần điều trị vô thời hạn bằng thuốc kháng vi-rút đường uống để duy trì sự ức chế vi-rút và ngăn ngừa tiến triển của bệnh.
Theo dõi trong quá trình điều trị:
Bệnh nhân đang điều trị bằng thuốc kháng vi-rút nên kiểm tra nồng độ HBV DNA và ALT 3-6 tháng một lần để đánh giá đáp ứng điều trị và tuân thủ điều trị [1,2]. HBeAg và anti-HBe nên được theo dõi 6-12 tháng một lần ở những bệnh nhân có HBeAg dương tính. Bệnh nhân có nguy cơ bị biến chứng thận hoặc xương nên được theo dõi định kỳ chức năng thận và mật độ khoáng của xương. Nên sàng lọc HCC bằng siêu âm 6 tháng một lần đối với bệnh nhân xơ gan hoặc có các yếu tố nguy cơ khác.
Mục tiêu điều trị và ngừng điều trị:
Mục tiêu cuối cùng của điều trị là mất HBsAg hoặc chuyển đổi huyết thanh, nhưng mục tiêu này đạt được ở một số ít bệnh nhân. Các kết quả cuối cùng thực tế bao gồm ức chế virus kéo dài (HBV DNA <10-20 IU/mL), bình thường hóa ALT và chuyển đổi huyết thanh HBeAg ở bệnh nhân dương tính với HBeAg [1,2]. Ở những bệnh nhân HBeAg dương tính đạt được chuyển đổi huyết thanh HBeAg và HBV DNA không phát hiện được, có thể ngừng điều trị sau 6-12 tháng điều trị củng cố [1]. Bệnh nhân HBeAg âm tính thường cần điều trị vô thời hạn, nhưng việc ngừng điều trị có thể được xem xét sau ≥3 năm ức chế virus ở những bệnh nhân không xơ gan chọn lọc [2].
Quản lý thất bại điều trị:
Thất bại điều trị được định nghĩa là không đáp ứng nguyên phát (không đạt được mức giảm HBV DNA >1 log10 trong 3 tháng), đáp ứng virus một phần (có thể phát hiện được HBV DNA sau 6-12 tháng), hoặc đột phá về virus học (tái xuất hiện HBV DNA). sau phản hồi ban đầu) [1,2]. Trong trường hợp không đáp ứng ban đầu hoặc đáp ứng một phần với entecavir hoặc TDF/TAF, cần đánh giá sự tuân thủ và tiếp tục điều trị, vì tình trạng kháng thuốc rất hiếm khi xảy ra với các thuốc này. Sự đột phá về virus thường cho thấy sự không tuân thủ nhưng có thể biểu hiện tình trạng kháng thuốc kháng vi-rút, đặc biệt với các thuốc cũ hơn như lamivudine hoặc adefovir. Việc quản lý bao gồm chuyển sang một thuốc có rào cản cao (entecavir hoặc TDF/TAF) nếu bệnh nhân chưa dùng một loại thuốc nào và thêm thuốc thứ hai nếu nghi ngờ kháng cả lamivudine và entecavir [1,2].
Các quần thể đặc biệt:
- Mang thai: TDF là thuốc kháng virus được ưu tiên sử dụng trong thai kỳ do tính an toàn và khả năng làm giảm lây truyền chu sinh. Tất cả phụ nữ mang thai có lượng virus cao (>200.000 IU/mL) nên được điều trị TDF trong tam cá nguyệt thứ ba [1,2]. Các thuốc kháng virus khác nên được chuyển sang TDF, hoặc trì hoãn điều trị nếu bệnh nhẹ ở tam cá nguyệt thứ nhất hoặc thứ hai.
- Xơ gan mất bù: Liệu pháp kháng vi-rút được chỉ định ở tất cả các bệnh nhân bị xơ gan mất bù, bất kể mức độ HBV DNA. AASLD khuyến nghị entecavir hoặc TAF là lựa chọn hàng đầu cho nhóm đối tượng này [1], trong khi hướng dẫn EASL cũng bao gồm TDF [2]. Cần điều chỉnh liều cho bệnh nhân suy giảm chức năng thận.
- HCC: Bệnh nhân bị HCC nên được điều trị bằng thuốc kháng vi-rút vô thời hạn để ngăn chặn sự nhân lên của HBV và giảm nguy cơ tái phát sau khi cắt bỏ hoặc ghép gan [1,2]. Lựa chọn tác nhân phụ thuộc vào chức năng gan cơ bản và khả năng tương tác thuốc-thuốc với các liệu pháp điều trị HCC.
- Kích hoạt lại HBV: Bệnh nhân được điều trị bằng thuốc ức chế miễn dịch hoặc gây độc tế bào có nguy cơ tái kích hoạt HBV, có thể dẫn đến viêm gan nặng, suy gan và tử vong. Tất cả bệnh nhân nên được sàng lọc HBsAg và anti-HBc trước khi bắt đầu dùng thuốc ức chế miễn dịch [1,2]. Bệnh nhân có HBsAg dương tính nên được điều trị dự phòng bằng thuốc kháng vi-rút (thường là entecavir hoặc TDF) trong thời gian ức chế miễn dịch và ít nhất 6-12 tháng sau khi hoàn thành, tùy thuộc vào loại liệu pháp ức chế miễn dịch [4]. Bệnh nhân có HBsAg âm tính, anti-HBc dương tính nên được theo dõi HBsAg và HBV DNA trong và sau khi dùng thuốc ức chế miễn dịch, bắt đầu điều trị bằng liệu pháp kháng vi-rút nếu xảy ra tái hoạt động.
Tóm lại, các hướng dẫn hiện hành nhấn mạnh tầm quan trọng của việc đánh giá rủi ro, lựa chọn bệnh nhân cẩn thận và quyết định điều trị theo từng cá nhân trong việc kiểm soát HBV mạn tính. Entecavir, TDF và TAF là những thuốc hàng đầu được ưa thích do hiệu lực và khả năng kháng thuốc cao, nhưng việc lựa chọn thuốc nên được điều chỉnh dựa trên đặc điểm của bệnh nhân và bệnh đi kèm. Việc theo dõi liên tục là điều cần thiết để đánh giá đáp ứng điều trị, quản lý các tác dụng phụ và phát hiện các biến chứng như HCC. Các nhóm đặc biệt, bao gồm phụ nữ mang thai, bệnh nhân xơ gan mất bù hoặc HCC và những người cần ức chế miễn dịch, cần được chú ý đặc biệt và các phương pháp điều trị tùy chỉnh. Khi các liệu pháp mới tiếp tục xuất hiện, việc quản lý HBV có thể sẽ phát triển, nhưng các nguyên tắc cốt lõi về đánh giá rủi ro, điều trị kịp thời và theo dõi thận trọng sẽ vẫn rất quan trọng để tối ưu hóa kết quả của bệnh nhân.
Phòng ngừa:
Phòng ngừa lây truyền HBV là rất quan trọng để giảm gánh nặng bệnh tật toàn cầu. Biện pháp phòng bệnh hiệu quả nhất là tiêm phòng. Tiêm chủng phổ cập cho trẻ sơ sinh đã được Tổ chức Y tế Thế giới khuyến nghị từ năm 1992 và đã làm giảm đáng kể tỷ lệ nhiễm trùng mới ở các vùng lưu hành [16]. Nên tiêm vắc-xin bổ sung cho trẻ em và thanh thiếu niên chưa được tiêm chủng cũng như người lớn có nguy cơ cao (ví dụ: nhân viên y tế, người tiêm chích ma túy, nam quan hệ tình dục đồng giới). Vắc-xin HBV an toàn và có khả năng tạo miễn dịch cao, với tỷ lệ huyết thanh bảo vệ >90% sau một đợt tiêm chủng đầy đủ [17]. Khả năng bảo vệ lâu dài dường như được duy trì ngay cả khi nồng độ anti-HBs giảm theo thời gian.
Ngăn ngừa lây truyền chu sinh là một chiến lược quan trọng khác, vì phương thức lây nhiễm này có nguy cơ mãn tính cao nhất. Tất cả phụ nữ mang thai nên được sàng lọc HBsAg, và trẻ sơ sinh sinh ra từ những bà mẹ có HBsAg dương tính nên được chủng ngừa HBV và globulin miễn dịch viêm gan B (HBIG) trong vòng 12 giờ sau khi sinh [18]. Dự phòng bằng thuốc kháng vi-rút bằng TDF trong tam cá nguyệt thứ ba được khuyến nghị cho những phụ nữ có lượng vi-rút cao (> 200.000 IU/mL) để giảm thêm nguy cơ lây truyền [14].
Các biện pháp kiểm soát nhiễm trùng là cần thiết để ngăn ngừa lây truyền HBV liên quan đến chăm sóc sức khỏe. Chúng bao gồm việc tuân thủ các biện pháp phòng ngừa tiêu chuẩn, thực hành tiêm an toàn và khử trùng thiết bị y tế đúng cách [19]. Sàng lọc máu, mô và nội tạng của người hiến tặng để tìm HBsAg và anti-HBc cũng rất quan trọng để ngăn ngừa lây truyền liên quan đến truyền máu và cấy ghép.
Kết luận:
Viêm gan B vẫn là một thách thức sức khỏe toàn cầu đáng kể, mặc dù đã có vắc xin và liệu pháp kháng virus hiệu quả. Nhiễm HBV mạn tính là nguyên nhân chính gây xơ gan, suy gan và HCC, nhấn mạnh tầm quan trọng của việc chẩn đoán và điều trị kịp thời. Những tiến bộ trong điều trị bằng thuốc kháng vi-rút đã cải thiện kết quả cho bệnh nhân mắc HBV mạn tính, nhưng việc quản lý lâu dài vẫn phức tạp do nguy cơ kháng thuốc kháng vi-rút, tái hoạt động của HBV và tiến triển bệnh. Nghiên cứu đang tiến hành nhằm mục đích phát triển các liệu pháp mới có thể đạt được hiệu quả chữa bệnh chức năng, với mục tiêu cuối cùng là loại bỏ HBV như một mối đe dọa sức khỏe cộng đồng. Trong khi đó, những nỗ lực tăng cường tiêm chủng HBV, ngăn ngừa lây truyền chu sinh và liên kết những người nhiễm bệnh với việc chăm sóc và điều trị là rất quan trọng để giảm gánh nặng HBV trên toàn thế giới.
BAN BIÊN TẬP – THƯ VIỆN MEDIPHARM
Tài liệu tham khảo
[1] World Health Organization. (2021). Hepatitis B. https://www.who.int/news-room/fact-sheets/detail/hepatitis-b
[2] Polaris Observatory Collaborators. (2018). Global prevalence, treatment, and prevention of hepatitis B virus infection in 2016: a modelling study. The Lancet Gastroenterology & Hepatology, 3(6), 383-403. https://doi.org/10.1016/S2468-1253(18)30056-6
[3] Velkov, S., Ott, J. J., Protzer, U., & Michler, T. (2018). The global hepatitis B virus genotype distribution approximated from available genotyping data. Genes, 9(10), 495. https://doi.org/10.3390/genes9100495
[4] Ganem, D., & Prince, A. M. (2004). Hepatitis B virus infection—natural history and clinical consequences. New England Journal of Medicine, 350(11), 1118-1129. https://doi.org/10.1056/NEJMra031087
[5] Trépo, C., Chan, H. L., & Lok, A. (2014). Hepatitis B virus infection. The Lancet, 384(9959), 2053-2063. https://doi.org/10.1016/S0140-6736(14)60220-8
[6] European Association for the Study of the Liver. (2017). EASL 2017 clinical practice guidelines on the management of hepatitis B virus infection. Journal of Hepatology, 67(2), 370-398. https://doi.org/10.1016/j.jhep.2017.03.021
[7] Liang, T. J. (2009). Hepatitis B: the virus and disease. Hepatology, 49(S5), S13-S21. https://doi.org/10.1002/hep.22881
[8] Cacoub, P., Saadoun, D., Bourlière, M., Khiri, H., Martineau, A., Benhamou, Y., Varastet, M., Pol, S., Thibault, V., Rotily, M., Halfon, P. (2005). Hepatitis B virus genotypes and extrahepatic manifestations. Journal of Hepatology, 43(5), 764-770. https://doi.org/10.1016/j.jhep.2005.05.029
[9] Krajden, M., McNabb, G., & Petric, M. (2005). The laboratory diagnosis of hepatitis B virus. Canadian Journal of Infectious Diseases and Medical Microbiology, 16(2), 65-72. https://doi.org/10.1155/2005/450574
[10] Terrault, N. A., Lok, A. S., McMahon, B. J., Chang, K. M., Hwang, J. P., Jonas, M. M., Brown Jr, R. S., Bzowej, N. H., & Wong, J. B. (2018). Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance. Hepatology, 67(4), 1560-1599. https://doi.org/10.1002/hep.29800
[11] Sarin, S. K., Kumar, M., Lau, G. K., Abbas, Z., Chan, H. L., Chen, C. J., Chen, D. S., Chen, H. L., Chen, P. J., Chien, R. N., Dokmeci, A. K., Gane, E., Hou, J. L., Jafri, W., Jia, J., Kim, J. H., Lai, C. L., Lee, H. C., Lim, S. G., … Omata, M. (2016). Asian-Pacific clinical practice guidelines on the management of hepatitis B: a 2015 update. Hepatology International, 10(1), 1-98. https://doi.org/10.1007/s12072-015-9675-4
[12] Ghany, M. G., & Doo, E. C. (2009). Antiviral resistance and hepatitis B therapy. Hepatology, 49(S5), S174-S184. https://doi.org/10.1002/hep.22900
[13] Brown, R. S., McMahon, B. J., Lok, A. S., Wong, J. B., Ahmed, A. T., Mouchli, M. A., Wang, Z., Prokop, L. J., Murad, M. H., & Mohammed, K. (2016). Antiviral therapy in chronic hepatitis B viral infection during pregnancy: a systematic review and meta-analysis. Hepatology, 63(1), 319-333. https://doi.org/10.1002/hep.28302
[14] Thio, C. L., Guo, N., Xie, C., Nelson, K. E., & Ehrhardt, S. (2015). Global elimination of mother-to-child transmission of hepatitis B: revisiting the current strategy. The Lancet Infectious Diseases, 15(8), 981-985. https://doi.org/10.1016/S1473-3099(15)00158-9
[15] World Health Organization. (2015). Guidelines for the prevention, care and treatment of persons with chronic hepatitis B infection. https://www.who.int/publications/i/item/9789241549059
[16] Schillie, S., Vellozzi, C., Reingold, A., Harris, A., Haber, P., Ward, J. W., & Nelson, N. P. (2018). Prevention of hepatitis B virus infection in the United States: recommendations of the Advisory Committee on Immunization Practices. MMWR Recommendations and Reports, 67(1), 1-31. https://doi.org/10.15585/mmwr.rr6701a1
[17] Bruce, M. G., Bruden, D., Hurlburt, D., Zanis, C., Thompson, G., Rea, L., Toomey, M., Townshend-Bulson, L., Rudolph, K., Bulkow, L., Spradling, P. R., Baum, R., Hennessy, T., & McMahon, B. J. (2016). Antibody levels and protection after hepatitis B vaccine: results of a 30-year follow-up study and response to a booster dose. The Journal of Infectious Diseases, 214(1), 16-22. https://doi.org/10.1093/infdis/jiv748

BÌNH LUẬN