Sinh học tế bào mỡ và sức khỏe chuyển hoá
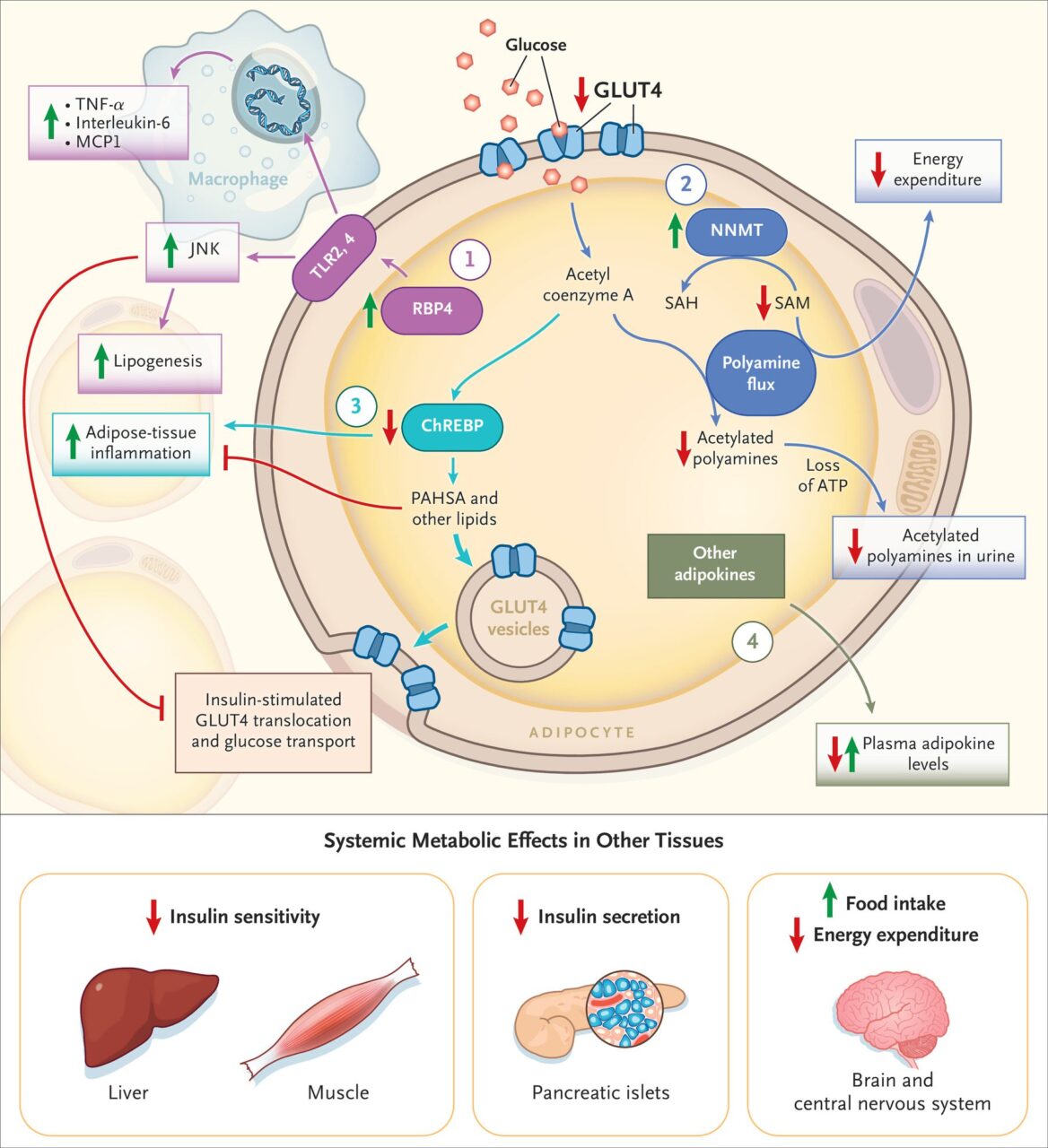
Tác dụng chuyển hoá toàn thân của GLUT4 Điều hòa sinh học tế bào mỡ.
Trong nhiều thập kỷ qua, sự hiểu biết của chúng ta về sinh học tế bào mỡ và cách nó điều chỉnh sự chuyển hoá toàn bộ cơ thể đã trải qua một cuộc cách mạng. 50 năm trước, mô mỡ được coi là một kho lưu trữ trơ tích tụ lipid ở trạng thái cho ăn và giải phóng axit béo và glycerol trong quá trình nhịn ăn. Công việc của nhiều nhà điều tra tiết lộ rằng mô mỡ là một tuyến nội tiết giải phóng hormone và các phân tử hoạt tính sinh học khác được gọi chung là adipokine.6,7 Một ví dụ quan trọng là leptin, điều chỉnh lượng thức ăn và chi tiêu năng lượng thông qua các tác động trong hệ thống thần kinh trung ương.8 Tuy nhiên, mô mỡ cũng giải phóng các chất điều biến miễn dịch, chẳng hạn như cytokine và peptide, điều chỉnh huyết áp và đông máu. Ngoài ra, mô mỡ trắng điều chỉnh cân bằng năng lượng thông qua các quá trình như nhuộm nâu hoặc be (trong đó các tế bào màu nâu hoặc màu be phát sinh trong mô mỡ trắng)6 và các chu kỳ vô ích khác. Một số chu kỳ vô ích được kiểm soát bằng cách tách các protein hoặc các chất điều chỉnh mới hơn như nicotinamide N-methyltransferase, phát huy tác dụng của nó thông qua quá trình methyl hóa histone9 (Hình 2), hoặc creatine.10 Mô mỡ cũng là một mô chuyển hoá rất tích cực, tổng hợp và phá vỡ lipid và chuyển hóa các chất nền như axit béo và axit amin chuỗi nhánh.11
Sự quan tâm đã tăng lên trong “viêm” mô mỡ, được xác định bởi sự xâm nhập tế bào miễn dịch và bài tiết cytokine tiền viêm. Trong khi một số loại tế bào miễn dịch rất quan trọng đối với việc tái cấu trúc mô mỡ để đáp ứng với việc nhịn ăn và cho ăn, kích hoạt tiền viêm của các tế bào này và tế bào mỡ có liên quan và có thể làm nặng thêm tình trạng kháng insulin.12-14 Các cơ chế mô mỡ khác và các chất trung gian của tình trạng kháng insulin toàn thân bao gồm thiếu oxy, xơ hóa, diHOMEs (chất trung gian axit dihydroxyoctadecanoic), exosome và microRNA (miRNA).6. Các quá trình nói trên được mô tả trong phần này hội tụ để điều chỉnh độ nhạy insulin toàn thân, bài tiết insulin, lượng thức ăn, chi tiêu năng lượng và trọng lượng cơ thể (Hình 1 và 2).
Tác dụng toàn thân của GLUT4 trong tế bào mỡ
Các nghiên cứu về GLUT4, chất vận chuyển glucose chính được điều chỉnh insulin, đã cung cấp những hiểu biết sâu sắc về vai trò của tế bào mỡ đối với sức khỏe chuyển hoá (Hình 2). GLUT4 được biểu hiện chủ yếu ở tế bào mỡ, cơ xương và cơ tim, với biểu hiện thấp ở các mô khác. Ở người và động vật gặm nhấm bị béo phì và tiểu đường loại 2, nồng độ GLUT4 giảm trong mô mỡ nhưng bình thường trong cơ.15 Quan sát này là một bất ngờ vì rất ít glucose được hấp thụ bởi mô mỡ. Tăng nồng độ insulin sau bữa ăn kích thích sự hấp thu glucose chủ yếu vào cơ bắp. Tuy nhiên, điều hòa giảm GLUT4 trong tế bào mỡ ở trạng thái kháng insulin làm tăng khả năng giảm hấp thu glucose trong tế bào mỡ có thể góp phần vào sự phát triển của bệnh tiểu đường. Khái niệm này được hỗ trợ bởi dữ liệu ở người cho thấy nồng độ GLUT4 mô mỡ tương quan cao với độ nhạy insulin được đo bằng kỹ thuật kẹp glucose huyết bình thường – cường insulin máu.16 Ngoài ra, nồng độ GLUT4 mô mỡ giảm là một yếu tố dự báo sớm bệnh tiểu đường loại 2 ở người.17
Để xác định vai trò của tế bào mỡ GLUT4 trong sinh bệnh học của bệnh tiểu đường, GLUT4 đã bị loại bỏ18 hoặc thể hiện quá mức19 có chọn lọc trong tế bào mỡ ở chuột. Mức GLUT4 vẫn bình thường trong cơ bắp ở cả hai mô hình. Điều đáng ngạc nhiên là những con chuột trong đó GLUT4 bị loại bỏ trong tế bào mỡ có kháng insulin, với nguy cơ mắc bệnh tiểu đường loại 2,18 trong khi những con chuột có biểu hiện quá mức GLUT4 đặc hiệu mỡ (AG4OX) đã tăng cường dung nạp glucose và giảm đường huyết lúc đói.19 Các nghiên cứu cho thấy tác dụng toàn thân đối với cơ và gan với những thay đổi di truyền được xác định của tế bào mỡ GLUT4. Để xác định các phân tử làm trung gian cho các hiệu ứng này, các phân tích mảng DNA đã được thực hiện trong mô mỡ từ những con chuột trong đó GLUT4 đã được biểu hiện quá mức hoặc bị loại bỏ đặc biệt trong tế bào mỡ. Các nghiên cứu ban đầu tập trung vào các protein tiết ra như là chất trung gian của các hiệu ứng toàn thân này.
Protein liên kết retinol 4 và kháng insulin
Một trong những gen bị thay đổi nhiều nhất để đáp ứng với những thay đổi trong biểu hiện GLUT4 của tế bào mỡ là protein liên kết retinol mã hóa gen 4 (RBP4), protein chính cung cấp retinol (vitamin A) cho các mô. RBP4 thuộc họ lipocalin của các protein liên kết, cũng bao gồm các protein liên kết axit béo, steroid và bilin. Việc phát hiện ra rằng biểu hiện RBP4 trong tế bào mỡ bị thay đổi để đáp ứng với những thay đổi di truyền trong biểu hiện GLUT4 của tế bào mỡ đã kích thích nhiều nghiên cứu cho thấy nồng độ RBP4 trong huyết thanh và mô mỡ tăng cao ở nhiều trạng thái kháng insulin ở người, bao gồm béo phì, tiểu đường loại 2,20,21 hội chứng buồng trứng đa nang,22 và chứng loạn dưỡng mỡ liên quan đến vi-rút suy giảm miễn dịch ở người,23 cũng như ở những người bị rối loạn lipid máu,24 bệnh động mạch vành,25 và tăng huyết áp,26,27 ngay cả khi không có bệnh tiểu đường. Tuy nhiên, không phải tất cả các nghiên cứu đều cho thấy mức RBP4 tăng cao.28
Các thành viên gia đình gầy, không mắc bệnh tiểu đường của những người mắc bệnh tiểu đường loại 2 có nguy cơ mắc bệnh tiểu đường tăng ít nhất 30 đến 50%. Nồng độ RBP4 mô mỡ và huyết thanh tăng cao trước khi bệnh rõ ràng ở các thành viên gia đình mắc bệnh tiểu đường.20 Có mối tương quan nghịch đảo mạnh mẽ giữa nồng độ RBP4 trong huyết thanh và độ nhạy insulin được xác định bằng các nghiên cứu kẹp glucose máu bình thường – cường insulin máu.20 Nhiều biện pháp cải thiện độ nhạy insulin làm giảm nồng độ RBP4 trong huyết thanh, bao gồm giảm cân, phẫu thuật giảm béo,29 thể dục30 và thuốc nhạy cảm với insulin.31
RBP4 NHƯ MỘT DẤU HIỆU HOẶC NGUYÊN NHÂN GÂY KHÁNG INSULIN TRONG BỆNH TIỂU ĐƯỜNG
Tăng nồng độ RBP4 ở chuột về mặt di truyền hoặc dược lý gây đề kháng insulin,21 và giảm nó mang lại độ nhạy insulin được cải thiện.21 Do đó, giảm nồng độ RBP4 trong huyết thanh có thể là một chiến lược hiệu quả để giảm kháng insulin và ngăn ngừa hoặc điều trị bệnh tiểu đường loại 2.
Liệu nồng độ RBP4 tăng cao có thể gây kháng insulin ở người hay không đã được giải quyết bằng các nghiên cứu di truyền ở người. Một nghiên cứu dịch tễ học nổi bật, Nghiên cứu Rotterdam, đã điều tra tác động của một biến thể tăng chức năng trong chất xúc tiến RBP4 của con người, làm tăng biểu hiện RBP4 khi truyền vào các tế bào mỡ,32 về nguy cơ mắc bệnh tiểu đường loại 2.33 Nghiên cứu thuần tập dựa trên dân số tiến cứu này liên quan đến 6571 người lớn từ 55 tuổi trở lên được thiết kế để xác định các yếu tố quyết định bệnh mãn tính ở người lớn tuổi. Những người mang alen mã hóa đa hình nucleotide đơn chức năng này trong chất xúc tiến RBP4 đã tăng 80% nguy cơ mắc bệnh tiểu đường loại 2 sẽ phát triển. Do đó, ở một số quần thể, các biến thể gen RBP4 có thể làm tăng nguy cơ mắc bệnh tiểu đường loại 2.
CƠ CHẾ KHÁNG INSULIN DO RBP4 GÂY RA
RBP4 có nhiều hơn một chức năng quan trọng về mặt sinh học. Nó là protein vận chuyển chính cho retinol, nhưng sự gia tăng nồng độ RBP4 gây ra tình trạng kháng insulin độc lập với retinol (Hình 2). Một yếu tố chính trong tình trạng kháng insulin do RBP4 gây ra là tăng viêm mô mỡ, được gợi ra bởi cả holo-RBP4 (RBP4 gắn với retinol) và apo-RBP4 (RBP4 không liên kết với retinol).34-37 RBP4 làm tăng viêm mô mỡ bằng cách báo hiệu thông qua các thụ thể giống như toll 2 và 4 để kích hoạt miền pyrin họ NLR – chứa 4 (NLRP4) viêm.13 Ngoài ra, RBP4 làm tăng lipolysis (sự ly giải lipid) trong tế bào mỡ của con người, và in vivo, . Nồng độ RBP4 trong huyết thanh tăng cao có liên quan đến sự ức chế lipolysis qua trung gian insulin và sản xuất glucose gan ở phụ nữ béo phì.38 Đây là một ví dụ về cách thay đổi biểu hiện GLUT4 trong tế bào mỡ thay đổi sinh học mô mỡ, giao tiếp giữa các cơ quan và độ nhạy insulin toàn thân.
Cảm biến glucose bằng tế bào mỡ
Trong bệnh béo phì và tiểu đường loại 2, biểu hiện GLUT4 và vận chuyển glucose kích thích insulin bị giảm trong tế bào mỡ.15 Bằng cách nào đó, tế bào mỡ cảm nhận được sự thay đổi và thay đổi sinh học của nó, bao gồm giải phóng hormone, cytokine và RBP4, cũng như các protein khác. Những thay đổi này, lần lượt, làm thay đổi hoạt động của insulin để ngăn chặn sản xuất glucose ở gan và thúc đẩy sử dụng glucose trong cơ bắp. Những phân tử hoặc con đường nào trong tế bào mỡ cảm nhận được những thay đổi này trong glucose?
Herman et al. phát hiện ra rằng tăng vận chuyển glucose qua trung gian GLUT4 vào tế bào mỡ được cảm nhận bởi protein liên kết yếu tố phản ứng carbohydrate (ChREBP)39 (Hình 2), một yếu tố phiên mã điều chỉnh sự hình thành mỡ và glycolysis (đường phân). Cảm ứng biểu hiện ChREBP làm thay đổi sinh học tế bào mỡ, dẫn đến nhiều glucose được đưa vào tổng hợp axit béo (tức là de novo lipogenesis, quá trình tân sinh chất béo). Tăng tổng hợp axit béo từ glucose có tác dụng thuận lợi đối với hoạt động của insulin để ngăn chặn sản xuất glucose ở gan và tăng sử dụng glucose trong cơ bắp. ChREBP rất quan trọng đối với hiệu ứng này bởi vì khi ChREBP bị loại bỏ khỏi chuột biểu hiện quá mức GLUT4 đặc hiệu mỡ, sự kết hợp glucose vào axit béo không còn tăng lên và tác dụng thuận lợi của tác dụng insulin đối với gan và cơ bắp không còn nữa.39
Những quan sát này áp dụng cho con người. Biểu hiện ChREBP trong mô mỡ dưới da tương quan cao với độ nhạy insulin ở những người béo phì nhưng không mắc bệnh tiểu đường, độc lập với chỉ số khối cơ thể (BMI).39 Ngoài ra, biểu hiện gen lipogen trong mô mỡ tương quan với độ nhạy insulin ở người, đã được chứng minh là độc lập với BMI trong một số nhưng không phải tất cả các nghiên cứu.40,41 Do đó, tăng vận chuyển glucose vào tế bào mỡ làm tăng độ nhạy insulin ở người và tăng độ nhạy insulin có liên quan đến việc kết hợp glucose nhiều hơn vào tổng hợp axit béo, được điều chỉnh bởi ChREBP.
Khám phá axit béo phân nhánh Hydroxy Axit béo

Tác dụng có lợi của PAHSAs (lipid chống viêm và đái tháo đường).
Thực tế là tăng vận chuyển glucose vào tế bào mỡ dẫn đến tăng sự tân sinh chất béo, cần thiết cho sự dung nạp glucose tăng cường ở chuột AG4OX (những con chuột biến đổi gen được thiết kế để biểu hiện quá mức GLUT4 trong tế bào mỡ),39 Gợi ý rằng tăng sự tân sinh chất béo trong mô mỡ có thể dẫn đến sự tổng hợp các lipid có lợi về mặt chuyển hoá. Để điều tra khả năng này, phân tích lipidomic không nhắm mục tiêu đã được thực hiện trên mô mỡ từ chuột AG4OX. Phân tích này đã dẫn đến việc phát hiện ra một loại lipid hoạt tính sinh học mới, axit béo hydroxy phân nhánh (FAHFAs), được tạo ra ở người, động vật và thực vật và có đặc tính trị đái tháo đường và kháng viêm.42-44 FAHFA bao gồm một axit béo và một axit béo hydroxy được liên kết bởi một liên kết este (Hình 3). Nhiều đồng phân FAHFA tồn tại, với sự phân nhánh ở các cacbon khác nhau. Ban đầu, 16 gia đình FAHFA đã được xác định,42 nhưng bây giờ rõ ràng là 51 hoặc nhiều họ FAHFA tồn tại, với 301 regioisomers trong các mô động vật có vú và 49 họ trong thực vật.42-45 Số lượng lớn FAHFA và sự đa dạng hóa học đặc biệt rộng lớn của các đồng phân và họ FAHFA46 đảm bảo khái niệm “FAHFAome”, lặp lại sự phức tạp của bộ gen hoặc proteome của con người.
FAHFA có mặt trong tất cả các mô động vật có vú đã được thử nghiệm, với mức độ cao nhất trong mô mỡ trắng và nâu dưới da.42 Nồng độ mô FAHFA tương tự như nồng độ của các lipid tín hiệu khác, chẳng hạn như prostaglandin và prostacyclin. FAHFA được điều chỉnh cao theo cách cụ thể của mô và đồng phân trong trạng thái sinh lý của việc nhịn ăn và trong trạng thái sinh lý bệnh của bệnh béo phì gây ra bởi chế độ ăn nhiều chất béo.42
FAHFA ở người

Mức độ của một phân họ FAHFA, este axit palmitic của axit hydroxystearic (PAHSAs), trong huyết thanh và mô mỡ trắng dưới da, tương quan chặt chẽ với độ nhạy insulin ở người42 (Bảng 1). Nồng độ huyết thanh và mỡ của nhiều đồng phân PAHSA giảm ở những người bị kháng insulin, có hoặc không có bệnh tiểu đường loại 2.42 Nồng độ PAHSA trong tế bào mỡ của con người tương quan cao với sự biểu hiện của các gen điều hòa GLUT4 và ChREBP.16 Mức PAHSA cũng tương quan nghịch với kích thước tế bào mỡ ở người. PAHSA thúc đẩy sự biệt hóa tế bào mỡ của con người thông qua con đường qua trung gian CCAAT / protein liên kết tăng cường (C / EBP)16 (Bảng 1). Ở những người bị béo phì, tổng nồng độ PAHSA và FAHFA trong huyết thanh, và đặc biệt, este axit stearic của axit 9-hydroxystearic (9-SAHSA) và este axit oleic của nồng độ axit 9-hydroxystearic (9-OAHSA), thấp hơn mức đối chứng mà không bị béo phì. Trong một nghiên cứu liên quan đến những bệnh nhân đã trải qua phẫu thuật cắt dạ dày nội soi, giảm cân được duy trì và các biện pháp chuyển hoá được cải thiện sau 6 tháng; chỉ có mức 9-OAHSA được tăng lên.47 Do đó, các can thiệp nhạy cảm với insulin có thể làm thay đổi mức độ của các đồng phân FAHFA cụ thể.
PAHSAs có trong sữa mẹ, và các đồng phân cụ thể được giảm trong sữa mẹ từ phụ nữ béo phì so với phụ nữ gầy.48 Nồng độ sữa mẹ tương quan cao với BMI ở phụ nữ cho con bú. Nồng độ PAHSA lưu hành giảm ở bệnh nhân ung thư vú.49 Ở phụ nữ lớn tuổi, tập thể dục làm tăng nồng độ PAHSA trong huyết thanh và mô mỡ trắng.50 Tác dụng của việc tập thể dục cũng đã được nghiên cứu ở những người chạy bộ được đào tạo. Trước khi tập thể dục, nồng độ FAHFA huyết thanh thấp hơn ở những người chạy thừa cân so với những người chạy bộ có trọng lượng bình thường. Phản ứng của các gia đình FAHFA khác nhau để tập thể dục khác nhau. Những thay đổi trong một số FAHFA dự đoán mức tiêu thụ oxy tối đa.51
Nồng độ este axit palmitoleic trong huyết thanh của axit 9-hydroxystearic (9-POHSA) hoặc 9-OAHSA tương quan với các dấu ấn sinh học tim mạch phi truyền thống ở người khỏe mạnh52 (Bảng 1). Chế độ ăn uống cũng có thể ảnh hưởng đến nồng độ FAHFA huyết thanh, đã được báo cáo là cao hơn ở động vật ăn tạp so với người ăn chay47 (Bảng 1). Tuy nhiên, mức độ tương đối của các đồng phân FAHFA trong thực phẩm không phải lúc nào cũng phản ánh nồng độ huyết thanh hoặc mô của chúng.42 Cho ăn quá nhiều trong thời gian ngắn chế độ ăn nhiều calo, chất béo bão hòa cũng làm tăng nồng độ FAHFA trong huyết thanh.47 Do đó, trong khi thực phẩm có thể là một nguồn FAHFA, chúng cũng được tổng hợp in vivo (thảo luận dưới đây).42,43
TÁC DỤNG SINH HỌC CỦA FAHFAS
Vì nồng độ FAHFA được điều chỉnh ở các trạng thái sinh lý và sinh lý bệnh thay đổi,42,46,53-55 FAHFA có thể đóng một vai trò quan trọng đối với sức khỏe và bệnh tật. Một số đồng phân FAHFA, nhưng không phải tất cả, làm tăng vận chuyển glucose kích thích insulin vào tế bào mỡ.56 Đối với 5 và 9-PAHSA, cơ chế là tăng cường hoạt động của insulin đối với sự chuyển vị GLUT4 từ các túi nội bào sang màng plasma.42 Những tác động này của 5 và 9-PAHSA được trung gian bởi thụ thể kết hợp protein G 120 (GPR120) (Hình 3).42
Sử dụng 5 và 9-PAHSA ở chuột già, ăn chow bị kháng insulin giúp cải thiện độ nhạy insulin và bài tiết insulin kích thích glucose. Sự cải thiện thứ hai có thể là do tác dụng kích thích của PAHSA đối với peptide giống glucagon 1 (GLP1) từ các tế bào nội tiết của ruột, sẽ làm tăng tiết insulin từ các tế bào beta tuyến tụy (Hình 3).42,57 Tuy nhiên, PAHSA cũng trực tiếp làm tăng bài tiết insulin kích thích glucose ở các đảo tụy của con người thông qua một hiệu ứng được trung gian bởi một thụ thể kết hợp protein G khác, GPR40,57 Theo quan sát với một số lipid khác. Ngoài ra, 5-PAHSA phục hồi nhịp điệu bình thường của bài tiết insulin ở các tiểu đảo từ những người mắc bệnh tiểu đường loại 2.42,57-59 Không phải tất cả các nghiên cứu60,61 đã cho thấy những tác dụng có lợi của PAHSAs. Nhiều vấn đề phương pháp luận quan trọng góp phần vào kết quả tiêu cực đã được quan sát.46,62,63 Ngoài ra, không phải tất cả các đồng phân FAHFA đều có tác dụng có lợi,56,64 Và các hiệu ứng sinh học có thể thay đổi theo các nền tảng di truyền khác nhau.
Ở những con chuột nhận được chế độ ăn nhiều chất béo, 5 hoặc 9-PAHSA không có tác dụng có lợi đối với GLP1 hoặc bài tiết insulin. Thay vào đó, ở những con chuột này, tác dụng có lợi của PAHSA đối với cân bằng nội môi glucose chủ yếu là do tác dụng nhạy cảm với insulin của chúng.55 Tầm quan trọng của hiệu ứng này là một yếu tố gây bệnh chính trong bệnh tiểu đường loại 2 là đề kháng với các hành động của insulin trên mô mỡ, cơ và gan. Kháng insulin làm tăng nguy cơ mắc bệnh tim mạch, ung thư, bệnh thoái hóa thần kinh và rối loạn chức năng nhận thức.65-67 Rất ít loại thuốc hiện có sẵn có tác dụng chính là tăng độ nhạy insulin. Thiazolidinediones có tác dụng này, nhưng việc sử dụng chúng đã bị hạn chế vì các vấn đề an toàn và tác dụng phụ.68 Thêm vào vũ khí của các chất nhạy cảm insulin để giảm gánh nặng kháng insulin và bệnh tiểu đường là một nhu cầu lớn. Sử dụng lâu dài 5 và 9-PAHSAs giúp tăng cường độ nhạy insulin ở gan và toàn thân ở chuột bị béo phì do chế độ ăn nhiều chất béo, một mô hình kháng insulin và bệnh tiểu đường loại 2 (Hình 3).55 PAHSAs cũng làm tăng sự hấp thu glucose vào cơ glycolytic và mô tim.55
Ở trạng thái nhạy cảm với insulin, insulin có hiệu quả ức chế sản xuất glucose nội sinh, chủ yếu từ gan và kích thích sự hấp thu glucose của mô cơ và mô mỡ.69 Tác động trực tiếp đến sản xuất glucose nội sinh bao gồm tăng tổng hợp glycogen, trong khi tác động gián tiếp liên quan đến ức chế lipolysis mô mỡ, hạn chế cung cấp chất nền tân sinh glucose đến gan.70-74 Cả hai tác động trực tiếp và gián tiếp đều bị suy yếu ở các trạng thái kháng insulin như béo phì và tiểu đường loại 2. Tăng viêm mô mỡ ở trạng thái kháng insulin cũng góp phần đề kháng với tác dụng chống lipolytic của insulin. Các cytokine tiền viêm, chẳng hạn như interleukin-6, kích thích lipolysis mô mỡ, dẫn đến tăng giải phóng glycerol và acetyl coenzyme A, được đưa đến gan.71 Glycerol phục vụ như một chất nền gluconeogenic, trong khi acetyl coenzyme A kích hoạt pyruvate carboxylase, cũng thúc đẩy gluconeogenesis.71 Tác dụng chống lipolytic của PAHSAs là cần thiết cho hành động nhạy cảm insulin gan của chúng ở những con chuột nhận được chế độ ăn nhiều chất béo.55 Tác dụng kháng viêm của PAHSA trong mô mỡ ở những con chuột như vậy42 có thể giải thích cho tác dụng antilipolytic,55 Nhưng cần phải điều tra thêm.
Trong các đại thực bào mô mỡ từ chuột bị kháng insulin, 9-PAHSA ức chế sự trưởng thành tế bào đuôi gai do lipopolysacarit gây ra và biểu hiện kháng nguyên, cũng như sản xuất cytokine tiền viêm (Hình 3).42 Este axit docosahexaenoic (DHA) của axit 13-hydroxyoctadecadienoic (13-DHAHLA) làm giảm hoạt hóa đại thực bào và tăng thực bào.43 Ngoài ra, PAHSA, POHSA, OAHSA, SAHSA và este axit linoleic của axit hydroxy linoleic (LAHLAs) có tác dụng kháng viêm.43,56,75 Bằng chứng cho thấy những tác dụng này có thể quan trọng in vivo bao gồm các quan sát ở chuột bị viêm đại tràng76 hoặc bệnh tiểu đường tuýp 1.77 Điều trị bằng 5 và 9-PAHSA ở chuột làm chậm sự khởi phát của viêm đại tràng, làm giảm mức độ nghiêm trọng của nó và giảm rõ rệt viêm ruột.76 Cụ thể, PAHSA làm giảm biểu hiện phân tử chi phí và kích hoạt tế bào đuôi gai, giảm sự giãn nở vô tính tế bào T, giải phóng interferon gamma và viêm ruột.76
Trong mô hình chuột mắc bệnh tiểu đường loại 1, (tức là chuột mắc bệnh tiểu đường không béo phì [NOD]), điều trị PAHSA làm chậm sự khởi phát và giảm đáng kể tỷ lệ mắc bệnh tiểu đường loại 1 và tăng đáng kể tỷ lệ sống sót.77 Hai cơ chế cho những hiệu ứng này là điều chế tế bào miễn dịch và tác dụng bảo vệ trực tiếp của PAHSA trên các tế bào đảo tụy. Điều trị PAHSA làm giảm thâm nhiễm tế bào miễn dịch tiền viêm vào các tiểu đảo và tăng sinh tế bào beta in vivo. Một số tác dụng này là trực tiếp, vì PAHSA làm giảm rõ rệt quá trình apoptosis (chết tế bào theo chương trình) và hoại tử do cytokine gây ra trong các tế bào beta in vitro khi không có tế bào miễn dịch.77 Ngoài ra, điều trị PAHSA làm tăng sinh tế bào beta tiểu đảo dưới áp lực cytokine in vitro, phản ánh các hiệu ứng in vivo.
Các tế bào beta tuyến tụy dễ bị stress mạng lưới nội chất, xảy ra khi protein tích tụ trong khoang tế bào này do quá tải hoặc quá trình xử lý bị thay đổi. Đây là một yếu tố chính trong cả bệnh tiểu đường loại 1 và loại 2. PAHSA làm giảm stress mạng lưới nội chất ở các tiểu đảo của con người và việc giảm này có hậu quả về chức năng. Trong khi cytokine ngăn chặn hoàn toàn sự tiết insulin kích thích glucose trong các tiểu đảo của con người in vitro, PAHSA khôi phục một phần bài tiết insulin ngay cả khi có cytokine. Những phát hiện gần đây cho thấy một cơ chế chính cho tác dụng bảo vệ của PAHSA đối với các đảo tụy là phòng ngừa, và thậm chí đảo ngược, lão hóa tế bào (Hình 3). Lão hóa tế bào beta là một yếu tố chính trong sinh bệnh học của cả bệnh tiểu đường loại 1 và loại 2.78 Do đó, PAHSA có khả năng bảo vệ chống lại bệnh tiểu đường loại 1 thông qua tác dụng của chúng đối với các tế bào miễn dịch và thông qua các tác dụng bảo vệ trực tiếp trên các tế bào beta, liên quan đến việc giảm stress mạng lưới nội chất và lão hóa tế bào đảo.
CÁC THỤ THỂ ĐẶC HIỆU CHO CÁC TÁC DỤNG SINH HỌC CỦA PAHSAS
Các thụ thể kết hợp protein G cảm nhận lipid có nhiều vai trò trong cân bằng nội môi glucose và bệnh tiểu đường.79,80 GPR120 có mặt trong các tế bào ruột ruột, nơi nó tham gia vào bài tiết GLP1, và cả trong các đại thực bào, nơi nó có tác dụng chống viêm. GPR120, GPR43 và GPR41, được biểu hiện trong tế bào mỡ, ảnh hưởng đến sự biệt hóa và hấp thu glucose, trong khi các GPR khác nằm trong các tế bào beta tuyến tụy và rất quan trọng cho việc tiết insulin.79 Thật vậy, các thụ thể này làm trung gian cho một số tác dụng sinh học của PAHSA. PAHSA kích hoạt GPR120, làm trung gian tác dụng của chúng đối với việc vận chuyển glucose trong tế bào mỡ42 và làm trung gian một phần tác dụng kháng viêm.76 PAHSA cũng kích hoạt GPR40, làm trung gian tác dụng của chúng đối với việc tiết insulin.57 Các GPR khác dường như làm trung gian cho tác dụng của PAHSA đối với quá trình phân giải lipID (dữ liệu chưa được công bố) và sản xuất glucose ở gan.81
TỔNG HỢP FAHFA TRONG CÁC MÔ ĐỘNG VẬT CÓ VÚ
Việc xác định các con đường sinh tổng hợp cho các FAHFA có lợi, chẳng hạn như PAHSA, rất quan trọng vì các con đường như vậy có thể cung cấp các mục tiêu để khôi phục hoặc tăng mức PAHSA ở những người kháng insulin và có khả năng cải thiện độ nhạy insulin của họ. Để kiểm tra xem FAHFA có được tổng hợp trong các mô động vật có vú hay không, các nhà điều tra đã điều trị chuột bằng axit 9-hydroxyheptadecanoic (HHA), một axit béo hydroxy có mặt ở mức rất thấp trong hầu hết các mô động vật có vú. Điều này đã được sử dụng để theo dõi sự tổng hợp của FAHFA non trẻ có chứa axit palmitic và HHA in vivo. Mức độ của FAHFA 9-PAHHA, kết quả từ sự hình thành liên kết este giữa HHA và axit palmitic nội sinh, tăng huyết thanh ở những con chuột đã nhận được HHA.42 Quan sát này chỉ ra rằng FAHFA thực sự có thể được tổng hợp trong các mô động vật có vú in vivo.
FAHFA có thể được tổng hợp trong các mô của con người cũng như các mô chuột.43 Trong một nghiên cứu lâm sàng, những người tham gia được điều trị trong 24 tuần bằng dầu ngô (giả dược) hoặc bằng axit eicosapentaenoic (EPA) cộng với DHA, hai axit béo không bão hòa đa n-3. Sự kết hợp của EPA cộng với DHA làm tăng nồng độ DHAHLAs trong huyết thanh, một phân họ của FAHFAs, ở những người tham gia nhận được axit béo không bão hòa đa n-3, so với những người nhận tinh dầu bắp.43
Mô hình tổng hợp FAHFA qua trung gian ATGL.

Gần đây, một enzyme sinh tổng hợp động vật có vú cho FAHFA đã được phát hiện: lipase triglyceride mỡ.82 Có mặt trong gần như tất cả các mô, nó điều chỉnh bước đầu tiên trong quá trình lipolysis. Lipopose triglyceride lipase xúc tác cho một phản ứng transacyl hóa chưa được biết đến trước đây este hóa axit béo hydroxy với chuỗi acyl béo từ triglyceride hoặc diglyceride, tạo ra FAHFA (Hình 4). Lipopose triglyceride lipase dường như là một enzyme sinh tổng hợp FAHFA quan trọng về mặt sinh lý, vì nồng độ FAHFA nội sinh và mới tổng hợp giảm 80 đến 90% ở chuột trong đó lipase triglyceride mỡ đã bị loại bỏ đặc biệt khỏi tế bào mỡ.82 Nồng độ FAHFA huyết thanh cũng giảm ở những con chuột này, cho thấy mô mỡ có thể là nguồn chính của FAHFA huyết thanh. Cần nhiều nghiên cứu hơn để xác định sự đóng góp tương đối của các kho mô mỡ khác nhau và các mô khác vào FAHFA lưu hành. Tăng nồng độ triglyceride bằng cách điều chỉnh tăng hoạt động diacylglycerol O-acyltransferase (DGAT), bước cuối cùng trong tổng hợp triglyceride, thúc đẩy sinh tổng hợp FAHFA và giảm hoạt động DGAT ức chế sinh tổng hợp, những phát hiện củng cố quan sát rằng triglyceride là tiền chất FAHFA.82
Hoạt động transacylase sinh tổng hợp của lipase triglyceride mỡ được bảo tồn trên các loài và có mặt trong mô mỡ của con người.82 Mặc dù hoạt động lipase này đã được biết đến, những dữ liệu này thiết lập một sự thay đổi mô hình, cho thấy hoạt động transacylase là quan trọng về mặt sinh học. Nhiều đột biến ở người trong lipase triglyceride mỡ đã được mô tả; Những đột biến này dẫn đến bệnh cơ tim, bệnh cơ xương và các bất thường khác do quá tải lipid trong các mô.83,84 Đột biến lipase triglyceride mỡ gây ra bệnh tích trữ lipid trung tính với bệnh cơ ở người.83 Liệu việc giảm sinh tổng hợp FAHFA có thể góp phần vào kiểu hình hay không vẫn chưa được biết.
THỦY PHÂN FAHFA TRONG CÁC MÔ ĐỘNG VẬT CÓ VÚ
FAHFA cũng có thể bị phá vỡ trong các mô động vật có vú. Bốn hydrolase FAHFA đã được xác định. Carboxyl ester lipase, còn được gọi là lipase mô phỏng muối mật hoặc cholesterol esterase, là một FAHFA hydrolase thủy phân FAHFA với tốc độ lớn hơn nhiều so với 31 lipid khác, bao gồm cả este cholesterol.85 Một đột biến trong carboxyl ester lipase gây ra bệnh tiểu đường khởi phát trưởng thành của trẻ loại 8 (MODY8), một dạng bệnh tiểu đường đơn gen đặc trưng bởi sự tiết insulin bị suy yếu và rối loạn chức năng ngoại tiết tuyến tụy.86 Dạng đột biến này của carboxyl ester lipase làm tăng thủy phân 9-PAHSA khi biểu hiện trong tế bào; Do đó, nó là một đột biến tăng chức năng. Carboxyl ester lipase chủ yếu biểu hiện ở tuyến tụy ngoại tiết, và thủy phân 9-PAHSA giảm rõ rệt trong mô tụy từ chuột loại trực tiếp carboxyl ester lipase, những phát hiện chỉ ra rằng carboxyl ester lipase có thể là enzyme phân hủy chính cho FAHFA trong tuyến tụy. Những dữ liệu này cũng cho thấy đột biến tăng chức năng MODY8 có thể làm giảm mức FAHFA bằng cách tăng thủy phân FAHFA in vivo. Mức FAHFA thấp hơn sẽ dẫn đến giảm tăng tiết insulin kích thích glucose, có thể góp phần vào kiểu hình bệnh tiểu đường. Tầm quan trọng của tác dụng lipase este carboxyl đối với thủy phân FAHFA hiện đang được nghiên cứu.
Gen 1 do androgen gây ra và protein điều hòa yếu tố mô phụ thuộc androgen (ADTRP) là các hydrolase threonine xuyên màng thủy phân FAHFA ưu tiên cho các lớp lipid khác.87 Các mô từ chuột thiếu ADTRP hoặc cả gen 1 và ADTRP do androgen gây ra đã làm tăng nồng độ FAHFA cụ thể, đặc biệt là các đồng phân có liên kết este ở carbon thứ chín, do giảm hoạt động thủy phân FAHFA. Mức độ của các lớp lipid khác không thay đổi, chỉ ra rằng gen 1 và ADTRP do androgen gây ra có thể đặc biệt thủy phân FAHFA in vivo.88 Các enzyme khác có thể thủy phân các đồng phân FAHFA với liên kết este ở các cacbon khác nhau. Những hydrolase threonine này, đặc biệt là ADTRP, có thể có vai trò trong các bệnh ở người, mặc dù vai trò đó có phải do ảnh hưởng của chúng đối với mức FAHFA hay không vẫn chưa được biết.89-91
Lipase nhạy cảm với hormone xúc tác bước thứ hai trong quá trình lipolysis và cũng đã được chứng minh là hoạt động như một FAHFA hydrolase in vitro. Tuy nhiên, tầm quan trọng sinh lý của hoạt động này là không rõ.92
Kết luận và định hướng tương lai
Các nghiên cứu về vận chuyển glucose mô mỡ và điều hòa GLUT4 cho thấy tầm quan trọng của mô mỡ trong việc điều chỉnh độ nhạy insulin toàn thân và cân bằng năng lượng toàn cơ thể, có ý nghĩa đối với sinh bệnh học và điều trị béo phì và tiểu đường. Các nghiên cứu về cơ chế tác động của tế bào mỡ GLUT4 dẫn đến việc xác định các protein và lipid tiết ra mỡ làm trung gian giao tiếp giữa các mô. GLUT4 thúc đẩy de novo lipogenesis, dẫn đến việc sản xuất các lipid mới như FAHFAs. Những lipid này, hoạt động thông qua GPR, có nhiều tác dụng chuyển hoá và kháng viêm thuận lợi. PAHSAs có lợi trong các mô hình chuột mắc bệnh tiểu đường loại 1 và 2 và viêm đại tràng. Vì nồng độ PAHSA thấp trong mô mỡ và huyết thanh ở những người kháng insulin và vì PAHSA trực tiếp bảo vệ đảo tụy của con người bằng cách ngăn ngừa và đảo ngược sự lão hóa do stress chuyển hoá, các nghiên cứu là cần thiết để xác định xem chúng có thể được sử dụng để ngăn ngừa hoặc điều trị bệnh tiểu đường loại 1 hoặc 2 hoặc các bệnh qua trung gian miễn dịch khác ở người hay không. Không phải tất cả các đồng phân FAHFA đều có lợi, và các nghiên cứu bổ sung là cần thiết để điều tra tác động sinh học của nhiều đồng phân FAHFA khác. Các loại khám phá được mô tả ở đây, kết hợp với các hình thức công nghệ mới nổi, cung cấp các cơ hội mới để phát triển các liệu pháp điều trị bệnh chuyển hóa hiệu quả hơn bằng cách điều chỉnh các phương pháp điều trị cho các tập hợp khiếm khuyết phân tử đặc hiệu ở từng bệnh nhân.
Bs Lê Đình Sáng (Dịch)
BÀI GỐC: Adipocyte Regulation of Insulin Sensitivity and the Risk of Type 2 Diabetes | NEJM
TÀI LIỆU THAM KHẢO
1. Bliss M. The discovery of insulin. Chicago: University of Chicago Press, 1982.
2.Drucker DJ, Nauck MA. The incretin system: glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors in type 2 diabetes. Lancet 2006;368:1696-1705.
3.Drucker DJ. Mechanisms of action and therapeutic application of glucagon-like peptide-1. Cell Metab 2018;27:740-756.
4.Xu B, Li S, Kang B, Zhou J. The current role of sodium-glucose cotransporter 2 inhibitors in type 2 diabetes mellitus management. Cardiovasc Diabetol 2022;21:83-83.
5.World Health Organization. Diabetes (https://www.who.int/news-room/fact-sheets/detail/diabetes. opens in new tab).
6.Cypess AM. Reassessing human adipose tissue. N Engl J Med 2022;386:768-779.
7.Ouchi N, Parker JL, Lugus JJ, Walsh K. Adipokines in inflammation and metabolic disease. Nat Rev Immunol 2011;11:85-97.
8.Schwartz MW, Woods SC, Porte D Jr, Seeley RJ, Baskin DG. Central nervous system control of food intake. Nature 2000;404:661-671.
9.Kraus D, Yang Q, Kong D, et al. Nicotinamide N-methyltransferase knockdown protects against diet-induced obesity. Nature 2014;508:258-262.
10.Kazak L, Rahbani JF, Samborska B, et al. Ablation of adipocyte creatine transport impairs thermogenesis and causes diet-induced obesity. Nat Metab 2019;1:360-370.
11.Herman MA, She P, Peroni OD, Lynch CJ, Kahn BB. Adipose tissue branched chain amino acid (BCAA) metabolism modulates circulating BCAA levels. J Biol Chem 2010;285:11348-11356.
12.Ferrante AW Jr. Macrophages, fat, and the emergence of immunometabolism. J Clin Invest 2013;123:4992-4993.
13.Moraes-Vieira PM, Yore MM, Sontheimer-Phelps A, et al. Retinol binding protein 4 primes the NLRP3 inflammasome by signaling through Toll-like receptors 2 and 4. Proc Natl Acad Sci U S A 2020;117:31309-31318.
14.Reilly SM, Saltiel AR. Adapting to obesity with adipose tissue inflammation. Nat Rev Endocrinol 2017;13:633-643.
15.Shepherd PR, Kahn BB. Glucose transporters and insulin action — implications for insulin resistance and diabetes mellitus. N Engl J Med 1999;341:248-257.
16.Hammarstedt A, Syed I, Vijayakumar A, et al. Adipose tissue dysfunction is associated with low levels of the novel palmitic acid hydroxystearic acids. Sci Rep 2018;8:15757-15757.
17.Carvalho E, Jansson PA, Nagaev I, Wenthzel AM, Smith U. Insulin resistance with low cellular IRS-1 expression is also associated with low GLUT4 expression and impaired insulin-stimulated glucose transport. FASEB J 2001;15:1101-1103.
18.Abel ED, Peroni O, Kim JK, et al. Adipose-selective targeting of the GLUT4 gene impairs insulin action in muscle and liver. Nature 2001;409:729-733.
19.Shepherd PR, Gnudi L, Tozzo E, Yang H, Leach F, Kahn BB. Adipose cell hyperplasia and enhanced glucose disposal in transgenic mice overexpressing GLUT4 selectively in adipose tissue. J Biol Chem 1993;268:22243-22246.
20.Graham TE, Yang Q, Blüher M, et al. Retinol-binding protein 4 and insulin resistance in lean, obese, and diabetic subjects. N Engl J Med 2006;354:2552-2563.
21.Yang Q, Graham TE, Mody N, et al. Serum retinol binding protein 4 contributes to insulin resistance in obesity and type 2 diabetes. Nature 2005;436:356-362.
22.Lingaiah S, Morin-Papunen L, Piltonen T, Sundström-Poromaa I, Stener-Victorin E, Tapanainen JS. Serum retinol-binding protein 4 levels in polycystic ovary syndrome. Endocr Connect 2019;8:709-717.
23.Peraire J, López-Dupla M, Alba V, et al. HIV/antiretroviral therapy-related lipodystrophy syndrome (HALS) is associated with higher RBP4 and lower omentin in plasma. Clin Microbiol Infect 2015;21(7):711.e1-711.e8.
24.Rocha M, Bañuls C, Bellod L, et al. Association of serum retinol binding protein 4 with atherogenic dyslipidemia in morbid obese patients. PLoS One 2013;8(11):e78670-e78670.
25.Lambadiari V, Kadoglou NPE, Stasinos V, et al. Serum levels of retinol-binding protein-4 are associated with the presence and severity of coronary artery disease. Cardiovasc Diabetol 2014;13:121-121.
26.Li X, Zhu S, Song G, et al. Retinol-binding protein 4 is closely correlated to blood pressure level and E/A in untreated essential hypertension patients. Ann Palliat Med 2019;8:645-650.
27.Solini A, Santini E, Madec S, Rossi C, Muscelli E. Retinol-binding protein-4 in women with untreated essential hypertension. Am J Hypertens 2009;22:1001-1006.
28.Chen H, Zhang J, Lai J, et al. Circulating retinol binding protein 4 levels in coronary artery disease: a systematic review and meta-analysis. Lipids Health Dis 2021;20:89-89.
29.Broch M, Gómez JM, Auguet MT, et al. Association of retinol-binding protein-4 (RBP4) with lipid parameters in obese women. Obes Surg 2010;20:1258-1264.
30.Taghian F, Zolfaghari M, Hedayati M. Effects of aerobic exercise on serum retinol binding protein4, insulin resistance and blood lipids in obese women. Iran J Public Health 2014;43:658-665.
31.Yao-Borengasser A, Varma V, Bodles AM, et al. Retinol binding protein 4 expression in humans: relationship to insulin resistance, inflammation, and response to pioglitazone. J Clin Endocrinol Metab 2007;92:2590-2597.
32.Munkhtulga L, Nagashima S, Nakayama K, et al. Regulatory SNP in the RBP4 gene modified the expression in adipocytes and associated with BMI. Obesity (Silver Spring) 2010;18:1006-1014.
33.van Hoek M, Dehghan A, Zillikens MC, Hofman A, Witteman JC, Sijbrands EJG. An RBP4 promoter polymorphism increases risk of type 2 diabetes. Diabetologia 2008;51:1423-1428.
34.Norseen J, Hosooka T, Hammarstedt A, et al. Retinol-binding protein 4 inhibits insulin signaling in adipocytes by inducing proinflammatory cytokines in macrophages through a c-Jun N-terminal kinase- and toll-like receptor 4-dependent and retinol-independent mechanism. Mol Cell Biol 2012;32:2010-2019.
35.Moraes-Vieira PM, Yore MM, Dwyer PM, Syed I, Aryal P, Kahn BB. RBP4 activates antigen-presenting cells, leading to adipose tissue inflammation and systemic insulin resistance. Cell Metab 2014;19:512-526.
36.Moraes-Vieira PM, Castoldi A, Aryal P, Wellenstein K, Peroni OD, Kahn BB. Antigen presentation and T-cell activation are critical for RBP4-induced insulin resistance. Diabetes 2016;65:1317-1327.
37.Lee S-A, Yuen JJ, Jiang H, Kahn BB, Blaner WS. Adipocyte-specific overexpression of retinol-binding protein 4 causes hepatic steatosis in mice. Hepatology 2016;64:1534-1546.
38.Kilicarslan M, de Weijer BA, Simonyté Sjödin K, et al. RBP4 increases lipolysis in human adipocytes and is associated with increased lipolysis and hepatic insulin resistance in obese women. FASEB J 2020;34:6099-6110.
39.Herman MA, Peroni OD, Villoria J, et al. A novel ChREBP isoform in adipose tissue regulates systemic glucose metabolism. Nature 2012;484:333-338.
40.Roberts R, Hodson L, Dennis AL, et al. Markers of de novo lipogenesis in adipose tissue: associations with small adipocytes and insulin sensitivity in humans. Diabetologia 2009;52:882-890.
41.Eissing L, Scherer T, Tödter K, et al. De novo lipogenesis in human fat and liver is linked to ChREBP-β and metabolic health. Nat Commun 2013;4:1528-1528.
42.Yore MM, Syed I, Moraes-Vieira PM, et al. Discovery of a class of endogenous mammalian lipids with anti-diabetic and anti-inflammatory effects. Cell 2014;159:318-332.
43.Kuda O, Brezinova M, Rombaldova M, et al. Docosahexaenoic acid-derived fatty acid esters of hydroxy fatty acids (FAHFAs) with anti-inflammatory properties. Diabetes 2016;65:2580-2590.
44.Zhu Q-F, Yan J-W, Zhang T-Y, Xiao H-M, Feng Y-Q. Comprehensive screening and identification of fatty acid esters of hydroxy fatty acids in plant tissues by chemical isotope labeling-assisted liquid chromatography-mass spectrometry. Anal Chem 2018;90:10056-10063.
45.Zhu Q-F, Yan J-W, Ni J, Feng Y-Q. FAHFA footprint in the visceral fat of mice across their lifespan. Biochim Biophys Acta Mol Cell Biol Lipids 2020;1865:158639-158639.
46.Brejchova K, Balas L, Paluchova V, Brezinova M, Durand T, Kuda O. Understanding FAHFAs: from structure to metabolic regulation. Prog Lipid Res 2020;79:101053-101053.
47.Kellerer T, Kleigrewe K, Brandl B, Hofmann T, Hauner H, Skurk T. Fatty acid esters of hydroxy fatty acids (FAHFAs) are associated with diet, BMI, and age. Front Nutr 2021;8:691401-691401.
48.Brezinova M, Kuda O, Hansikova J, et al. Levels of palmitic acid ester of hydroxystearic acid (PAHSA) are reduced in the breast milk of obese mothers. Biochim Biophys Acta Mol Cell Biol Lipids 2018;1863:126-131.
49.Zhu Q-F, Yan J-W, Gao Y, Zhang J-W, Yuan B-F, Feng Y-Q. Highly sensitive determination of fatty acid esters of hydroxyl fatty acids by liquid chromatography-mass spectrometry. J Chromatogr B Analyt Technol Biomed Life Sci 2017;1061-1062:34-40.
50.Brezinova M, Cajka T, Oseeva M, et al. Exercise training induces insulin-sensitizing PAHSAs in adipose tissue of elderly women. Biochim Biophys Acta Mol Cell Biol Lipids 2020;1865:158576-158576.
51.Nelson AB, Chow LS, Stagg DB, et al. Acute aerobic exercise reveals that FAHFAs distinguish the metabolomes of overweight and normal-weight runners. JCI Insight 2022;7(7):e158037-e158037.
52.Dongoran RA, Lin T-J, Byekyet A, Tang S-C, Yang J-H, Liu C-H. Determination of major endogenous FAHFAs in healthy human circulation: the correlations with several circulating cardiovascular-related biomarkers and anti-inflammatory effects on RAW 264.7 cells. Biomolecules 2020;10:1689-1689.
53.Tan D, Ertunc ME, Konduri S, et al. Discovery of FAHFA-containing triacylglycerols and their metabolic regulation. J Am Chem Soc 2019;141:8798-8806.
54.Paluchova V, Oseeva M, Brezinova M, et al. Lipokine 5-PAHSA is regulated by adipose triglyceride lipase and primes adipocytes for de novo lipogenesis in mice. Diabetes 2020;69:300-312.
55.Zhou P, Santoro A, Peroni OD, et al. PAHSAs enhance hepatic and systemic insulin sensitivity through direct and indirect mechanisms. J Clin Invest 2019;129:4138-4150.
56.Aryal P, Syed I, Lee J, et al. Distinct biological activities of isomers from several families of branched fatty acid esters of hydroxy fatty acids (FAHFAs). J Lipid Res 2021;62:100108-100108.
57.Syed I, Lee J, Moraes-Vieira PM, et al. Palmitic acid hydroxystearic acids activate GPR40, which is involved in their beneficial effects on glucose homeostasis. Cell Metab 2018;27(2):419.e4-427.e4.
58.Sokolowska P, Jastrzebska E, Dobrzyn A, Brzozka Z. Investigation of the therapeutic potential of new antidiabetic compounds using islet-on-a-chip microfluidic model. Biosensors (Basel) 2022;12:302-302.
59.Bandak B, Yi L, Roper MG. Microfluidic-enabled quantitative measurements of insulin release dynamics from single islets of Langerhans in response to 5-palmitic acid hydroxy stearic acid. Lab Chip 2018;18:2873-2882.
60.Pflimlin E, Bielohuby M, Korn M, et al. Acute and repeated treatment with 5-PAHSA or 9-PAHSA isomers does not improve glucose control in mice. Cell Metab 2018;28(2):217.e13-227.e13.
61.Wang Y-M, Liu H-X, Fang N-Y. High glucose concentration impairs 5-PAHSA activity by inhibiting AMP-activated protein kinase activation and promoting nuclear factor-kappa-B-mediated inflammation. Front Pharmacol 2019;9:1491-1491.
62.Syed I, Lee J, Peroni OD, et al. Methodological issues in studying PAHSA biology: masking PAHSA effects. Cell Metab 2018;28:543-546.
63.Kuda O. On the complexity of PAHSA research. Cell Metab 2018;28:541-542.
64.Benlebna M, Balas L, Bonafos B, et al. Long-term high intake of 9-PAHPA or 9-OAHPA increases basal metabolism and insulin sensitivity but disrupts liver homeostasis in healthy mice. J Nutr Biochem 2020;79:108361-108361.
65.Ginsberg HN. Insulin resistance and cardiovascular disease. J Clin Invest 2000;106:453-458.
66.Biessels GJ, Despa F. Cognitive decline and dementia in diabetes mellitus: mechanisms and clinical implications. Nat Rev Endocrinol 2018;14:591-604.
67.Gallagher EJ, LeRoith D. Obesity and diabetes: the increased risk of cancer and cancer-related mortality. Physiol Rev 2015;95:727-748.
68.Yki-Järvinen H. Thiazolidinediones. N Engl J Med 2004;351:1106-1118.
69.Wasserman DH. Four grams of glucose. Am J Physiol Endocrinol Metab 2009;296(1):E11-E21.
70.Edgerton DS, Kraft G, Smith M, et al. Insulin’s direct hepatic effect explains the inhibition of glucose production caused by insulin secretion. JCI Insight 2017;2(6):e91863-e91863.
71.Perry RJ, Camporez J-PG, Kursawe R, et al. Hepatic acetyl CoA links adipose tissue inflammation to hepatic insulin resistance and type 2 diabetes. Cell 2015;160:745-758.
72.Titchenell PM, Quinn WJ, Lu M, et al. Direct hepatocyte insulin signaling is required for lipogenesis but is dispensable for the suppression of glucose production. Cell Metab 2016;23:1154-1166.
73.Matsumoto M, Pocai A, Rossetti L, Depinho RA, Accili D. Impaired regulation of hepatic glucose production in mice lacking the forkhead transcription factor Foxo1 in liver. Cell Metab 2007;6:208-216.
74.Petersen MC, Shulman GI. Mechanisms of insulin action and insulin resistance. Physiol Rev 2018;98:2133-2223.
75.Kolar MJ, Konduri S, Chang T, et al. Linoleic acid esters of hydroxy linoleic acids are anti-inflammatory lipids found in plants and mammals. J Biol Chem 2019;294:10698-10707.
76.Lee J, Moraes-Vieira PM, Castoldi A, et al. Branched fatty acid esters of hydroxy fatty acids (FAHFAs) protect against colitis by regulating gut innate and adaptive immune responses. J Biol Chem 2016;291:22207-22217.
77.Syed I, Rubin de Celis MF, Mohan JF, et al. PAHSAs attenuate immune responses and promote β cell survival in autoimmune diabetic mice. J Clin Invest 2019;129:3717-3731.
78.Rubin de Celis MF, Garcia-Martin R, Syed I, et al. PAHSAs reduce cellular senescence and protect pancreatic beta cells from metabolic stress through regulation of Mdm2/p53. Proc Natl Acad Sci U S A 2022;119(47):e2206923119-e2206923119.
79.Hirasawa A, Hara T, Katsuma S, Adachi T, Tsujimoto G. Free fatty acid receptors and drug discovery. Biol Pharm Bull 2008;31:1847-1851.
80.Husted AS, Trauelsen M, Rudenko O, Hjorth SA, Schwartz TW. GPCR-mediated signaling of metabolites. Cell Metab 2017;25:777-796.
81.Santoro A, Zhou P, Zhu Y, Peroni OD, et al. Palmitic acid esters of hydroxy stearic acids reduce endogenous glucose production through GPR43 activation. Diabetes 2020;69:Suppl 1:1832-P-1832-P.
82.Patel R, Santoro A, Hofer P, et al. ATGL is a biosynthetic enzyme for fatty acid esters of hydroxy fatty acids. Nature 2022;606:968-975.
83.Fischer J, Lefèvre C, Morava E, et al. The gene encoding adipose triglyceride lipase (PNPLA2) is mutated in neutral lipid storage disease with myopathy. Nat Genet 2007;39:28-30.
84.Schweiger M, Lass A, Zimmermann R, Eichmann TO, Zechner R. Neutral lipid storage disease: genetic disorders caused by mutations in adipose triglyceride lipase/PNPLA2 or CGI-58/ABHD5. Am J Physiol Endocrinol Metab 2009;297:E289-E296.
85.Kolar MJ, Kamat SS, Parsons WH, et al. Branched fatty acid esters of hydroxy fatty acids are preferred substrates of the MODY8 protein carboxyl ester lipase. Biochemistry 2016;55:4636-4641.
86.Raeder H, Johansson S, Holm PI, et al. Mutations in the CEL VNTR cause a syndrome of diabetes and pancreatic exocrine dysfunction. Nat Genet 2006;38:54-62.
87.Parsons WH, Kolar MJ, Kamat SS, et al. AIG1 and ADTRP are atypical integral membrane hydrolases that degrade bioactive FAHFAs. Nat Chem Biol 2016;12:367-372.
88.Erikci Ertunc M, Kok BP, Parsons WH, et al. AIG1 and ADTRP are endogenous hydrolases of fatty acid esters of hydroxy fatty acids (FAHFAs) in mice. J Biol Chem 2020;295:5891-5905.
89.Wei J, Attaar M, Shi Z, et al. Identification of fifty-seven novel loci for abdominal wall hernia development and their biological and clinical implications: results from the UK Biobank. Hernia 2022;26:335-348.
90.Lupu C, Patel MM, Lupu F. Insights into the functional role of ADTRP (androgen-dependent TFPI-regulating protein) in health and disease. Int J Mol Sci 2021;22:4451-4451.
91.Kee Z, Ong SM, Heng C-K, Ooi DSQ. Androgen-dependent tissue factor pathway inhibitor regulating protein: a review of its peripheral actions and association with cardiometabolic diseases. J Mol Med (Berl) 2022;100:185-196.
92.Brejchova K, Radner FPW, Balas L, et al. Distinct roles of adipose triglyceride lipase and hormone-sensitive lipase in the catabolism of triacylglycerol estolides. Proc Natl Acad Sci U S A 2021;118(2):e2020999118-e2020999118.

BÌNH LUẬN