Thiếu máu liên quan đến bệnh gan – Anemia Associated With Liver Disease
Biên tập: Elliot Tapper MD, Allen Shaughnessy PharmD, M Med Ed, FCCP and William Aird MD. Cập nhật ngày 18 tháng 7, năm 2024. ©DynaMed, Bảo lưu mọi quyền.
Dịch và chú giải, vẽ hình: Bs Lê Đình Sáng
I. Tổng quan và Khuyến nghị
Bối cảnh
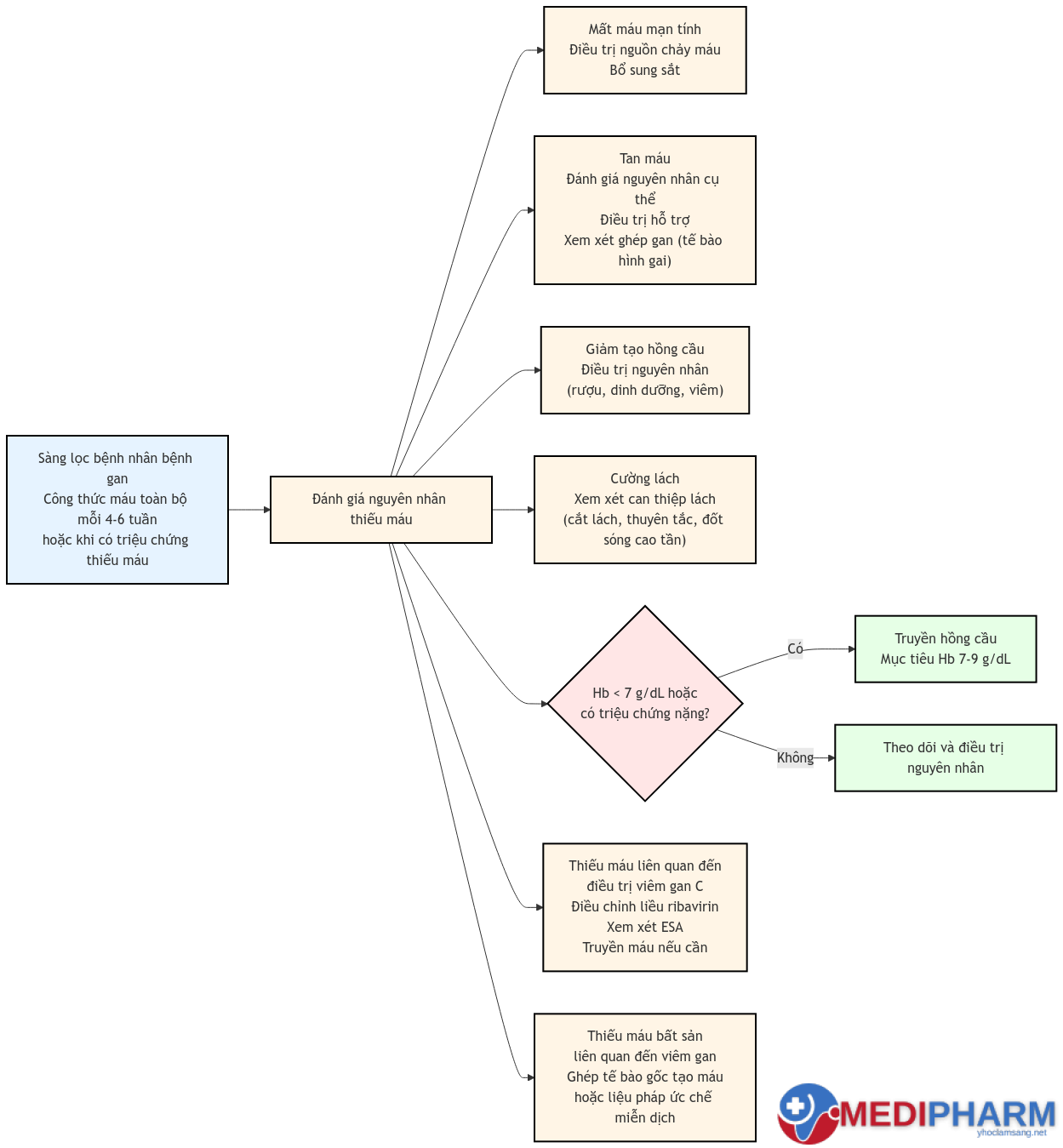
Thiếu máu, có hoặc không có thiếu sắt, thường liên quan đến bệnh gan mạn tính và có thể do mất máu đường tiêu hóa, tan máu, giảm tạo hồng cầu và/hoặc cường lách.
Khoảng 75% bệnh nhân xơ gan còn bù và tăng áp lực tĩnh mạch cửa được báo cáo là phát triển thiếu máu.
Đánh giá
- Xem xét thiếu máu ở bệnh nhân có bệnh gan có tiền sử hoặc biểu hiện lâm sàng của thiếu máu.
- Thực hiện công thức máu toàn bộ với công thức bạch cầu và đếm hồng cầu lưới cũng như phết máu ngoại vi để xác định sự hiện diện và loại thiếu máu.
- Xem xét xét nghiệm máu bổ sung để xác định các nguyên nhân tiềm ẩn của thiếu máu bao gồm chỉ số sắt, chỉ số tan máu và phết máu ngoại vi.
Quản lý
- Điều trị nguyên nhân cơ bản của thiếu máu.
- Đối với chảy máu đường tiêu hóa:
- Xác định và điều trị nguồn chảy máu cơ bản và cung cấp hỗ trợ thể tích nội mạch kịp thời và truyền hồng cầu khi cần thiết (Khuyến nghị mạnh).
- Điều trị nguồn chảy máu có thể bao gồm dùng thuốc, như thuốc co mạch và kháng sinh dự phòng, và các thủ thuật, như can thiệp nội soi, chèn bóng và shunt cửa chủ trong gan qua tĩnh mạch cổ như liệu pháp cứu hộ. Xem thêm thông tin trong phần Điều trị Xuất huyết tĩnh mạch cấp tính.
- Điều trị thiếu sắt bằng bổ sung sắt, như sắt sulfat 300-325 mg/ngày.
- Đối với thiếu máu liên quan đến viêm gan C và điều trị, mục tiêu là duy trì mức hemoglobin trên 10 g/dL (100 g/L) và giảm nhẹ triệu chứng. Nếu cần ribavirin làm liệu pháp bổ trợ, cân nhắc điều chỉnh liều ribavirin, điều trị bằng erythropoietin hoặc truyền máu để quản lý thiếu máu.
- Đối với thiếu máu bất sản liên quan đến viêm gan, cân nhắc các phương pháp điều trị tương tự như với thiếu máu bất sản vô căn bao gồm ghép tế bào gốc tạo máu và/hoặc liệu pháp ức chế miễn dịch.
II. Thông tin nền tảng
2.1. Mô tả
Mức hemoglobin thấp ở bệnh nhân mắc bệnh gan do các nguyên nhân đa yếu tố, đặc biệt là mất máu đường tiêu hóa cấp tính hoặc mạn tính có hoặc không có thiếu sắt.
2.2. Định nghĩa
Định nghĩa thiếu máu của Tổ chức Y tế Thế giới (WHO) ở mực nước biển:
Ngưỡng hemoglobin cho người không mang thai từ 15-59 tuổi:
- Hemoglobin < 13 g/dL (130 g/L) ở nam giới
- Hemoglobin < 12 g/dL (120 g/L) ở nữ giới
Ngưỡng hemoglobin cho trẻ em:
- Hemoglobin < 13 g/dL (130 g/L) ở trẻ em nam 12-14 tuổi
- Hemoglobin < 12 g/dL (120 g/L) ở trẻ em nữ không mang thai 12-14 tuổi
- Hemoglobin < 11,5 g/dL (115 g/L) ở trẻ 5-11 tuổi
- Hemoglobin < 11 g/dL (110 g/L) ở trẻ 6-59 tháng tuổi
- Hemoglobin < 10,5 g/dL (105 g/L) ở trẻ 0-5 tháng tuổi
Ngưỡng hemoglobin trong thai kỳ:
- Hemoglobin < 11 g/dL (110 g/L) trong tam cá nguyệt đầu
- Hemoglobin < 10,5 g/dL (105 g/L) trong tam cá nguyệt thứ hai
- Hemoglobin < 11 g/dL (110 g/L) trong tam cá nguyệt thứ ba
2.3. Dịch tễ học
Tỷ lệ mắc/Tỷ lệ hiện mắc:
Bệnh nhân xơ gan:
- Trong một đoàn hệ gồm 1016 bệnh nhân người lớn (<65 tuổi) bị xơ gan còn bù và tăng áp lực tĩnh mạch cửa, 761 bệnh nhân (75%) có thiếu máu sau thời gian theo dõi trung bình 43,5 tháng (25% tại thời điểm ban đầu và 50% phát triển trong quá trình theo dõi); các chỉ số huyết học cơ bản khác bao gồm:
- Chỉ giảm tiểu cầu ở 18,4%
- Không có giảm tế bào máu ở 16,7%
- Giảm tiểu cầu và giảm bạch cầu ở 12,6%
- Thiếu máu và giảm tiểu cầu ở 11,2%
- Giảm tiểu cầu, giảm bạch cầu và thiếu máu ở 7,9%
- Chỉ thiếu máu ở 4,1%
- Chỉ giảm bạch cầu ở 2,7%
- Thiếu máu và giảm bạch cầu ở 1,4%
Thiếu máu tế bào hình gai (SCA):
- Được báo cáo ở khoảng 3% bệnh nhân rối loạn sử dụng rượu có bệnh gan tiến triển
- Trong một đoàn hệ gồm 116 bệnh nhân (tuổi trung bình 55,8 tuổi, 77% nam giới) bị xơ gan tiến triển (điểm Child–Pugh–Turcott > 7) nhập viện:
- 24 bệnh nhân (20,7%) có tế bào hình gai trên phết máu ngoại vi
- 7 bệnh nhân (6%) có bằng chứng của SCA (tỷ lệ tế bào hình gai ≥ 5%, thiếu máu cần truyền máu và bằng chứng tan máu)
- Trong một đoàn hệ gồm 186 bệnh nhân (tuổi trung vị 60 tuổi, 67% nam giới) bị xơ gan nhập viện:
- Tỷ lệ tế bào hình gai:
- 0%-4% ở 119 bệnh nhân (64%)
- 5%-9% ở 49 bệnh nhân (26%)
- ≥ 10% ở 18 bệnh nhân (10%)
- Tỷ lệ tế bào hình gai:
Thiếu máu ở bệnh nhân nhiễm virus viêm gan C (HCV): Tỷ lệ mắc thiếu máu tan máu tự miễn là 1,4 trên 1.000 người-năm trong đoàn hệ gồm 120.691 người lớn nhiễm HCV (so với 0,4 trên 1.000 người-năm trong đoàn hệ gồm 454.905 người lớn không nhiễm HCV).
Bệnh nhân bệnh Wilson: Tan máu được báo cáo ở 10%-15%.
2.4. Các yếu tố nguy cơ có thể
- Mất máu do rối loạn đông máu và giảm tiểu cầu do bệnh gan
- Rối loạn sử dụng rượu
- Cường lách
- Các yếu tố nguy cơ gây thiếu máu do ribavirin ở bệnh nhân được điều trị viêm gan C bao gồm:
- Nữ giới
-
60 tuổi
- Số lượng tiểu cầu trước điều trị < 100 × 10^9/L
- Creatinin huyết thanh tăng
- Giảm hemoglobin > 2 g/dL (20 g/L) trong 4 tuần đầu điều trị
- Dân tộc châu Á
- Biến đổi di truyền của inosine triphosphate pyrophosphatase (ITPA)
2.5. Tình trạng liên quan
- Giảm tiểu cầu
- Giảm bạch cầu
- Bệnh celiac
III. Nguyên nhân và bệnh sinh
3.1. Nguyên nhân
Bảng 1: Nguyên nhân thiếu máu và các tình trạng góp phần
| Nguyên nhân | Tình trạng góp phần |
|---|---|
| Mất máu mạn tính | – Xuất huyết tĩnh mạch giãn
– Các nguồn chảy máu đường tiêu hóa khác |
| Tan máu | – Hội chứng Zieve
– Bệnh Wilson – Thiếu máu tế bào hình gai – Ribavirin như điều trị bổ trợ viêm gan C – Hội chứng HELLP* – Tiền sản giật* – Thiếu máu tan máu tự miễn** |
| Giảm tạo hồng cầu | – Rối loạn sử dụng rượu
– Thiếu hụt dinh dưỡng (ví dụ: thiếu acid folic) – Thiếu máu do viêm – Điều trị viêm gan C bằng interferon-alfa*** – Thiếu máu bất sản liên quan đến viêm gan |
| Cường lách | Tăng áp lực tĩnh mạch cửa do bệnh gan |
Chú thích: HELLP, tan máu, tăng enzym gan, giảm tiểu cầu.
- Có thể biểu hiện thiếu máu tan máu vi mạch. ** Hiếm khi liên quan đến xơ gan mật nguyên phát. *** LƯU Ý THỰC HÀNH LÂM SÀNG: interferon alfa cũng đã được liên quan đến sự phát triển của thiếu máu (thứ phát do ức chế tạo hồng cầu), nhưng việc sử dụng nó không còn được khuyến cáo bởi các hướng dẫn khác nhau trong điều trị viêm gan C.
Bằng chứng về mối liên quan giữa nhiễm virus viêm gan C hoặc điều trị bằng ribavirin và thiếu máu tan máu:
- Sofosbuvir cộng với ribavirin có thể có tỷ lệ biến cố bất lợi cao hơn, bao gồm các biến cố liên quan đến máu hoặc thiếu máu, so với sofosbuvir/velpatasvir ở bệnh nhân viêm gan C mạn tính genotype 2 hoặc genotype 3.
- Dựa trên phân tích gộp hồi cứu của các thử nghiệm ASTRAL-2 và ASTRAL-3:
- 611 người lớn (tuổi trung bình 52 tuổi) nhiễm HCV genotype 2 hoặc genotype 3 trong ≥ 6 tháng được randomized để dùng sofosbuvir cộng với ribavirin so với sofosbuvir/velpatasvir một lần mỗi ngày trong 12 tuần được đánh giá về kết cục được báo cáo bởi bệnh nhân.
- Biến cố bất lợi liên quan đến điều trị so sánh sofosbuvir cộng với ribavirin so với sofosbuvir/velpatasvir:
- Bất kỳ biến cố bất lợi nào ở 71,8% so với 43,1% (p < 0,05, NNT 4)
- Liên quan đến máu hoặc thiếu máu ở 38,6% so với 0,3% (p < 0,05, NNH 3)
- Bệnh nhân viêm gan C và điều trị viêm gan C đều có liên quan đến tăng nguy cơ thiếu máu tan máu tự miễn.
- Dựa trên nghiên cứu đoàn hệ:
- 120.691 người lớn (tuổi trung bình 52 tuổi) nhiễm virus viêm gan C (HCV) và 454.905 người lớn không nhiễm được đánh giá sau thời gian trung vị 2,5 năm (từ 6 tháng sau thời điểm ban đầu)
- Tỷ lệ mắc thiếu máu tan máu tự miễn:
- 1,4 trên 1.000 người-năm ở bệnh nhân nhiễm HCV
- 0,4 trên 1.000 người-năm ở bệnh nhân không nhiễm HCV
- Các yếu tố liên quan đến tăng nguy cơ thiếu máu tan máu tự miễn:
- Nhiễm HCV (tỷ suất nguy cơ [HR] điều chỉnh 2,8, 95% CI 2,1-3,9) so với không nhiễm
- Điều trị HCV ở những bệnh nhân nhiễm so với không nhiễm (HR điều chỉnh 3,2, 95% CI 1,5-6,7)
3.2. Nguyên nhân của bệnh gan liên quan đến thiếu máu
Thiếu máu không trực tiếp gây tổn thương gan; tuy nhiên:
- Các bệnh thiếu máu tải sắt có thể gây hemochromatosis thứ phát; bao gồm:
- Thiếu máu bất sản
- Thiếu máu tan máu mạn tính
- Thiếu máu đáp ứng với pyridoxine
- Thiếu pyruvate kinase
- Thiếu máu nguyên hồng cầu
- Beta-thalassemia thể nặng và trung gian
- Thiếu máu hồng cầu hình liềm có thể dẫn đến một số rối loạn gan và đường mật, bao gồm:
- Cơn đau gan cấp do hồng cầu hình liềm
- Cơn tắc nghẽn gan do hồng cầu hình liềm
- Tắc mật trong gan do hồng cầu hình liềm
- Sỏi mật
- Quá tải sắt ở gan do truyền máu
3.3. Cơ chế bệnh sinh
a) Cơ chế của thiếu máu do chảy máu đường tiêu hóa:
- Bệnh gan có thể làm tăng nguy cơ chảy máu đường tiêu hóa do:
- Tăng áp lực tĩnh mạch cửa dẫn đến:
- Giãn tĩnh mạch thực quản
- Giãn tĩnh mạch dạ dày
- Bệnh lý dạ dày do tăng áp lực tĩnh mạch cửa (PHG)
- Dãn mạch hang vị dạ dày (GAVE)
- Giảm sản xuất các yếu tố đông máu bởi tế bào gan
- Giảm tiểu cầu do giảm sản xuất thrombopoietin bởi tế bào gan
- Tăng áp lực tĩnh mạch cửa dẫn đến:
- Chảy máu đường tiêu hóa cấp tính (đặc biệt từ giãn tĩnh mạch thực quản hoặc dạ dày) có thể trực tiếp dẫn đến thiếu máu; chảy máu mạn tính (thường từ PHG hoặc GAVE) có thể dẫn đến thiếu máu thiếu sắt
b) Cơ chế của thiếu máu do tan máu:
- Thiếu máu tế bào hình gai:
- Tế bào hình gai là các hồng cầu đã mất hình dạng bình thường và có nhiều gai có chiều rộng và chiều dài thay đổi phân bố không đều trên bề mặt tế bào
- Thiếu máu tế bào hình gai có thể xảy ra trong cả bệnh gan do rượu và không do rượu
- Tế bào hình gai có thể xuất hiện:
- Do mất cân bằng trong chuyển hóa lipid dẫn đến tăng cholesterol (và tăng tỷ lệ cholesterol/phospholipid) trong màng tế bào với sự giảm độ lưu động màng hồng cầu và tăng tỷ lệ diện tích bề mặt/thể tích
- Khi các hồng cầu bình thường được truyền vào bệnh nhân xơ gan do rượu tiến triển và được chuyển đổi thành tế bào hình gai
- Điều kiện lách dẫn đến tế bào có các nhô ra màng không đều đặc trưng (gai)
- Loại bỏ các tế bào hình gai không biến dạng bởi đại thực bào lách có thể dẫn đến thiếu máu tan máu mạn tính
- Cắt lách loại bỏ tế bào hình gai và có thể cải thiện thiếu máu tan máu
- Hội chứng Zieve:
- Hội chứng Zieve bao gồm bộ ba lâm sàng:
- Viêm gan nhiễm mỡ do rượu
- Tăng lipid máu
- Thiếu máu tan máu âm tính với test kháng globulin trực tiếp (DAT) (test Coombs)
- Viêm gan và tan máu góp phần gây tăng bilirubin máu
- Cơ chế chưa được hiểu rõ hoàn toàn, nhưng tan máu có thể do thay đổi cấu trúc màng hồng cầu, dẫn đến tế bào hình gai
- Hội chứng Zieve bao gồm bộ ba lâm sàng:
- Bệnh Wilson:
- Bệnh Wilson là rối loạn bài tiết đồng dẫn đến giảm bài tiết đồng vào mật
- Tích tụ đồng trong gan dẫn đến bệnh gan nặng thường kèm theo tan máu đáng kể
- Thiếu máu tan máu âm tính với DAT (test Coombs) có thể là biểu hiện ban đầu
- Phá hủy tế bào gan có thể dẫn đến giải phóng lượng lớn đồng dự trữ, làm trầm trọng thêm tan máu
- Thiếu máu tan máu có thể xảy ra như một đợt đơn lẻ, tái phát hoặc thiếu máu mạn tính mức độ nhẹ
- Viêm gan:
- Thiếu máu bất sản liên quan đến viêm gan được coi là một biến thể của thiếu máu bất sản
- Cơ chế bệnh sinh cơ bản có thể liên quan đến phá hủy tế bào tạo máu sớm qua trung gian tế bào T
- Cải thiện nhanh chóng sau khi dùng các thuốc ức chế miễn dịch phù hợp với cơ chế bệnh sinh qua trung gian miễn dịch
- Đề xuất rằng virus có thể gây kích hoạt lympho bào
- Chiều dài telomere lympho bào ngắn đã được báo cáo ở một nhóm nhỏ bệnh nhân
- Thường âm tính với huyết thanh (tác nhân gây bệnh không rõ), nhưng đã được liên quan với:
- Virus viêm gan A (HAV)
- Virus viêm gan B (HBV)
- Virus viêm gan C (HCV)
- Virus viêm gan E (HEV)
- Parvovirus B19
- Virus Epstein-Barr (EBV)
- Virus lây truyền qua truyền máu
- Echovirus
- Virus GB-C
- Virus SEN
- Sử dụng ribavirin để điều trị nhiễm HCV có thể dẫn đến thiếu máu tan máu:
- Gây thiếu máu tan máu phụ thuộc liều có thể hồi phục trong 4-8 tuần sau khi ngừng thuốc
- Được chuyển đổi thành ribavirin monophosphate, diphosphate và triphosphate trong hồng cầu; tích tụ ribavirin phosphate dẫn đến độc tính tế bào và tan máu sau đó
c) Cơ chế của thiếu máu do giảm tạo hồng cầu:
- Rối loạn sử dụng rượu:
- Rối loạn sử dụng rượu có thể làm trầm trọng thêm thiếu máu ở bệnh nhân bệnh gan do tăng nguy cơ thiếu hụt dinh dưỡng, đặc biệt là thiếu acid folic, dẫn đến giảm tạo hồng cầu
- Rượu cũng có tác dụng độc trực tiếp lên tủy xương có thể dẫn đến giảm tạo hồng cầu và thiếu máu sau đó
- Liên quan đến nguyên hồng cầu vòng trong tủy xương (thiếu máu nguyên hồng cầu)
- Hiện diện ở 30%-40% bệnh nhân nhập viện do rối loạn sử dụng rượu
- Có thể do tác dụng độc của ethanol lên ≥ 1 bước trong tổng hợp heme
- Hiện diện ở khoảng một phần ba bệnh nhân rối loạn sử dụng rượu nặng
- Phổ biến hơn ở những người rối loạn sử dụng rượu bị suy dinh dưỡng
- Thường biến mất sau 5-7 ngày cai rượu
- Vai trò của thay đổi nguyên hồng cầu trong việc gây thiếu máu chưa rõ ràng
- Điều trị viêm gan C:
- Hầu hết thiếu máu do điều trị viêm gan C được cho là do tan máu do ribavirin
- LƯU Ý THỰC HÀNH LÂM SÀNG: Interferon alfa cũng đã được liên quan đến sự phát triển của thiếu máu (thứ phát do ức chế tạo hồng cầu), nhưng việc sử dụng nó không còn được khuyến cáo bởi các hướng dẫn khác nhau trong điều trị viêm gan C.
d) Cơ chế của thiếu máu do cường lách:
- Cường lách được định nghĩa là một hội chứng bao gồm:
- Lách to
- Thiếu máu, giảm bạch cầu và/hoặc giảm tiểu cầu
- Tủy xương tăng sinh bù trừ
- Cải thiện sau cắt lách (nếu được thực hiện)
- Thường xảy ra ở bệnh nhân tăng áp lực tĩnh mạch cửa, hiếm khi ở những người bị huyết khối tĩnh mạch lách
- Cường lách thường dẫn đến thiếu máu khi lách đạt kích thước gấp 3-5 lần bình thường
- Vì nguyên nhân thiếu máu ở bệnh nhân xơ gan là đa yếu tố, hầu hết các nghiên cứu về cường lách tập trung vào biểu hiện giảm tiểu cầu và giảm bạch cầu
- Có một số cơ chế mà cường lách có thể dẫn đến thiếu máu:
- Tăng cô đặc trong lách do kích thước lách lớn hơn có thể trực tiếp dẫn đến 1 hoặc nhiều dòng tế bào giảm
- Lách to có thể dẫn đến giảm thời gian sống của hồng cầu (một số bằng chứng cho thấy nồng độ glucose của tủy lách thấp hơn trong lách to, có thể giải thích thời gian sống ngắn hơn của hồng cầu) và thiếu máu sau đó, đặc biệt nếu đáp ứng tủy xương không đầy đủ
- Cường lách liên quan đến tăng thể tích huyết tương qua cơ chế chưa rõ, điều này cũng có thể góp phần gây thiếu máu
IV. Tiền sử và thăm khám
4.1. Biểu hiện lâm sàng
- Thiếu máu không có triệu chứng có thể được phát hiện trong đánh giá sức khỏe định kỳ hoặc tình cờ trong quá trình kiểm tra các tình trạng khác
- Biểu hiện lâm sàng của thiếu máu bao gồm:
- Mệt mỏi
- Khó thở khi gắng sức, thở nhanh
- Nhịp tim nhanh, ngất, đau ngực
- Đau đầu
- Da xanh nhợt
- Tiền sử nên bao gồm khởi phát và thời gian của các triệu chứng, bệnh đồng mắc, tiền sử gia đình và tiền sử hiện tại hoặc trong quá khứ của các tình trạng liên quan đến thiếu máu
- Bệnh nhân thiếu sắt có thể biểu hiện:
- Mệt mỏi
- Da xanh nhợt
- Móng tay dễ gãy
- Viêm miệng góc
- Viêm lưỡi
- Màng thực quản và họng
- Nhịp tim nhanh và suy tim nặng hơn
- Đau đầu
- Ù tai
- Rối loạn vị giác
- Chứng thèm ăn các chất không phải thức ăn
- Bệnh nhân cường lách có thể biểu hiện các triệu chứng của lách to, bao gồm:
- Đau, đau nhói hoặc cảm giác đầy ở vùng bụng trên bên trái
- Cảm giác no sớm
- Bệnh nhân xơ gan có thể biểu hiện các triệu chứng:
- Mệt mỏi
- Yếu
- Sụt cân
- Chán ăn
- Ngứa da
- Vàng da
- Phù bụng hoặc chi dưới do ứ dịch
- Chảy máu đường tiêu hóa trên
- Thay đổi trạng thái tâm thần
- Các dấu hiệu thực thể của xơ gan hoặc tăng áp lực tĩnh mạch cửa có thể rõ ràng
- Một số dấu hiệu thực thể đặc hiệu cho xơ gan nhưng không có dấu hiệu thực thể nào nhạy cho xơ gan ở bệnh nhân bệnh gan
- Dựa trên tổng quan hệ thống:
- Tổng quan hệ thống của 86 nghiên cứu chẩn đoán đánh giá các chỉ số lâm sàng để phát hiện xơ gan ở 19.533 bệnh nhân người lớn mắc bệnh gan
- Độ chính xác chẩn đoán của các dấu hiệu thực thể đối với xơ gan ở bệnh nhân bệnh gan
Kết quả theo thứ tự tỷ số khả dĩ dương giảm dần:
| Dấu hiệu | Độ nhạy | Độ đặc hiệu | Tỷ số khả dĩ dương | Tỷ số khả dĩ âm | Số nghiên cứu |
|---|---|---|---|---|---|
| Bạch điểm móng tay (đổi màu trắng trên móng) | 20%-72% | 89%-96% | 2,7-11,5 | 0,30-0,85 | 2 |
| Vú to ở nam | 6%-41% | 95%-99% | 4,5-6,7 | 0,60-0,96 | 2 |
| Giãn tĩnh mạch bụng (đầu Medusa) | 6% | 99% | 6 | 0,95 | 1 |
| Bệnh não | 17% | 97% | 5 | 0,86 | 1 |
| Giảm lông cơ thể | 10% | 98% | 5 | 0,92 | 1 |
| Cổ trướng | 20% | 97% | 3,98 | 0,84 | 1 |
| Giãn mạch mặt | 23%-72% | 78%-92% | 1,9-3,4 | 0,30-0,93 | 2 |
| Teo tinh hoàn | 18% | 95% | 3,6 | 0,86 | 1 |
| Hồng ban lòng bàn tay | 23% | 95% | 3 | 0,87 | 1 |
| Sao mạch | 50% | 85% | 2,8 | 0,65 | 1 |
| Vàng da | 44% | 85% | 2,5 | 0,70 | 1 |
| Lách to | 50% | 80% | 2,5 | 0,62 | 1 |
| Gan cứng | 68% | 75% | 2,0 | 0,49 | 1 |
| Phù ngoại vi | 36% | 82% | 2 | 0,78 | 1 |
| Gan to | 60% | 70% | 1,9 | 0,57 | 1 |
- Các triệu chứng khởi phát của bệnh Wilson không đặc hiệu và thường biểu hiện như sự kết hợp không rõ ràng của các dấu hiệu gan, thần kinh, tâm thần và mắt
- Các triệu chứng khởi phát của thiếu máu liên quan đến điều trị viêm gan C phụ thuộc vào mức độ và tốc độ giảm hemoglobin
- Bệnh nhân thiếu máu bất sản liên quan đến viêm gan:
- Thường phát triển thiếu máu bất sản nặng 2-3 tháng sau một đợt viêm gan cấp tính
- Có thể biểu hiện các dấu hiệu và triệu chứng khác nhau liên quan đến giảm ba dòng tế bào máu, bao gồm:
- Biểu hiện chảy máu thứ phát do giảm tiểu cầu
- Mệt mỏi và xanh xao do thiếu máu tiến triển
- Sốt, loét niêm mạc và nhiễm trùng vi khuẩn thứ phát do giảm bạch cầu trung tính
- Bệnh nhân hội chứng Zieve có thể biểu hiện:
- Sốt
- Đau bụng, đặc biệt là vùng bụng trên bên phải
- Một số người coi hội chứng Zieve là một biến thể của thiếu máu tế bào hình gai nhưng các đặc điểm riêng biệt của hội chứng Zieve bao gồm:
- Tự giới hạn (thường hết trong vòng vài ngày)
- Liên quan đến thiếu máu tan máu nhẹ
- Có thể kèm theo sốt và đau bụng, các đặc điểm không có trong thiếu máu tế bào hình gai
- Bệnh nhân nằm viện với bệnh gan do rượu có thể biểu hiện:
- Thay đổi nguyên hồng cầu trong tủy xương
- Mất máu cấp tính
- Nguyên hồng cầu có vòng (> 15% hoặc hơn trong các tế bào hạt đỏ)
- Không có dự trữ sắt trong tủy xương
4.2. Chẩn đoán
a) Thiết lập chẩn đoán
Chẩn đoán thiếu máu:
- Thiếu máu được chẩn đoán dựa trên tiêu chuẩn của Tổ chức Y tế Thế giới (WHO) về mức hemoglobin:
- < 13 g/dL (130 g/L) ở nam giới
- < 12 g/dL (120 g/L) ở nữ giới
Chẩn đoán các bệnh gan chính có thể dẫn đến thiếu máu:
Chẩn đoán xơ gan:
- Thường dựa trên xét nghiệm máu cho thấy tăng transaminase, giảm tiểu cầu và kéo dài thời gian prothrombin
- Siêu âm bụng có thể phát hiện nốt, teo, không đều hoặc tăng âm gợi ý xơ gan
- Sinh thiết gan có thể thiết lập chẩn đoán nhưng thường không cần thiết nếu chẩn đoán rõ ràng từ các dữ liệu lâm sàng, xét nghiệm và X-quang khác
Chẩn đoán bệnh gan do rượu gợi ý bởi:
- Vàng da
- Xét nghiệm chức năng gan bất thường, bao gồm:
- Tăng nồng độ aminotransferase huyết thanh
- Nồng độ aspartate aminotransferase (AST) tăng nhưng thường < 300 đơn vị/mL
- Tỷ lệ AST trên alanine aminotransferase > 2
- Tăng số lượng bạch cầu ngoại vi, số lượng bạch cầu trung tính và INR
- Các nghiên cứu hình ảnh có thể giúp xác định các thay đổi nhiễm mỡ, xơ gan hoặc ung thư biểu mô tế bào gan, cũng như loại trừ các tình trạng khác
Chẩn đoán lách to bằng chẩn đoán hình ảnh bụng:
- Siêu âm – có thể xác nhận sự hiện diện của lách to, phân biệt tổn thương khu trú với phì đại lan tỏa và hỗ trợ chẩn đoán lách to do ứ máu
- Chụp cắt lớp vi tính – giới hạn trên của thể tích lách bình thường là 314,5 cm3 tương ứng với chiều dài lách tối đa là 12,6 cm
Chẩn đoán thiếu máu bất sản liên quan đến viêm gan được gợi ý bởi:
- Giảm ba dòng tế bào máu (sự hiện diện đồng thời của giảm bạch cầu trung tính, thiếu máu và giảm tiểu cầu) cùng với giảm hồng cầu lưới tuyệt đối
- Các phát hiện điển hình trên sinh thiết tủy xương bao gồm:
- Giảm tế bào nặng ảnh hưởng đến tiền thân hồng cầu và bạch cầu cũng như megakaryocyte
- Phần lớn là tế bào mỡ và mô đệm tủy trong khoang tủy
- Các tế bào tạo máu còn sót lại có hình thái bình thường
- Thiếu thâm nhiễm ác tính, xơ hóa và tạo máu nguyên hồng cầu
4.3. Chẩn đoán phân biệt
Xem phần Nguyên nhân để biết danh sách các bệnh gan do thiếu máu và thiếu máu liên quan đến bệnh gan
4.4. Tổng quan về xét nghiệm
- Thực hiện công thức máu toàn bộ với công thức bạch cầu và đếm hồng cầu lưới; phân loại thiếu máu dựa trên thể tích trung bình hồng cầu có thể hướng dẫn tìm nguyên nhân thiếu máu
- Xét nghiệm bổ sung để xác định các nguyên nhân có thể gây thiếu máu khi được chỉ định, bao gồm:
- Chỉ số sắt
- Đánh giá các chỉ số tan máu, bao gồm:
- Haptoglobin (có thể giảm trong bệnh gan mạn tính)
- Bilirubin
- Lactate dehydrogenase
- Test kháng globulin trực tiếp (test Coombs)
- Phết máu ngoại vi
- Các xét nghiệm máu khác có thể giúp đánh giá mức độ nặng hoặc xác định nguyên nhân của xơ gan (nhưng không thể được sử dụng để loại trừ xơ gan)
- Các xét nghiệm đánh giá mức độ nặng và biến chứng bao gồm:
- Xét nghiệm đông máu
- Xét nghiệm chức năng gan
- Các xét nghiệm xác định nguyên nhân bao gồm:
- Xét nghiệm huyết thanh viêm gan B và viêm gan C
- Nồng độ alpha-1 antitrypsin và xác định kiểu gen bằng điện di đẳng điện
- Kháng thể tự miễn; bao gồm kháng thể kháng nhân, kháng thể kháng microsome gan-thận type 1 và kháng thể kháng kháng nguyên gan hòa tan
- Kháng thể kháng mitochondria nếu bệnh ứ mật (để phát hiện xơ gan mật nguyên phát)
- Ceruloplasmin huyết thanh và đồng huyết thanh ở bệnh nhân nghi ngờ bệnh Wilson
- Xét nghiệm gen bệnh hemochromatosis
- Các xét nghiệm đánh giá mức độ nặng và biến chứng bao gồm:
- Xem xét các nghiên cứu hình ảnh, bao gồm:
- Siêu âm, chụp cắt lớp vi tính và chụp xạ hình đồng vị phóng xạ lách để phát hiện lách to
- Siêu âm gan để phát hiện nốt, teo, không đều hoặc tăng âm gợi ý xơ gan, thay đổi mỡ hoặc ung thư biểu mô tế bào gan, cũng như loại trừ các tình trạng khác
- Đo độ đàn hồi gan thoáng qua (Fibroscan) có thể giúp phân tầng bệnh nhân thành các giai đoạn xơ hóa gan khác nhau; một số mô hình mới hơn cũng có thể định lượng gan nhiễm mỡ
- Xem xét sinh thiết gan ở bệnh nhân nghi ngờ xơ gan để thiết lập chẩn đoán khi các xét nghiệm khác không kết luận
- Hút tủy và sinh thiết có thể cho thấy các thay đổi phù hợp với rối loạn sử dụng rượu hoặc thiếu máu bất sản liên quan đến viêm gan
4.5. Xét nghiệm máu
Công thức máu toàn bộ:
- Hemoglobin (Hb) thấp (theo định nghĩa)
- Số lượng bạch cầu có thể:
- Giảm trong cường lách
- Tăng trong gan nhiễm mỡ cấp tính của thai kỳ
- Số lượng tiểu cầu có thể giảm trong cường lách
- Giảm ba dòng tế bào máu (sự hiện diện đồng thời của giảm bạch cầu trung tính, thiếu máu và giảm tiểu cầu) trong thiếu máu bất sản liên quan đến viêm gan
Thể tích trung bình hồng cầu:
- Thiếu máu bình sắc ở bệnh nhân bệnh gan có thể do:
- Mất máu cấp tính (ví dụ: xuất huyết tĩnh mạch giãn cấp tính, thường do xơ gan)
- Lách to, có thể do tăng áp lực tĩnh mạch cửa, thường do xơ gan
- Thiếu máu do viêm, có thể xảy ra ở bệnh nhân xơ gan
- Thuốc điều trị viêm gan C (ví dụ: ribavirin)
- Bệnh Wilson, có thể biểu hiện với thiếu máu tan máu
- Thiếu máu nhược sắc ở bệnh nhân bệnh gan bao gồm:
- Thiếu máu thiếu sắt, có thể do mất máu (ví dụ: ở bệnh nhân bị viêm dạ dày do tăng áp lực tĩnh mạch cửa)
- Thiếu máu nguyên hồng cầu do bệnh gan liên quan đến rượu
- Thiếu máu đa sắc ở bệnh nhân bệnh gan có thể do:
- Thiếu vitamin B12
- Rối loạn sử dụng rượu
- Chỉ số phân bố hồng cầu tăng
Đếm hồng cầu lưới:
- Thường thấp trong bệnh gan mạn tính
- Giảm hồng cầu lưới tuyệt đối trong thiếu máu bất sản liên quan đến viêm gan
Phết máu ngoại vi:
- Các thay đổi hình thái điển hình của hồng cầu bao gồm:
- Hồng cầu to – thường tròn, không oval
- Tế bào đích (còn gọi là codocyte)
- Tế bào miệng
- Biến dạng kích thước hồng cầu
- Các phát hiện khác bao gồm:
- Tế bào gai (còn gọi là burr cell)
- Thể Pappenheimer trong một phần ba đến một nửa bệnh nhân rối loạn sử dụng rượu
Chỉ số sắt – sắt huyết thanh và transferrin:
- Độ bão hòa transferrin (tính từ sắt huyết thanh và transferrin)
- Ferritin huyết thanh
- Ferritin huyết thanh < 15 ng/mL cho thấy dự trữ sắt cạn kiệt (BCSH Grade A)
- Mức ferritin huyết thanh cao tới 1.000 ng/mL ở bệnh nhân bệnh thận mạn tính không loại trừ tình trạng thiếu sắt hạn chế tạo hồng cầu và đáp ứng với sắt đường tĩnh mạch
- Đánh giá quá tải sắt khi ferritin huyết thanh > 1.000 ng/mL (BCSH Grade B)
LƯU Ý THỰC HÀNH LÂM SÀNG: Sự hiện diện của thiếu máu không loại trừ khả năng mắc bệnh hemochromatosis vì xơ gan có thể gây thiếu máu độc lập với dự trữ sắt.
Chỉ số tan máu:
- Haptoglobin có thể giảm trong bệnh gan mạn tính
- Bilirubin tăng
- Lactate dehydrogenase tăng
- Test kháng globulin trực tiếp (test Coombs) để tìm tan máu qua trung gian miễn dịch
Các xét nghiệm máu khác có thể giúp đánh giá mức độ nặng hoặc xác định nguyên nhân của xơ gan (nhưng không thể được sử dụng để loại trừ xơ gan):
- Các xét nghiệm đánh giá mức độ nặng và biến chứng bao gồm:
- Thời gian prothrombin/INR
- Thời gian thromboplastin từng phần hoạt hóa
- Xét nghiệm chức năng gan
- Aspartate aminotransferase
- Alanine aminotransferase
- Gamma-glutamyltransferase
- Phosphatase kiềm
- Bilirubin huyết thanh
- Albumin huyết thanh
- Các xét nghiệm xác định nguyên nhân bao gồm:
- Xét nghiệm huyết thanh viêm gan B và viêm gan C
- Nồng độ alpha-1 antitrypsin và xác định kiểu gen bằng điện di đẳng điện
- Kháng thể tự miễn bao gồm:
- Kháng thể kháng nhân
- Kháng thể kháng microsome gan-thận type 1
- Kháng thể kháng kháng nguyên gan hòa tan
- Kháng thể kháng mitochondria nếu bệnh ứ mật (để phát hiện xơ gan mật nguyên phát)
- Ceruloplasmin huyết thanh và đồng huyết thanh ở bệnh nhân nghi ngờ bệnh Wilson
- Xét nghiệm gen bệnh hemochromatosis nếu độ bão hòa transferrin lúc đói > 45%
Tỷ lệ tế bào hình gai ≥ 10% liên quan đến bilirubin, INR, hemoglobin, số lượng hồng cầu lưới và quá tải sắt cao hơn so với tỷ lệ tế bào hình gai 5%-9% ở bệnh nhân xơ gan:
- Dựa trên nghiên cứu đoàn hệ:
- 186 bệnh nhân (67% nam giới, tuổi trung vị 60 tuổi) bị xơ gan nhập viện được theo dõi trong thời gian trung vị 1,1 tháng
- 18 bệnh nhân (10%) có tỷ lệ tế bào hình gai ≥ 10% (thiếu máu tế bào hình gai); 49 bệnh nhân (26%) có tỷ lệ tế bào hình gai 5%-9%
- So sánh bệnh nhân có tỷ lệ tế bào hình gai ≥ 10% với tỷ lệ tế bào hình gai 5%-9%:
- Bilirubin toàn phần 12,8 mg/dL (218,9 μmol/L) so với 7,0 mg/dL (119,7 μmol/L) (p < 0,05)
- INR 2,1 so với 1,7 (p < 0,05)
- Hb 8,1 g/dL (81 g/L) so với 9,4 g/dL (94 g/L) (p = 0,02)
- Số lượng hồng cầu lưới hiệu chỉnh 4% so với 2% (p = 0,03)
- Nồng độ ferritin huyết thanh 700 μg/L so với 387 μg/L (p = 0,01)
4.6. Nghiên cứu hình ảnh
Chẩn đoán hình ảnh để đánh giá lách:
- Siêu âm:
- Có thể xác nhận sự hiện diện của lách to, phân biệt tổn thương khu trú với phì đại lan tỏa và hỗ trợ chẩn đoán lách to do ứ máu
- Ưu điểm bao gồm tính di động và không sử dụng bức xạ ion hóa
- Chiều dài sọ đuôi thường được đo
- Giới hạn trên của bình thường được báo cáo thay đổi từ 11 cm đến 13 cm
- Chiều dài tương quan tốt với thể tích lách (đặc biệt khi sử dụng tư thế nằm nghiêng phải)
- Các chỉ số khác của lách to được báo cáo bao gồm:
- Đo trước-sau > hai phần ba khoảng cách giữa thành bụng trước và sau
- Chiều rộng lách > 7 cm và đường kính > 4 cm
- Chụp cắt lớp vi tính bao gồm đo chiều dài lách, “chỉ số lách” (tích của chiều dài, chiều sâu và chiều rộng) và tổng thể tích của các lát cắt liên tiếp:
- Được báo cáo có độ tái lập cao hơn siêu âm
- Có thể được sử dụng để đánh giá các cơ quan khác nếu nghi ngờ rối loạn hệ thống
- Thể tích lách bình thường dao động từ 107,2 cm3 đến 314,5 cm3
- Giới hạn trên của thể tích lách bình thường là 314,5 cm3 tương ứng với chiều dài lách tối đa là 12,6 cm
- Xạ hình đồng vị phóng xạ – ngưỡng cắt phổ biến nhất cho chiều dài lách bình thường là 13 cm
Chẩn đoán hình ảnh để đánh giá gan:
- Siêu âm:
- Các phát hiện ở bệnh nhân xơ gan bao gồm:
- Nốt
- Tăng âm
- Teo thùy phải
- Phì đại thùy trái
- Siêu âm vùng bụng trên bên phải có thể giúp đánh giá tăng áp lực tĩnh mạch cửa, khối gan, huyết khối tĩnh mạch cửa (cấp tính và mạn tính) và cổ trướng
- Các phát hiện ở bệnh nhân xơ gan bao gồm:
- Đo độ đàn hồi gan thoáng qua (Fibroscan):
- Đánh giá không xâm lấn mức độ xơ hóa gan thông qua đo độ cứng của gan
- Độ cứng của gan được đo bằng cách sử dụng rung động do đầu dò tạo ra ở tần số thấp (50 Hz) và biên độ, sau đó siêu âm xung-phản hồi theo dõi sự lan truyền của sóng biến dạng qua nhu mô gan
- Hữu ích để phân tầng bệnh nhân thành các giai đoạn xơ hóa gan khác nhau
- Thiết bị mới hơn có thể định lượng gan nhiễm mỡ
4.7. Sinh thiết và giải phẫu bệnh
Các phát hiện sinh thiết gan ở bệnh nhân xơ gan có thể cho thấy:
- Thâm nhiễm mỡ ở gan
- Thoái hóa tế bào dạng bóng
- Thể Mallory
- Hoại tử tế bào gan
- Xơ hóa
- Xơ gan
Các phát hiện hút tủy và sinh thiết ở bệnh nhân:
- Rối loạn sử dụng rượu có thể bao gồm:
- Không bào hóa của tiền thân hồng cầu trong tủy xương
- Nguyên hồng cầu có vòng trong tủy xương
- Thay đổi nguyên hồng cầu trong tủy xương
- Dự trữ sắt cạn kiệt
- Thiếu máu bất sản liên quan đến viêm gan có thể bao gồm:
- Giảm tế bào nặng ảnh hưởng đến tiền thân hồng cầu và bạch cầu cũng như megakaryocyte
- Phần lớn là tế bào mỡ và mô đệm tủy trong khoang tủy
- Các tế bào tạo máu còn sót lại có hình thái bình thường
- Thiếu thâm nhiễm ác tính, xơ hóa và tạo máu nguyên hồng cầu
V. Quản lý
5.1. Tổng quan quản lý
Điều trị thiếu máu liên quan đến rối loạn gan phụ thuộc vào tình trạng cơ bản:
- Bệnh nhân bị chảy máu đường tiêu hóa:
- Cung cấp hỗ trợ thể tích nội mạch kịp thời và truyền hồng cầu khi cần thiết (AASLD/ACG Class I, Level B); nên truyền hồng cầu khối một cách thận trọng, bắt đầu khi hemoglobin (Hb) đạt khoảng 7 g/dL (70 g/L) với mục tiêu duy trì mức Hb ở 7-9 g/dL (70-90 g/L)
- Nguồn chảy máu cần được điều trị, bao gồm:
- Thuốc (như thuốc co mạch và kháng sinh dự phòng)
- Can thiệp nội soi và thủ thuật phẫu thuật
- Bệnh nhân thiếu sắt – điều trị bằng bổ sung sắt
- Bệnh nhân viêm gan C và thiếu máu liên quan đến điều trị:
- Mục tiêu quản lý thiếu máu là:
- Duy trì mức Hb trên 10 g/dL (100 g/L)
- Giảm nhẹ triệu chứng
- Khả năng tiếp tục liệu pháp ribavirin nếu được chỉ định
- Các chiến lược quản lý thiếu máu bao gồm:
- Điều chỉnh liều ribavirin nếu ribavirin được yêu cầu làm liệu pháp bổ trợ
- Các chất kích thích tạo hồng cầu
- Truyền máu
- Mục tiêu quản lý thiếu máu là:
- Bệnh nhân cường lách; điều trị có thể bao gồm:
- Cắt lách
- Thuyên tắc lách một phần
- Đốt sóng cao tần
- Bệnh nhân thiếu máu tế bào hình gai:
- Điều trị là hỗ trợ
- Bằng chứng hạn chế cho các phương pháp điều trị đề xuất có thể bao gồm:
- Ghép gan chỉnh hình
- Tiêm tĩnh mạch phospholipid
- Flunarizine (không có sẵn ở Hoa Kỳ)
- Bệnh nhân thiếu máu bất sản liên quan đến viêm gan:
- Điều trị tương tự như những người bị thiếu máu bất sản vô căn, bao gồm:
- Ghép tế bào gốc tạo máu
- Liệu pháp ức chế miễn dịch
- Có thể cần truyền hồng cầu hoặc tiểu cầu trước khi bắt đầu điều trị
- Điều trị tương tự như những người bị thiếu máu bất sản vô căn, bao gồm:
- Để quản lý rối loạn đông máu, xem phần Quản lý của Xơ gan gan và Truyền tiểu cầu để biết thêm thông tin
5.2. Thuốc
Bổ sung sắt:
- Thiếu sắt do mất máu mạn tính có thể được điều trị bằng sắt đường uống hoặc sắt đường tĩnh mạch trong trường hợp bệnh gan mạn tính tiến triển
Các chất kích thích tạo hồng cầu (ESAs):
- ESAs bao gồm các chất như epoetin alfa và darbepoetin alfa
- Đối với thiếu máu liên quan đến ribavirin, lợi ích được báo cáo của ESA bao gồm:
- Cải thiện thiếu máu tan máu
- Tiếp tục hoặc sử dụng liều ribavirin cao hơn nếu cần thiết (có thể dẫn đến cải thiện hiệu quả kháng virus)
- Cải thiện chất lượng cuộc sống
- Nếu xem xét ESA làm phương pháp điều trị thiếu máu ở bệnh nhân viêm gan C đang dùng ribavirin như một phần của liệu pháp, xem J Viral Hepat 2012 Feb;19(2):91-5 để biết hướng dẫn (hướng dẫn của Hiệp hội Nghiên cứu Gan Thụy Sĩ về sử dụng erythropoietin trong điều trị thiếu máu trong liệu pháp viêm gan C mạn tính) để có thêm hướng dẫn
- Cảnh báo của FDA về sử dụng ESA trong các chất kích thích tạo hồng cầu để biết thêm thông tin
- Thiếu máu tế bào đỏ đơn thuần đã được báo cáo ở bệnh nhân viêm gan C đang nhận liệu pháp kháng virus và ESA
Thuốc điều trị chảy máu đường tiêu hóa:
- Đối với bệnh nhân bị chảy máu đường tiêu hóa, nguồn chảy máu cần được điều trị; các lựa chọn thuốc bao gồm:
- Thuốc co mạch, bao gồm terlipressin, octreotide, somatostatin hoặc vapreotide (terlipressin, somatostatin và vapreotide không có sẵn ở Hoa Kỳ)
- Kháng sinh dự phòng – norfloxacin (không có sẵn ở Hoa Kỳ) hoặc ciprofloxacin được đề xuất
Thuốc điều trị thiếu máu tế bào hình gai:
- Bằng chứng hạn chế cho việc quản lý bằng thuốc đối với thiếu máu tế bào hình gai
- Truyền phosphatidylcholine không bão hòa được báo cáo làm giảm tỷ lệ tế bào hình gai và mức bilirubin không liên hợp ở 4 bệnh nhân bị xơ gan nặng và thiếu máu tế bào hình gai trong loạt ca (phosphatidylcholine tiêm không có sẵn ở Hoa Kỳ)
- Flunarizine (một chất đối kháng canxi không có sẵn ở Hoa Kỳ) được báo cáo gây cải thiện tình trạng huyết học (bao gồm mức hemoglobin) và tình trạng chung ở 2 bệnh nhân (phụ nữ 56 tuổi và 69 tuổi) bị xơ gan và thiếu máu tế bào hình gai trong loạt ca
- Liệu pháp kết hợp flunarizine, pentoxifylline và cholestyramine được báo cáo gây hồi phục từ thiếu máu, cải thiện tăng bilirubin máu và giảm tế bào hình gai ở một người đàn ông 45 tuổi bị vàng da tiến triển liên quan đến bệnh gan do rượu trong báo cáo ca
Các thuốc khác:
- Liệu pháp ức chế miễn dịch cho thiếu máu bất sản liên quan đến viêm gan:
- 1 trong 2 lựa chọn chính cho điều trị
- Liệu pháp thay thế đầu tay nếu không thể xác định được người cho phù hợp HLA cho ghép tế bào gốc tạo máu
- Đơn trị liệu với globulin kháng tế bào lympho (ATG), globulin kháng lympho (không có sẵn ở Hoa Kỳ) hoặc cyclosporine được báo cáo gây đáp ứng ở khoảng 70%
- Các phác đồ kết hợp mạnh hơn của các thuốc ức chế miễn dịch trên cộng với corticosteroid, yếu tố kích thích tạo cụm bạch cầu hạt hoặc yếu tố kích thích tạo cụm bạch cầu hạt-đại thực bào được báo cáo đạt tỷ lệ đáp ứng khoảng 75%-80%
- Liệu pháp ức chế miễn dịch được báo cáo gây đáp ứng ở 87,5% trẻ em bị thiếu máu bất sản liên quan đến viêm gan (bằng chứng cấp độ 3 [thiếu trực tiếp])
- Dựa trên loạt ca:
- 24 trẻ em (tuổi trung vị 9 năm) bị thiếu máu bất sản liên quan đến viêm gan được điều trị bằng liệu pháp ức chế miễn dịch với ATG và CsA được đánh giá
- Tỷ lệ đáp ứng tổng thể 87,5%
- Đáp ứng hoàn toàn được báo cáo ở 13 trẻ (54,2%) sau 6 tháng
- Đáp ứng một phần được báo cáo ở 8 trẻ (33,3%) sau 6 tháng
- Tỷ lệ sống sót tổng thể sau 5 năm là 87,5%
- Dựa trên loạt ca:
5.3. Các sản phẩm máu
Truyền hồng cầu:
- Xuất huyết tĩnh mạch giãn:
- Khuyến nghị truyền máu trong xuất huyết tĩnh mạch giãn cấp tính từ hướng dẫn thực hành của Hiệp hội Nghiên cứu Bệnh gan Hoa Kỳ/Trường Cao đẳng Bác sĩ Tiêu hóa Hoa Kỳ (AASLD/ACG) về phòng ngừa và quản lý giãn tĩnh mạch dạ dày-thực quản và xuất huyết tĩnh mạch giãn ở xơ gan
- Hướng dẫn năm 2007 khuyến nghị hỗ trợ thể tích nội mạch kịp thời và truyền máu khi cần thiết, cẩn thận duy trì hemoglobin (Hb) khoảng 8 g/dL (80 g/L) (AASLD/ACG Class I, Level B), nhưng tránh truyền quá mức để ngăn ngừa quá tải và làm trầm trọng thêm chảy máu tĩnh mạch giãn
- Hướng dẫn năm 2017 đề xuất sửa đổi khuyến nghị truyền máu với hồng cầu khối được truyền thận trọng, bắt đầu khi Hb đạt khoảng 7 g/dL (70 g/L) với mục tiêu duy trì mức Hb ở 7-9 g/dL (70-90 g/L) (không cung cấp mức độ khuyến nghị)
- Khuyến nghị đồng thuận của hội thảo quốc tế Baveno VI về điều trị xuất huyết tĩnh mạch giãn cấp tính:
- Hồi phục thể tích máu nên thận trọng (Baveno Level 1b, Grade A)
- Mục tiêu hồi sức là duy trì tưới máu mô; bồi phụ thể tích nên được cho để duy trì ổn định huyết động
- Truyền hồng cầu khối nên được thực hiện để duy trì mức Hb 7-8 g/dL (70-80 g/L), nhưng xem xét các yếu tố khác, như:
- Bệnh đồng mắc
- Tuổi bệnh nhân
- Tình trạng huyết động
- Chảy máu đang tiếp diễn
- Khuyến nghị truyền máu trong xuất huyết tĩnh mạch giãn cấp tính từ hướng dẫn thực hành của Hiệp hội Nghiên cứu Bệnh gan Hoa Kỳ/Trường Cao đẳng Bác sĩ Tiêu hóa Hoa Kỳ (AASLD/ACG) về phòng ngừa và quản lý giãn tĩnh mạch dạ dày-thực quản và xuất huyết tĩnh mạch giãn ở xơ gan
- Truyền hồng cầu cũng có thể cần thiết ở bệnh nhân:
- Viêm gan C và thiếu máu liên quan đến điều trị
- Thiếu máu bất sản liên quan đến viêm gan trước khi bắt đầu điều trị; nên truyền các đơn vị hồng cầu được chiếu xạ và âm tính với cytomegalovirus (không từ các thành viên gia đình)
- Ngưỡng truyền hồng cầu hạn chế có thể làm giảm tử vong so với ngưỡng tự do ở bệnh nhân chảy máu đường tiêu hóa trên (bằng chứng cấp độ 2 [trung bình])
- Dựa trên đánh giá Cochrane bị hạn chế bởi tính không đồng nhất lâm sàng
- Đánh giá hệ thống của 31 thử nghiệm ngẫu nhiên so sánh ngưỡng truyền hạn chế so với tự do ở 12.587 bệnh nhân được truyền hồng cầu vì bất kỳ tình trạng nào
- 3 thử nghiệm đã tuyển bệnh nhân chảy máu đường tiêu hóa trên
- Các thử nghiệm khác nhau trong định nghĩa ngưỡng truyền hạn chế và tự do và sử dụng truyền hồng cầu ban đầu
- Ở bệnh nhân chảy máu đường tiêu hóa trên, ngưỡng truyền hạn chế liên quan đến:
- Giảm tử vong trong 30 ngày trong phân tích của 3 thử nghiệm với 1.455 bệnh nhân
- Tỷ số nguy cơ 0,65 (95% CI 0,44-0,97)
- NNT 33 với tỷ lệ tử vong 30 ngày 5,6% trong nhóm truyền tự do
- Giảm nhu cầu truyền hồng cầu trong 2 thử nghiệm với 1.073 bệnh nhân
- Giảm tử vong trong 30 ngày trong phân tích của 3 thử nghiệm với 1.455 bệnh nhân
- Sử dụng ngưỡng truyền hồng cầu hemoglobin < 7 g/dL làm giảm tử vong so với ngưỡng < 9 g/dL ở người lớn bị chảy máu đường tiêu hóa trên cấp tính nặng (bằng chứng cấp độ 1 [có khả năng đáng tin cậy])
- Dựa trên thử nghiệm ngẫu nhiên:
- 921 người lớn > 18 tuổi bị chảy máu đường tiêu hóa trên cấp tính nặng (51% do loét dạ dày tá tràng, 23% do giãn tĩnh mạch thực quản) được ngẫu nhiên hóa vào 1 trong 2 ngưỡng truyền hồng cầu và được theo dõi trong 45 ngày
- Truyền khi hemoglobin (Hb) < 7 g/dL với phạm vi mục tiêu 7-9 g/dL (chiến lược hạn chế)
- Truyền khi Hb < 9 g/dL với phạm vi mục tiêu 9-11 g/dL (chiến lược tự do)
- Tiêu chí loại trừ bao gồm chảy máu ồ ạt, nguy cơ chảy máu tái phát thấp, hội chứng mạch vành cấp, bệnh lý mạch máu ngoại vi có triệu chứng, đột quỵ và truyền máu trong 90 ngày qua
- Tất cả bệnh nhân được truyền 1 đơn vị hồng cầu sau đó là đơn vị bổ sung nếu Hb dưới phạm vi mục tiêu
- 889 bệnh nhân (96,5%) được đưa vào phân tích (32 bị loại do không đủ điều kiện, vi phạm nghiêm trọng quy trình hoặc rút lui)
- So sánh chiến lược truyền hạn chế với tự do:
- Tử vong do mọi nguyên nhân 5% so với 9% (p = 0,02, NNT 25)
- Tử vong do chảy máu không kiểm soát được ở 0,7% so với 3,1% (p = 0,01, NNT 42)
- Chảy máu thêm ở 10% so với 16% (p = 0,01, NNT 17)
- Biến cố bất lợi ở 40% so với 48% (p = 0,02, NNT 13)
- Biến cố bất lợi nghiêm trọng ở 20% so với 26% (p = 0,04, NNT 17)
- Không truyền hồng cầu ở 51% so với 14% (p < 0,001, NNT 3)
- 921 người lớn > 18 tuổi bị chảy máu đường tiêu hóa trên cấp tính nặng (51% do loét dạ dày tá tràng, 23% do giãn tĩnh mạch thực quản) được ngẫu nhiên hóa vào 1 trong 2 ngưỡng truyền hồng cầu và được theo dõi trong 45 ngày
5.4. Phẫu thuật và thủ thuật
Phẫu thuật và thủ thuật để điều trị cường lách:
- Cắt lách:
- Có thể mở hoặc nội soi
- Biến chứng bao gồm huyết khối tĩnh mạch lách và cửa
- Được báo cáo làm tăng số lượng tiểu cầu và bạch cầu sau cắt lách
- Có thể kết hợp với phẫu thuật shunt
- Thuyên tắc lách một phần:
- Đặt catheter vào động mạch lách, tiêm các hạt cho đến khi giảm dòng chảy lách khoảng một nửa
- Nhồi máu lách 30%-70% thể tích lách
- Biến chứng bao gồm:
- Sốt
- Đau bụng
- Huyết khối tĩnh mạch cửa và lách
- Áp xe lách
- Đốt sóng cao tần:
- Có thể mở, qua da hoặc nội soi
- Thể tích lách giảm khoảng 24% lâu dài
- Biến chứng bao gồm chảy máu trong ổ bụng cần cắt lách cấp cứu
Can thiệp nội soi và thủ thuật phẫu thuật cho chảy máu đường tiêu hóa:
- Đối với bệnh nhân bị chảy máu đường tiêu hóa, nguồn chảy máu cần được điều trị; các lựa chọn bao gồm:
- Can thiệp nội soi khi chẩn đoán chảy máu tĩnh mạch giãn
- Chèn bóng để kiểm soát chảy máu trong khi chuẩn bị điều trị triệt để hơn
- Shunt cửa chủ trong gan qua tĩnh mạch cổ được sử dụng làm liệu pháp cứu hộ
Ghép gan:
- Ghép gan chỉnh hình được báo cáo gây hồi phục thiếu máu tế bào hình gai; cơ chế chưa rõ ràng nhưng có thể do:
- Bình thường hóa chuyển hóa lipid
- Giảm tăng áp lực tĩnh mạch cửa và cường lách
- Ghép gan chỉnh hình được báo cáo gây hồi phục tế bào hình gai ở 4 trong số 5 bệnh nhân bị xơ gan tiến triển và có bằng chứng của tế bào hình gai (bằng chứng cấp độ 3 [thiếu trực tiếp])
- Dựa trên loạt ca:
- 116 bệnh nhân (tuổi trung bình 55,8 tuổi, 77% nam giới) bị xơ gan tiến triển (điểm Child–Pugh–Turcott > 7) nhập viện và được theo dõi trong thời gian trung bình 52 ngày
- 24 bệnh nhân (20,7%) có bằng chứng tế bào hình gai trên phết máu ngoại vi
- 7 bệnh nhân (6%) có bằng chứng thiếu máu tế bào hình gai (≥ 5% tế bào hình gai, thiếu máu cần truyền máu và bằng chứng tan máu)
- 5 bệnh nhân (4 bệnh nhân có tế bào hình gai và 1 bệnh nhân không có tế bào hình gai) được ghép gan chỉnh hình
- Hồi phục tế bào hình gai được báo cáo ở 4 bệnh nhân có bằng chứng tế bào hình gai trong vòng 3 tuần
- Dựa trên loạt ca:
- Ghép gan chỉnh hình được báo cáo gây hồi phục tự phát thiếu máu tế bào hình gai ở một người đàn ông 53 tuổi bị hemochromatosis, tiền sử rối loạn sử dụng rượu và xơ gan mất bù trong báo cáo ca
Ghép tế bào gốc tạo máu (HSCT):
- HSCT là 1 trong 2 lựa chọn chính để điều trị ở bệnh nhân thiếu máu bất sản nặng liên quan đến viêm gan
- Tỷ lệ sống sót trung bình sau 5 năm được báo cáo là 70% ở bệnh nhân được HSCT cho thiếu máu bất sản liên quan đến viêm gan
- Phác đồ điều hòa ức chế miễn dịch (ví dụ: globulin kháng tế bào lympho hoặc globulin kháng lympho với cyclosporine và steroid) được báo cáo làm tăng tỷ lệ thành công
- Có thể cần truyền tiểu cầu trước khi bắt đầu điều trị; nên sử dụng các đơn vị tiểu cầu được chiếu xạ và âm tính với cytomegalovirus (không từ các thành viên gia đình) cho những bệnh nhân này
5.5. Quản lý khác
Đối với bệnh nhân viêm gan C và thiếu máu liên quan đến điều trị:
- Mục tiêu quản lý thiếu máu:
- Bình luận DynaMed: Một số bác sĩ lâm sàng xem xét duy trì mức hemoglobin (Hb) trên 10 g/dL (100 g/L).
- Giảm nhẹ triệu chứng
- Tiếp tục liệu pháp ribavirin nếu cần thiết
- Các chiến lược quản lý thiếu máu bao gồm:
- Điều chỉnh liều ribavirin nếu ribavirin cần thiết như một phần của liệu pháp; các lựa chọn giảm liều ribavirin được đề xuất:
- Ở người lớn không có yếu tố nguy cơ tim mạch:
- Hb 8,5-10 g/dL (85-100 g/L): giảm 200 mg/ngày (trừ ở bệnh nhân đang dùng 1.400 mg, giảm liều nên là 400 mg/ngày); nếu cần, liều ribavirin có thể được giảm lần thứ hai thêm 200 mg/ngày
- Hb < 8,5 g/dL (85 g/L): ngừng ribavirin
- Ở người lớn có tiền sử bệnh tim ổn định:
- Hb giảm ≥ 2 g/dL (20 g/L) trong bất kỳ khoảng thời gian 4 tuần nào trong quá trình điều trị: giảm 200 mg/ngày
- Hb < 12 g/dL (120 g/L): ngừng điều trị
- Hb < 10 g/dL (100 g/L) 4 tuần sau khi giảm liều: ngừng điều trị
- Ở người lớn không có yếu tố nguy cơ tim mạch:
- Các chất kích thích tạo hồng cầu
- Truyền máu
- Điều chỉnh liều ribavirin nếu ribavirin cần thiết như một phần của liệu pháp; các lựa chọn giảm liều ribavirin được đề xuất:
Để biết thêm thông tin về quản lý bệnh nhân có rối loạn đông máu, xem:
- Phần Quản lý rối loạn đông máu của Xơ gan gan
- Truyền tiểu cầu
- Rối loạn tiểu cầu trong bệnh gan
- Rối loạn đông máu trong bệnh gan
VI. Biến chứng và tiên lượng
Tiên lượng
Tử vong:
- Tử vong trong 6 tuần được báo cáo là 15%-20% ở bệnh nhân xuất huyết tĩnh mạch giãn cấp tính
Bệnh nhân xơ gan và thiếu máu tế bào hình gai:
- Tỷ lệ sống sót 6 tháng sau khi nhập viện được báo cáo là 28% ở bệnh nhân xơ gan và thiếu máu tế bào hình gai
- Dựa trên nghiên cứu đoàn hệ:
- 186 bệnh nhân (67% nam giới, tuổi trung vị 60 tuổi) bị xơ gan nhập viện được theo dõi trong thời gian trung bình 1,1 tháng
- 18 bệnh nhân (10%) có tỷ lệ tế bào hình gai ≥ 10% (thiếu máu tế bào hình gai); 49 bệnh nhân (26%) có tỷ lệ tế bào hình gai 5%-9%
- Tỷ lệ sống sót 28% ở bệnh nhân có tỷ lệ tế bào hình gai ≥ 10% sau 6 tháng
- Thời gian sống sót trung bình 3,5 tháng cho bệnh nhân có tỷ lệ tế bào hình gai ≥ 10% so với 12 tháng cho bệnh nhân có tỷ lệ tế bào hình gai 5%-9% (p < 0,05)
- Dựa trên nghiên cứu đoàn hệ:
- Tỷ lệ tế bào hình gai ≥ 5% liên quan đến giảm sống sót trong 6 tháng so với tỷ lệ tế bào hình gai 0%-4% ở bệnh nhân xơ gan tiến triển
- Dựa trên nghiên cứu đoàn hệ:
- 116 bệnh nhân (tuổi trung bình 55,8 tuổi, 77% nam giới) bị xơ gan tiến triển (điểm Child–Pugh–Turcott > 7) nhập viện và được theo dõi trong thời gian trung bình 52 ngày
- 24 bệnh nhân (20,7%) có bằng chứng tế bào hình gai trên phết máu ngoại vi
- 7 bệnh nhân (6%) có bằng chứng thiếu máu tế bào hình gai (≥ 5% tế bào hình gai, thiếu máu cần truyền máu và bằng chứng tan máu)
- Tử vong khi theo dõi (81,9% tổng thể)
- 100% ở bệnh nhân có tỷ lệ tế bào hình gai ≥ 5%
- 85,7% ở bệnh nhân có tỷ lệ tế bào hình gai 0%-4%
- 71,4% ở bệnh nhân không có tế bào hình gai
- Sống sót trong 6 tháng:
- 0% ở bệnh nhân có tỷ lệ tế bào hình gai ≥ 5% (p = 0,004 so với không có tế bào hình gai) – 0% ở bệnh nhân có tỷ lệ tế bào hình gai ≥ 5% (p = 0,007 so với tỷ lệ tế bào hình gai 0%-4%) – 20% ở bệnh nhân có tỷ lệ tế bào hình gai 0%-4% – 40% ở bệnh nhân không có tế bào hình gai – Không có sự khác biệt đáng kể giữa các nhóm về tỷ lệ sống sót 1 năm
- Dựa trên nghiên cứu đoàn hệ:
Thiếu máu ban đầu có thể không liên quan đến tăng tử vong hoặc nguy cơ ghép gan ở bệnh nhân xơ gan còn bù:
- Dựa trên nghiên cứu đoàn hệ:
- 1.016 bệnh nhân người lớn (< 65 tuổi) bị xơ gan còn bù được đánh giá
- Tại thời điểm ban đầu:
- 254 bệnh nhân (25%) có thiếu máu
- 139 bệnh nhân (13,7%) có giảm bạch cầu
- 599 bệnh nhân (59%) có giảm tiểu cầu
- Không có mối liên quan đáng kể giữa thiếu máu ban đầu và tử vong hoặc ghép gan
- Các yếu tố liên quan đến tăng nguy cơ tử vong hoặc ghép gan trong phân tích đa biến:
- Giảm tiểu cầu tại thời điểm ban đầu (tỷ số nguy cơ [HR] 1,6, 95% CI 1,3-2,0)
- Giảm bạch cầu tại thời điểm ban đầu (HR 1,4, 95% CI 1-1,9)
Hội chứng Zieve thường cải thiện 2-3 tuần sau khi ngừng uống rượu.
VII. Phòng ngừa và sàng lọc
Không áp dụng
VIII. Hướng dẫn và tài nguyên
Hướng dẫn (Guidelines)
Hướng dẫn quốc tế:
- Hướng dẫn của Tổ chức Y tế Thế giới (WHO) về ngưỡng hemoglobin để xác định thiếu máu ở cá nhân và quần thể có thể được tìm thấy tại WHO 2022 Mar 7 PDF
Hướng dẫn Hoa Kỳ:
- Hiệp hội Nghiên cứu Bệnh gan Hoa Kỳ (AASLD):
- Hướng dẫn của AASLD về phân tầng nguy cơ, chẩn đoán và quản lý chảy máu do tăng áp lực tĩnh mạch cửa trong xơ gan có thể được tìm thấy trong Hepatology 2022 Jan;75(1):219-236
- Hướng dẫn thực hành của AASLD về chẩn đoán và quản lý bệnh hemochromatosis có thể được tìm thấy trong Hepatology 2011 Jul;54(1):328-43
- Hiệp hội Nghiên cứu Bệnh gan Hoa Kỳ/Trường Cao đẳng Bác sĩ Tiêu hóa Hoa Kỳ (AASLD/ACG) – hướng dẫn thực hành về phòng ngừa và quản lý giãn tĩnh mạch dạ dày-thực quản và xuất huyết tĩnh mạch giãn trong xơ gan có thể được tìm thấy trong Hepatology 2007 Sep;46(3):922-38
Hướng dẫn Vương quốc Anh:
- Hướng dẫn của Hiệp hội Bác sĩ Tiêu hóa Anh (BSG) về quản lý xuất huyết tĩnh mạch giãn ở bệnh nhân xơ gan có thể được tìm thấy tại BSG 2015 hoặc trong Gut 2015 Nov;64(11):1680-704
Hướng dẫn châu Âu:
- Hướng dẫn của Hiệp hội Nghiên cứu Gan Thụy Sĩ (SASL) về sử dụng erythropoietin trong điều trị thiếu máu trong liệu pháp viêm gan C mạn tính có thể được tìm thấy trong J Viral Hepat 2012 Feb;19(2):91-5
Bài tổng quan (Systematic Reviews)
- Tổng quan về các nguyên nhân hiếm gặp của thiếu máu trong bệnh gan có thể được tìm thấy trong Adv Clin Exp Med 2022 May;31(5):547-559 PDF
- Tổng quan về thiếu máu thiếu sắt trong bệnh gan mạn tính: bệnh sinh, chẩn đoán và điều trị có thể được tìm thấy trong Ann Gastroenterol 2020 Sep-Oct;33(5):465-475
- Tổng quan về thiếu máu tan máu trong hội chứng Zieve liên quan đến viêm gan do rượu có thể được tìm thấy trong Am J Gastroenterol 1994 Apr;89(4):605-7
- Tổng quan về tăng bilirubin máu và thiếu máu tan máu trong viêm gan do rượu cấp tính có thể được tìm thấy trong BMJ Case Rep 2015 Apr 1;2015
- Tổng quan về quản lý thiếu máu ở bệnh nhân viêm gan C mạn tính có thể được tìm thấy trong Ann Pharmacother 2011 Feb;45(2):1-13
- Tổng quan về quản lý thiếu máu do liệu pháp ba thuốc ở bệnh nhân viêm gan C mạn tính có thể được tìm thấy trong J Hepatol 2013 Dec;59(6):1323-30
- Tổng quan về sử dụng erythropoietin trong điều trị thiếu máu trong liệu pháp viêm gan C mạn tính có thể được tìm thấy trong J Viral Hepat 2012 Feb;19(2):91-5
- Tổng quan về định nghĩa và quản lý thiếu máu ở bệnh nhân nhiễm virus viêm gan C có thể được tìm thấy trong Liver Int 2013 May;33 Suppl 1:107-12
- Tổng quan về thiếu máu bất sản liên quan đến viêm gan có thể được tìm thấy trong Virol J 2014 Feb 18;11:31
- Tổng quan về các biến chứng huyết học của rối loạn sử dụng rượu có thể được tìm thấy trong Alcohol Health Res World 1997;21(1):42-52
- Thiếu máu tế bào hình gai ở một phụ nữ 68 tuổi bị bệnh gan do rượu trong báo cáo ca bệnh (Intern Med 2011;50(20):2413-6)
- Thiếu máu tế bào hình gai ở một phụ nữ 53 tuổi bị bệnh gan giai đoạn cuối do rượu và lách to trong báo cáo ca bệnh (Transfusion 2014 Apr;54(4):1166-70)
IX. Bảng chú giải các thuật ngữ Y học liên quan:
- Anemia (uh-nee-mee-uh): Thiếu máu
- Cirrhosis (suh-roh-sis): Xơ gan
- Portal hypertension (por-tuhl hahy-per-ten-shuhn): Tăng áp lực tĩnh mạch cửa
- Hemoglobin (hee-muh-gloh-bin): Hemoglobin
- Thrombocytopenia (throm-boh-sahy-tuh-pee-nee-uh): Giảm tiểu cầu
- Leukopenia (loo-koh-pee-nee-uh): Giảm bạch cầu
- Spur cell anemia (spur sel uh-nee-mee-uh): Thiếu máu tế bào hình gai
- Zieve syndrome (zeev sin-drohm): Hội chứng Zieve
- Wilson disease (wil-suhn dih-zeez): Bệnh Wilson
- Hepatitis (hep-uh-tahy-tis): Viêm gan
- Ribavirin (rahy-buh-vahy-rin): Ribavirin
- Erythropoietin (ih-rith-roh-poy-i-tn): Erythropoietin
- Hypersplenism (hahy-per-splee-niz-uhm): Cường lách
- Splenomegaly (splee-noh-meg-uh-lee): Lách to
- Hemolysis (hi-mol-uh-sis): Tan máu
- Ferritin (fer-i-tn): Ferritin
- Transferrin (trans-fer-in): Transferrin
- Haptoglobin (hap-tuh-gloh-bin): Haptoglobin
- Bilirubin (bil-uh-roo-bin): Bilirubin
- Coagulopathy (koh-ag-yuh-lop-uh-thee): Rối loạn đông máu
TÀI LIỆU THAM KHẢO
- Marks PW. Hematologic manifestations of liver disease. Semin Hematol. 2013 Jul;50(3):216-21.
- Gonzalez-Casas R, Jones EA, Moreno-Otero R. Spectrum of anemia associated with chronic liver disease. World J Gastroenterol. 2009 Oct 7;15(37):4653-8full-text.
- Stein J, Connor S, Virgin G, Ong DE, Pereyra L. Anemia and iron deficiency in gastrointestinal and liver conditions. World J Gastroenterol. 2016 Sep 21;22(35):7908-25full-text.