Trạng thái giảm protein máu đại diện cho một thách thức khi đánh giá chức năng trục dưới đồi-tuyến yên-thượng thận (HPA) [1]. Kịch bản này thường gặp ở xơ gan và phức tạp hơn do sự chồng chéo đáng kể giữa các biểu hiện lâm sàng của suy thượng thận (STT) và bệnh gan mất bù. Ngoài ra, STT tồn tại dọc theo một phổ ở bệnh nhân xơ gan và do đó, bác sĩ đánh giá có nhiệm vụ xác định xem chức năng tuyến thượng thận là đầy đủ, suy giảm tương đối (RAI) hay suy hoàn toàn (Suy thượng thận tuyệt đối).
Suy thượng thận tương đối ban đầu được mô tả ở nhóm dân số bị bệnh nguy kịch và hiện được gọi là suy corticosteroid liên quan đến bệnh nguy kịch (CIRCI). Marik và cộng sự lần đầu tiên báo cáo tình trạng này ở bệnh nhân xơ gan vào năm 2005, đặt tên cho nó là “hội chứng gan-thượng thận” [2]. Ban đầu, bệnh nhân có đủ dự trữ tuyến thượng thận để đáp ứng nhu cầu cân bằng nội môi nhưng không thể sản xuất cortisol dư thừa hoặc đáp ứng ở cấp độ thụ thể mô để tăng sản xuất cortisol. Tuy nhiên, có sự không đồng nhất đáng kể trong các tài liệu hiện có liên quan đến chẩn đoán và mô tả đặc tính của STT (tức là, nó tương đối hay tuyệt đối?). Nhiều tác giả thừa nhận thách thức đặt ra bằng cách đo cortisol toàn phần (TC) trong huyết thanh trong xơ gan nhưng không có đủ bằng chứng cho các hướng dẫn hiện tại để đưa ra các khuyến nghị liên quan đến các chiến lược chẩn đoán tối ưu và ngưỡng lâm sàng [3].
Tỷ lệ hiện mắc STT trong xơ gan rất khác nhau (15% -72%) và phụ thuộc vào yếu tố bệnh nhân và phương pháp nghiên cứu [2, 4-12]. Ý nghĩa tiên lượng âm tính có liên quan đến suy thượng thận tương đối theo tiêu chí Cortisol toàn phần trong cả bệnh nguy kịch và không nguy kịch [2, 6-9, 11, 13-15]; tuy nhiên, liệu nồng độ cortisol tự do trong huyết tương hoặc nước bọt có báo trước kết quả tương tự hay không vẫn chưa được biết. Một cách tiếp cận phân mảnh để chẩn đoán và mô tả đặc điểm của STT trong xơ gan đã làm chậm sự công nhận rộng rãi của nó và góp phần vào sự nhầm lẫn lâm sàng hiện tại.
Một thách thức khác chỉ có ở xơ gan là sự phát triển của STT có thể là cả đa yếu tố và đa cấp trong tự nhiên [6, 16-19]. Cố gắng tách một trường hợp cụ thể thành một quy trình hoàn toàn chính hoặc phụ (hoặc đại học) có thể không thực hiện được do không đồng nhất lâm sàng. Cuối cùng, bệnh nhân xơ gan có nguy cơ cao phát triển bệnh nguy kịch, đây là một yếu tố nguy cơ STT đã được thiết lập trong dân số nói chung [20]. Việc phân biệt xem STT trong kịch bản này có liên quan đến bệnh gan tiềm ẩn hay tình trạng bệnh hiện tại hay không có thể thực hiện được. Tuy nhiên, do STT phát triển ở bệnh nhân ngoại trú ổn định [4, 5, 21-24], nghiên cứu theo chiều dọc là cần thiết để hiểu liệu STT là rối loạn chức năng cơ quan động hay tĩnh trong xơ gan.
Chức năng trục HPA (Dưới đồi – Tuyến yên – Thượng thận) bất thường và chuyển hóa cortisol trong bệnh gan
Suy thượng thận là một rối loạn chức năng nội tiết không được công nhận bao gồm phổ của bệnh gan. Mặc dù sinh lý bệnh của nó rất phức tạp và sẽ được thảo luận chi tiết hơn trong phần sau, bài tiết ACTH bất thường ở tuyến yên (và/hoặc vùng dưới đồi) có thể đóng vai trò nhất định. Montagense et al. báo cáo sự khác biệt về nhịp tiết cortisol tự do, do đó đỉnh tiết cortisol buổi sáng bị trì hoãn ở bệnh nhân xơ gan, đặc biệt là những người mắc bệnh gan mất bù [25]. Mặc dù bị giới hạn bởi kích thước mẫu và không đo ACTH đồng thời, những phát hiện này cung cấp bằng chứng cho thấy rối loạn chức năng tuyến yên là di chứng của xơ gan. Bằng chứng mới nổi cho thấy ghép gan loại bỏ những bất thường này, hỗ trợ khẳng định vai trò quan trọng của gan trong việc duy trì chức năng nội tiết bình thường [26].
Sự tiết cortisol là phi tuyến tính ở những người khỏe mạnh, dao động theo kiểu sinh học và theo chu kỳ trong ngày (chu kỳ 60 đến 90 phút) với đỉnh điểm vào sáng sớm và hạ thấp về đêm [27]. Sự gián đoạn nhịp sinh học bình thường là phổ biến trong xơ gan mất bù, nhưng liệu nó có ảnh hưởng đáng kể đến bài tiết cortisol hay không vẫn chưa được giải quyết [25]. Một nghiên cứu nhỏ cho thấy không có thay đổi ở bệnh nhân xơ gan so với nhóm chứng, mặc dù hầu hết bệnh nhân có bệnh bù [28]. Ngược lại, một nghiên cứu nhỏ khác lưu ý rằng bệnh nhân xơ gan có cortisol huyết tương tự do đỉnh (cortisol tự do trong huyết tương) bị trì hoãn; Hiệu ứng này rõ rệt hơn ở những người mắc bệnh gan mất bù [29].
Chuyển hóa cortisol cũng bất thường trong xơ gan. 11 enzyme beta-hydroxysteroid dehydrogenase (11β-HSD) (loại 1 và 2, cả hai đều chứa trong tế bào gan và thận) chuyển đổi qua lại cortisol giữa dạng hoạt tính sinh học và dạng trơ (cortisone). Các nghiên cứu trên động vật và con người chứng minh rằng bệnh gan có liên quan đến việc giảm nồng độ enzyme 11β-HSD và do đó làm tăng glucocorticoids lưu hành [30, 31]. Ngoài ra, việc loại bỏ cortisol bị suy yếu trong xơ gan và song song với mức độ nghiêm trọng của bệnh gan [32].
Thay đổi liên kết sản xuất globulin trong xơ gan
Rối loạn chức năng nội tiết trong xơ gan cũng là sản phẩm phụ của chức năng tổng hợp gan bị suy giảm. Gan sản xuất tất cả các globulin liên kết hormone, do đó có sự giảm toàn thể (ngoại trừ SHBG) trong xơ gan. Điều này đặc biệt phù hợp khi đánh giá trục thượng thận vì 90% cortisol liên kết với globulin liên kết corticosteroid (CBG; 70%) hoặc albumin (20%). Mức độ giảm của cả hai đều được ghi nhận rõ ràng trong xơ gan [33, 34], nhưng liệu mất phân biệt có tồn tại hay không vẫn chưa được biết. Điều thú vị là, nồng độ CBG và albumin chỉ tương quan yếu [1].
Các đặc tính phân tử và do đó chức năng của albumin bị thay đổi trong xơ gan. Nồng độ albumin hiệu quả mô tả quan sát thấy rằng tỷ lệ albumin cao hơn ở bệnh nhân xơ gan có thể bị rối loạn chức năng và có liên quan đến mức độ nghiêm trọng của bệnh gan cũng như kết quả lâm sàng, bao gồm tử vong [35]. Tuy nhiên, liệu hạ albumin máu và rối loạn chức năng phân tử nội tại liên quan duy nhất đối với xơ gan có làm giảm liên kết cortisol hay không vẫn là một con đường cho nghiên cứu trong tương lai.
Sinh lý bệnh của suy thượng thận trong xơ gan
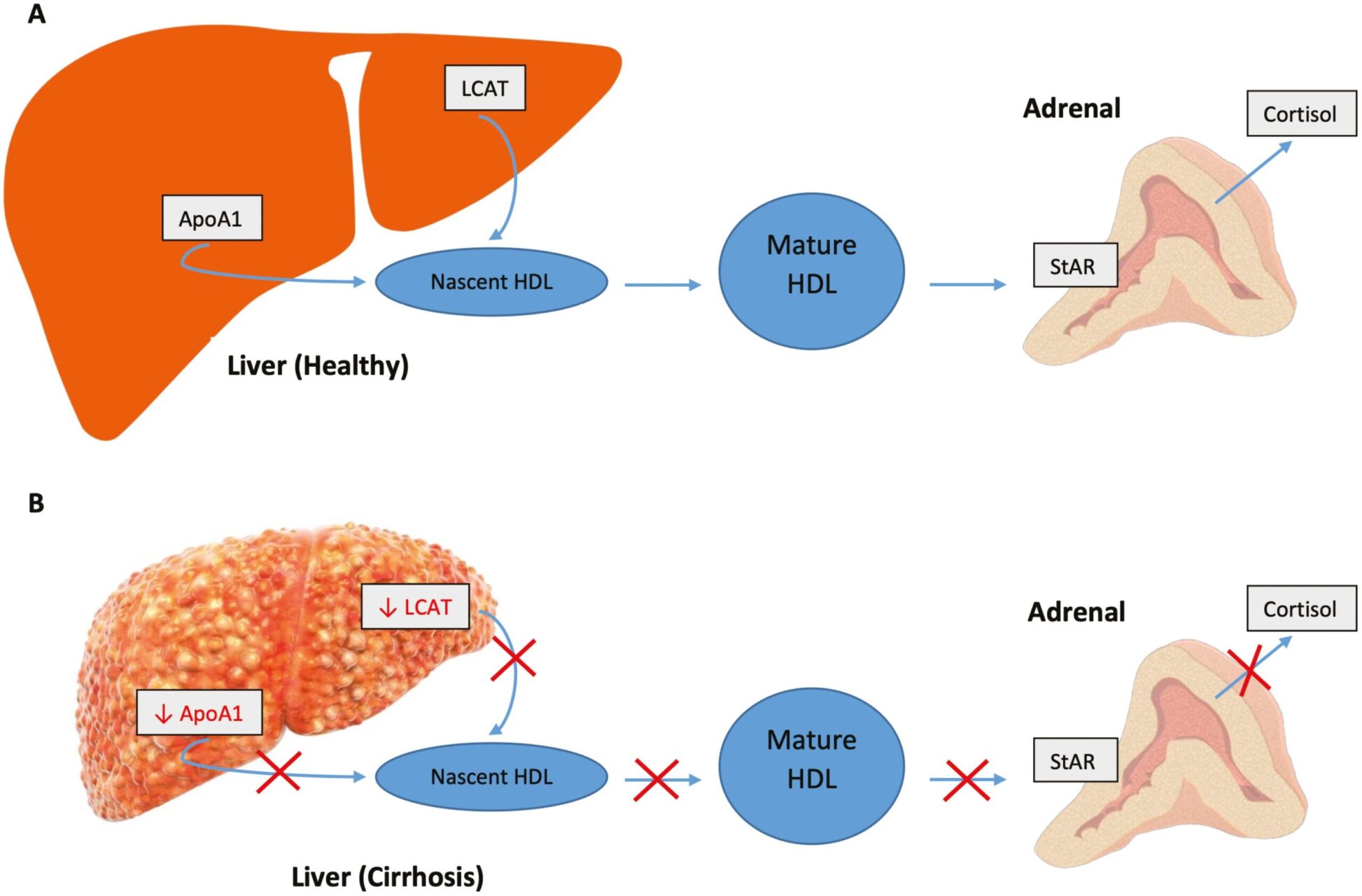
Con đường nhân quả của STT trong xơ gan không được hiểu đầy đủ nhưng có sự hiện diện của nhiều yếu tố [6, 36]. Nguyên nhân truyền thống của STT tuyệt đối có thể xảy ra, nhưng điều này chỉ đại diện cho một số ít trường hợp vì di chứng của bệnh gan làm gián đoạn chức năng tuyến thượng thận bình thường. Sự hình thành steroid tuyến thượng thận phụ thuộc vào việc di chuyển con thoi cholesterol trong gan thông qua lipoprotein mật độ cao (HDL). Loại thứ hai chủ yếu bao gồm apolipoprotein, bao gồm apo-A1. Nó được thiết lập tốt rằng mức apo-A1 và HDL tương quan với chức năng tổng hợp gan [37-39]. Tương tự, suy giảm hoạt động enzyme lecithin-cholesterol acyltransferase (LCAT) dường như song song với mức độ nghiêm trọng của bệnh gan [40, 41]. Cho rằng LCAT liên kết với apo-A1 để tạo điều kiện thuận lợi cho quá trình este hóa cholesterol tự do và tạo thành hạt HDL trưởng thành, có sự phụ thuộc lẫn nhau đáng kể giữa cả ba yếu tố (Hình 1). Rối loạn lipid máu trong bệnh gan, biểu hiện bằng sự giảm nồng độ HDL, có liên quan đến STT [6-8]. Mặc dù được công nhận là một cơ chế đóng góp tiềm năng, bằng chứng cho quan hệ nhân quả trực tiếp vẫn còn thiếu. Ở trạng thái không xơ gan, HDL thấp không làm thay đổi đáp ứng HPA đối với xét nghiệm kích thích ACTH [42]. Tuy nhiên, liệu có tác dụng khác biệt của sự thiếu hụt chất nền này ở bệnh nhân xơ gan, đặc biệt là để đáp ứng với stress, hay không, vẫn chưa được biết. Hơn nữa, nồng độ CBG thấp trong xơ gan có thể làm xáo trộn mối quan hệ giữa HDL và suy tuyến thượng thận, nhưng các tài liệu không nhất quán về tính hợp lý của nó [5, 6, 9, 43].
Hình 1. Chuyển hóa lipid và tuyến thượng thận
Gan là nơi chính của quá trình tổng hợp apolipoprotein. Một trong những apolipoprotein quan trọng, ApoA1, bao gồm một phần lớn các hạt lipoprotein mật độ cao (HDL). Enzym acyltransferase lecithin-cholesterol có nguồn gốc từ gan (LCAT) liên kết với ApoA1 trên HDL và este hóa cholesterol tự do. Một khi quá trình này hoàn tất, hạt HDL trưởng thành và có thể được chuyển đến các mô ngoại vi. Trong tuyến thượng thận, cholesterol được tháo dỡ và sự hấp thu xảy ra thông qua protein điều hòa cấp tốc steroid ty thể (StAR), đây là bước giới hạn tốc độ trong việc sản xuất hormone steroid (A). Trong xơ gan, quá trình này bị gián đoạn do giảm tổng hợp gan của cả ApoA1 và LCAT, dẫn đến suy giảm sự hình thành các phân tử HDL trưởng thành đầy đủ để cung cấp chất nền đầy đủ cho quá trình tạo steroid tuyến thượng thận bình thường. Tuy nhiên, liệu điều này có dẫn đến giảm đáng kể về mặt lâm sàng trong sản xuất cortisol hay không vẫn chưa được biết (B).

Hình 2. Sinh bệnh học của suy thượng thận trong xơ gan. Sự phát triển của suy thượng thận trong xơ gan có thể là đa yếu tố. Đóng góp từ rối loạn lipid máu được mô tả chi tiết trong Hình 1.
-
1) Thiếu hoạt động enzyme tuyến thượng thận nội tại dẫn đến steroid tiền chất dư thừa (liên quan đến cortisol) hoặc các con đường chuyển hướng.
-
2) Thay đổi trương lực mạch máu trong trường hợp giãn mạch lách và thể tích tuần hoàn hiệu dụng thấp dẫn đến giảm tưới máu tuyến thượng thận mạn tính, và
-
3) Tác dụng ức chế của các cytokine gây viêm đối với bài tiết nội tiết tố của trục HPA [11, 36].
Xơ gan là một trạng thái tiền viêm và các cấu hình khác biệt của biểu hiện cytokine tương quan với mức độ nghiêm trọng của bệnh [17]. Mức nồng độ TNF-alpha và IL-6 được so sánh trong một nghiên cứu về bệnh nhân xơ gan không nguy kịch cả có và không có suy thượng thận tương đối (RAI). Bệnh nhân bị suy thượng thận tương đối có nồng độ cytokine tiền viêm cao hơn về số lượng nhưng không cao hơn đáng kể trong phân tích thăm dò này [9]. Phát hiện này đòi hỏi phải điều tra thêm, bao gồm mở rộng sang đo lường các cytokine khác. Tuy nhiên, vẫn tồn tại khả năng gây nhiễu đáng kể, vì bệnh cấp tính (đặc biệt là bệnh nguy kịch) làm tăng mức độ cytokine gây viêm.
Ngoài tác dụng ức chế trực tiếp của chúng trên cả 3 mức độ của trục HPA, các cytokine gây viêm làm giảm độ nhạy glucocorticoid mô ngoại vi [44]. Khái niệm suy giảm đa cấp được hỗ trợ thêm bởi Fede et al. Các tác giả đã đề cập trước đây cho thấy suy thượng thận trong xơ gan có thể được đảo ngược với kích thích ACTH siêu sinh lý kéo dài, cho thấy sự pha trộn của cả suy một phần nguyên phát và thứ phát [45].
Xét nghiệm Cortisol toàn phần và nghiệm pháp kích thích ACTH trong bệnh gan
Đo nồng độ Cortisol toàn phần (TC) trong xơ gan đang gây tranh cãi. Do tổng hợp globulin liên kết bị suy yếu, các phương thức xét nghiệm chẩn đoán tiêu chuẩn có thể không chính xác. Các hướng dẫn hiện tại của Hiệp hội Nội tiết chỉ hỗ trợ sử dụng Cortisol toàn phần khi đánh giá bệnh nhân cho suy thượng thận tiên phát [3]. Tuy nhiên, trong trường hợp xơ gan, khả năng khái quát hóa của các khuyến nghị này chùn bước. Đầu tiên, mức Cortisol toàn phần thấp hơn và được kích thích có thể đánh giá quá cao sự hiện diện của suy thượng thận [36]. Thứ hai, sinh lý bệnh của suy thượng thận trong xơ gan có thể là đa cấp và/hoặc tuỳ trường hợp.
Đo nồng độ cortisol phụ thuộc vào xét nghiệm. Tiêu chuẩn vàng, sắc ký lỏng-khối phổ song song (LC-MS), là đặc hiệu nhất và mang lại mức Cortisol toàn phần thấp hơn so với xét nghiệm miễn dịch [46]. Mặc dù sử dụng LC-MS là lý tưởng, nhưng nó đắt hơn và ít có sẵn rộng rãi hơn trong thực hành lâm sàng thông thường (so với môi trường nghiên cứu). Do đó, các bác sĩ lâm sàng cần chú ý đến những hạn chế này và giải thích nồng độ cortisol một cách thận trọng để tránh chẩn đoán sai. Do đó, việc hiệu chuẩn lại ngưỡng Cortisol toàn phần để xác định đáp ứng tuyến thượng thận đầy đủ là cần thiết.
Hiện tại, mức Cortisol toàn phần vào sáng sớm là <138 nmol/L gợi ý về suy thượng thận và được xác nhận với mức Cortisol toàn phần cao nhất < 500 nmol/L sau kích thích ACTH [3]. Tuy nhiên, các giá trị này dựa trên các xét nghiệm miễn dịch lịch sử sử dụng kháng thể đa dòng với cortisol, ít đặc hiệu hơn do phản ứng chéo với các steroid huyết thanh khác. Các phương pháp mới hơn để đo nồng độ Cortisol toàn phần, bao gồm các kháng thể đơn dòng đặc hiệu hơn hoặc LC-MS tiêu chuẩn vàng, mức Cortisol toàn phần ròng thấp hơn khoảng 22% đến 39% so với mức lịch sử [47]. Với sự thay đổi đáng kể này, ngưỡng Cortisol toàn phần cơ sở mới là <55 nmol/L hoặc Cortisol toàn phần đỉnh từ 386 đến 414 nmol/L để xác định suy thượng thận đã được đề xuất trong dân số nói chung khi sử dụng các xét nghiệm miễn dịch thế hệ mới hơn hoặc LC-MS [47]; Việc áp dụng chính thức vẫn đang chờ xử lý.
Các vấn đề phức tạp hơn nữa là thiếu phạm vi tham chiếu Cortisol toàn phần đặc hiệu trong xơ gan và/hoặc giảm protein máu đã được xác nhận. Ngoài ra, các giá trị này sẽ yêu cầu điều chỉnh mức độ nghiêm trọng của bệnh. Một nghiên cứu gần đây của Lovato et al. đã chứng minh rằng albumin, CBG, Cortisol toàn phần và tốc độ tiết cortisol tối đa (CSRmax; CSR thu được dưới kích thích ACTH tối đa) đều có liên quan nghịch với phân loại Child-Pugh. Điều quan trọng, cả mức albumin và CBG đều tương quan với mức Cortisol toàn phần được kích thích, trong khi CSRmax thì không [32]. Những phát hiện này nhấn mạnh rằng, mặc dù rối loạn chức năng tuyến thượng thận là phổ biến trong xơ gan, xét nghiệm bằng xét nghiệm phụ thuộc protein như Cortisol toàn phần là không chính xác.
Mặc dù có sai sót, Cortisol toàn phần vẫn là phương thức ưa thích để đánh giá chức năng tuyến thượng thận trong thực hành lâm sàng. Những điểm mạnh đáng chú ý bao gồm tính sẵn có rộng rãi, kết quả nhanh chóng để thông báo cho việc ra quyết định tại giường bệnh và sự quen thuộc của bác sĩ. Ngoài ra, nồng độ Cortisol toàn phần có ý nghĩa tiên lượng ở bệnh nhân xơ gan mất bù. Suy thượng thận tương đối, như được định nghĩa bởi cortisol delta (Cortisol đỉnh trừ cho cortisol nền) là <250 nmol/L, dự đoán độc lập tỷ lệ tử vong, nhấn mạnh tầm quan trọng của cả chẩn đoán và quản lý thích hợp [6-9].
Hai liều Cosyntropin đã được sử dụng để đánh giá suy thượng thận ở cả dân số nói chung và trạng thái giảm protein máu. Các hướng dẫn hiện tại khuyến nghị sử dụng Cosyntropin liều tiêu chuẩn (SD-SST; 250 μg) trong cả hai trường hợp thay vì thay thế liều thấp (1 μg) [3]. Những người ủng hộ sau này ở bệnh nhân xơ gan cho rằng liều Cosyntropin thấp hơn cải thiện độ nhạy chẩn đoán, đặc biệt là ở các trạng thái không bị bệnh nguy kịch, nơi liều tiêu chuẩn có thể là siêu sinh lý quá mức [22, 48]. Xét nghiệm kích thích Cosyntropin liều thấp (LD-SST) đã so sánh thuận lợi với SD-SST trong phân tích tổng hợp, nhưng những hạn chế đáng kể bao gồm thiếu xác nhận LD-SST ở bệnh nhân bị bệnh cấp tính hoặc chu kỳ ngủ-thức bất thường, như có thể xảy ra ở bệnh nhân xơ gan và bệnh não gan [49]. Ngoài ra, việc chuẩn bị 1 μg Cosyntropin đòi hỏi kỹ năng kỹ thuật cẩn thận để đảm bảo pha loãng và tiêm đúng cách, gây ra lỗi tiềm ẩn trong cả quản lý và giải thích kết quả [50]. Với những hạn chế đáng kể này, SD-SST vẫn là tiêu chuẩn chăm sóc.
Chức năng tuyến thượng thận trong bệnh nguy kịch và bệnh gan
Bệnh nguy kịch đại diện cho một kịch bản khác đầy tranh cãi khi đánh giá chức năng tuyến thượng thận. Trong dân số nói chung, thiếu sự đồng thuận về đánh giá tối ưu. Một số tác giả tranh luận về việc sử dụng mức cortisol toàn phần ngẫu nhiên < 276 nmol/L hoặc cortisol toàn phần delta < 250 nmol/L để chẩn đoán [51, 52]. Mặc dù bệnh nhân giảm protein máu bị bệnh nặng dự kiến sẽ có nồng độ cortisol toàn phần ngẫu nhiên > 262 nmol/L, tính hợp lệ của việc sử dụng nồng độ cortisol toàn phần ban đầu và kích thích Cosyntropin trong dân số này được đặt câu hỏi [53]. Hamrahian et al. phát hiện ra rằng gần 40% bệnh nhân bị bệnh nặng với albumin ≤ 2,5 g/dL có mức cortisol toàn phần đỉnh < 510 nmol/L mặc dù mức cortisol tự do trong huyết tương bình thường và kích thích [54]. Nghiên cứu tương tự cũng lưu ý rằng trong quần thể giảm protein máu, cortisol tự do trong huyết tương nền chiếm 19% đến 62% cortisol toàn phần đo được [54]. Do đó, mức cortisol tự do trong huyết tương ngẫu nhiên ngưỡng ≥ 50 nmol/L đã được đề xuất như một dấu hiệu độc lập với protein liên kết của chức năng thượng thận đầy đủ [53].
Mặc dù nồng độ cortisol tự do trong huyết tương mang lại lợi thế chẩn đoán hấp dẫn ở bệnh nhân xơ gan và giảm protein máu, việc áp dụng rộng rãi của nó bị hạn chế do hiện tại thiếu xác nhận ngưỡng 50 nmol/L và thời gian quay vòng chậm. Hiện tại, chúng tôi thích sử dụng delta cortisol toàn phần hơn. Tốc độ thay đổi, thay vì đạt được mức cortisol toàn phần đỉnh cụ thể, ít nhất độc lập một phần với chức năng tổng hợp gan tiềm ẩn và có thể dễ dàng xác định bệnh nhân bị suy thượng thận tương đối [6]. Tuy nhiên, liệu nồng độ cortisol toàn phần nền và/hoặc mức độ hạ albumin máu có ảnh hưởng đến độ chính xác chẩn đoán của nó hay không vẫn chưa rõ ràng ở cả dân số bị bệnh nặng và không nguy kịch.
Nồng độ CBG thấp cũng có thể đóng một vai trò quan trọng ở bệnh nhân xơ gan và bệnh nguy kịch. Các trạng thái viêm như nhiễm trùng huyết gây ra sự thay đổi hình dạng trong CBG sao cho ái lực của nó với cortisol giảm, cho phép tách rời phân tử và tăng cường cung cấp cortisol đến các mô [55, 56]. Tuy nhiên, nồng độ CBG giảm tỷ lệ thuận với mức độ nghiêm trọng của bệnh và là dấu hiệu tiên lượng kém [56]. Trong dân số không xơ gan, một nghiên cứu gần đây cho thấy nồng độ CBG < 200 nmol/L là dự đoán độc lập về tỷ lệ tử vong ngắn hạn ở bệnh nhân sốc nhiễm trùng [57]. Mặc dù không được nghiên cứu rõ ràng, suy luận hợp lý cho thấy rằng ở những bệnh nhân xơ gan (có nồng độ CBG nền thấp) và bệnh nguy kịch, việc cung cấp cortisol theo mô có thể không đủ để đáp ứng nhu cầu gia tăng cục bộ. Hơn nữa, hiện tượng phân ly ACTH-cortisol trong bệnh nguy kịch chứng minh rằng mặc dù mức cortisol nội sinh tối đa, nồng độ ACTH thường thấp hơn dự đoán và có thể phản ánh sự ức chế bài tiết ACTH và cortisol xung [58]. Mặc dù các nghiên cứu trước đây về suy thượng thận ở bệnh nhân xơ gan bị bệnh nguy kịch không đo nồng độ ACTH [2, 11, 12, 15], nhưng những bệnh nhân không bị bệnh nặng có suy thượng thận tương đối có mức ACTH tương tự hoặc thấp hơn so với bệnh nhân có chức năng tuyến thượng thận được bảo tồn [5, 7].
Suy giảm sự tổng hợp steroid trong bệnh nguy kịch không chỉ giới hạn ở thiếu hụt glucocorticoid. Bằng chứng tích lũy cho thấy sự tổng hợp androgen tuyến thượng thận cũng bị ảnh hưởng tiêu cực. Một số nghiên cứu chứng minh giảm nồng độ dehydroepiandrosterone sulfate (DHEAS) và tăng tỷ lệ cortisol so với DHEAS liên quan đến tăng tỷ lệ tử vong [59-61]. Phát hiện tiên lượng quan trọng này cũng đã được chứng minh trong một nhóm bệnh nhân xơ gan gần đây [62]. Cho dù điều này đại diện cho sự chuyển hướng con đường steroid tuyến thượng thận hoặc tác dụng khác biệt của bệnh là không rõ ràng, nhưng sự hiện diện của nó hỗ trợ khái niệm “kiệt sức” tuyến thượng thận chức năng. Thật thú vị, nồng độ DHEAS thấp cũng đã được báo cáo ở những bệnh nhân bị bệnh không nghiêm trọng bị viêm gan nhiễm mỡ không do rượu và xơ hóa tiến triển, mặc dù liệu những điều này có mang ý nghĩa tiên lượng tương tự hay không vẫn chưa được biết [63]. Mặc dù đầy hứa hẹn, cần nhiều nghiên cứu hơn để hiểu liệu DHEAS có phải là một yếu tố nguy cơ độc lập gây tử vong trong cả bệnh nguy kịch và không nguy kịch hay không.
Phương pháp thay thế để đánh giá chức năng tuyến thượng thận trong xơ gan
Những hạn chế của đo cortisol toàn phần trong xơ gan đã dẫn đến việc xem xét các dấu hiệu độc lập globulin liên kết của chức năng tuyến thượng thận (Bảng 1). CSRmax được đề cập trước đây là một tham số tính toán đã được báo cáo trong một số quần thể, bao gồm xơ gan, nhưng yêu cầu mô hình toán học và được sử dụng tốt nhất cho nghiên cứu hơn là tại giường bệnh [32, 64-66]. Bởi vì cortisol tự do trong huyết tương có hoạt tính sinh học và không liên kết với CBG hoặc albumin, một số người ủng hộ việc sử dụng nó trong xơ gan. Những người ủng hộ cortisol tự do trong huyết tương cho rằng suy thượng thận được chẩn đoán quá mức trong xơ gan khi ngưỡng cortisol toàn phần tiêu chuẩn được sử dụng để giải thích xét nghiệm kích thích ACTH [5, 22, 67]. Tuy nhiên, điều quan trọng cần lưu ý là khái niệm suy thượng thận trong bệnh gan đại diện cho một phổ suy tuyến thượng thận. Y văn hiện tại không phải là giáo điều trong đặc tính của nó, vì các thuật ngữ suy thượng thận và suy thượng thận tương đối thường được sử dụng thay thế cho nhau. Do đó, đáp ứng cortisol toàn phần kích thích bất thường ở bệnh nhân xơ gan có thể đại diện cho một trong ba khả năng:
| Phương pháp chẩn đoán | Điểm mạnh | Điểm yếu | Đề xuất sử dụng lâm sàng |
|---|---|---|---|
| Cortisol toàn phần | • Có sẵn khắp nơi • Dễ dàng tiếp thu và diễn giải • Kết quả nhanh chóng • Ý nghĩa tiên lượng |
• Phụ thuộc globulin liên kết
• Mức độ phụ thuộc xét nghiệm (sắc ký lỏng-khối phổ, tiêu chuẩn vàng) • Các ngưỡng chẩn đoán khác nhau được sử dụng trong y văn |
Thói quen, giải thích một cách thận trọng |
| Cortisol huyết tương tự do | • Globulin liên kết độc lập • Đo cortisol có hoạt tính sinh học • Mức nền tương quan tốt với cortisol toàn phần |
• Thời gian quay vòng chậm
• Thiếu tính sẵn có rộng rãi • Không rõ ý nghĩa tiên lượng |
Phụ trợ, nếu cóa |
| Cortisol nước bọt | • Dễ thực hiện | • Thời gian quay vòng chậm
• Thiếu tính sẵn có rộng rãi • Không rõ ý nghĩa tiên lượng |
Hiện không được khuyến nghịb |
aCó khả năng phân biệt suy thượng thận tuyệt đối và tương đối.
bHiện đang được sử dụng chủ yếu trong môi trường nghiên cứu; bằng chứng bổ sung cần thiết trước khi sẵn sàng để sử dụng thường xuyên.
-
1) suy thượng thận thực sự (tuyệt đối): giảm bài tiết steroid tuyến thượng thận không phụ thuộc tình huống,
-
2) suy thượng thận tương đối: phản ứng tuyến thượng thận không đầy đủ đối với các kích thích stress [6], hoặc
-
3) Dương tính giả: một yếu tố nhiễu của tổng hợp globulin liên kết gan giảm.
Các tình huống 1 và 3 có thể được phân biệt bằng việc đo cortisol tự do trong huyết tương, vì nhiều nghiên cứu đã chỉ ra các phản ứng thích hợp đối với thử nghiệm kích thích ACTH [5, 22, 67]. Tuy nhiên, tiện ích của nó trong suy thượng thận tương đối (kịch bản 2) vẫn chưa được xác định. Thật thú vị, mức cortisol toàn phần và cortisol tự do trong huyết tương nền tương tự nhau ở những bệnh nhân có và không có suy thượng thận tương đối và tương quan chặt chẽ [1, 5, 6, 68]. Tuy nhiên, ý nghĩa lâm sàng của cortisol tự do trong huyết tương vẫn chưa được biết; tài liệu dựa trên kết quả trong đó cortisol tự do trong huyết tương được đo chủ yếu xác định suy thượng thận tương đối liên quan đến phản ứng cortisol toàn phần [6, 8, 9].
Một số nhược điểm khác đối với cortisol tự do trong huyết tương ngăn cản việc áp dụng nó như là tiêu chuẩn vàng để đánh giá chức năng tuyến thượng thận trong xơ gan. Tương tự như Cortisol toàn phần, ngưỡng cortisol tự do trong huyết tương đặc hiệu cho bệnh nhân xơ gan không được thiết lập; hầu hết các tác giả sử dụng mức cortisol tự do trong huyết tương đỉnh được kích thích < 33 nmol/L [5, 22, 67]. Đo lường trực tiếp cortisol tự do trong huyết tương cũng là vấn đề trong thực hành lâm sàng. Các mẫu bệnh nhân thường được gửi đến phòng xét nghiệm tham chiếu bên ngoài do yêu cầu phân tích đối với LC-MS. Do đó, chi phí gia tăng và sự chậm trễ báo cáo lên đến 1 đến 2 tuần ngăn cản việc sử dụng trong các tình huống lâm sàng khẩn cấp khi liệu pháp thay thế glucocorticoid đang được xem xét. Mức cortisol tự do trong huyết tương ước tính có thể thu được, phổ biến nhất là sử dụng công thức Coolens, mặc dù điều này không chính xác hơn và chủ yếu được sử dụng trong nghiên cứu [69].
Để đối phó với các vấn đề với cả đo cortisol toàn phần và cortisol tự do trong huyết tương ở bệnh nhân xơ gan, cortisol nước bọt (SC) là một lựa chọn thay thế được đề xuất. Khi sử dụng cortisol nước bọt nền < 5,0 nmol/L, cortisol nước bọt đỉnh < 35 nmol/L hoặc delta cortisol nước bọt < 8,3 nmol/L, tất cả đều có nguồn gốc từ dân số không xơ gan, tỷ lệ hiện mắc của suy thượng thận kém mạnh mẽ hơn [70]. Mặc dù việc thực hiện cortisol nước bọt là đơn giản, nhưng ý nghĩa tiên lượng của nó vẫn chưa được biết. Thu thập mẫu nước bọt thường đòi hỏi một khoảng thời gian nghỉ ăn uống qua đường miệng, điều này có thể gây ra những thách thức nhỏ về hậu cần ở một số bệnh nhân. Ngoài ra, mối tương quan nồng độ cortisol nước bọt và cortisol toàn phần có thể phụ thuộc vào mức độ hạ albumin máu hiện diện [70, 71]. Cần xác nhận thêm để đưa ra kết luận dứt khoát. Tóm lại, cortisol nước bọt có tiềm năng là một công cụ có giá trị để đánh giá chức năng tuyến thượng thận ở bệnh nhân xơ gan, nhưng cần nghiên cứu thêm trước khi có thể được khuyến cáo làm xét nghiệm đầu tay.
Suy thượng thận và phương pháp kiểm tra suy thượng thận trong xơ gan
Tỷ lệ hiện mắc suy thượng thận trong xơ gan tương đồng với mức độ nghiêm trọng của bệnh [8, 68, 72]. Rối loạn chức năng tuyến thượng thận cũng có thể là mang tính trường hợp theo tình trạng bệnh hiện tại. Do đó, các bác sĩ lâm sàng nên sử dụng phương pháp chẩn đoán có thể phân biệt giữa suy thượng thận tuyệt đối và tương đối vì điều này có ý nghĩa điều trị.
Chúng tôi khuyến cáo ngưỡng thấp để chẩn đoán suy thượng thận tương đối tạm thời ở bệnh nhân xơ gan và huyết động không ổn định, đặc biệt là trong trường hợp bệnh nguy kịch. Bởi vì suy thượng thận tương đối được ghi nhận rõ ràng trong bệnh gan mất bù có và không có bệnh nghiêm trọng, chúng tôi đưa ra giả thuyết rằng sự hiện diện của nó có thể là sản phẩm phụ của cả hai tình trạng tiềm ẩn. Tuy nhiên, việc thiếu nghiên cứu theo chiều dọc liên quan đến dòng thời gian (hoặc thực tế) của phục hồi chức năng tuyến thượng thận hạn chế suy luận thêm.
Đánh giá trục HPA trong bệnh nguy kịch là khó khăn, như đã mô tả trước đây. Nói tóm lại, chúng tôi ủng hộ việc quản lý SD-SST và sử dụng ngưỡng delta cortisol toàn phần < 250 nmol/L để xác định suy thượng thận tương đối (CIRCI) tại thời điểm này. Cơ sở lý luận của chúng tôi cho khuyến nghị có điều kiện này là 2 lần. Liều siêu sinh lý của ACTH và đánh giá tốc độ thay đổi thay vì mức cao nhất có thể làm giảm một số ảnh hưởng của chức năng tổng hợp gan bị suy giảm. Điều quan trọng, phương pháp chẩn đoán này cũng có xác nhận lâm sàng tốt hơn vì các nghiên cứu trước đây ở bệnh nhân nhiễm trùng huyết hoặc xuất huyết do giãn vỡ tĩnh mạch thực quản và suy thượng thận tương đối có kết quả lâm sàng tồi tệ hơn bao gồm tăng phụ thuộc thuốc vận mạch và tử vong ngắn hạn [12, 73]. Các ngưỡng chẩn đoán khác và/hoặc sử dụng cortisol tự do trong huyết tương hoặc cortisol nước bọt bị hạn chế đáng kể do thiếu hiệu lực trong nhóm dân số này và ý nghĩa tiên lượng không rõ ràng.
Chẩn đoán suy thượng thận tương đối ở những bệnh nhân không bị bệnh nặng cũng không đáng lo ngại. Các tài liệu không đồng nhất liên quan đến phương pháp chẩn đoán và ngưỡng được sử dụng. Ngoài ra, không có tiêu chí chính thức nào tồn tại để phác thảo các thông số cần đánh giá. Các yếu tố dự đoán suy thượng thận trong xơ gan bao gồm Mô hình cao hơn cho bệnh gan giai đoạn cuối và điểm số Child-Pugh, cổ trướng và mức albumin thấp hơn; Thật thú vị, các dấu hiệu cụ thể của chức năng tổng hợp như bilirubin hoặc tỷ lệ chuẩn hóa quốc tế không liên quan [74]. Mức HDL thấp cũng nổi bật hơn ở bệnh nhân xơ gan và suy thượng thận, mặc dù độ nhạy hoặc độ đặc hiệu của ngưỡng HDL cụ thể vẫn chưa được xác định [6]. Chúng tôi đề nghị bệnh nhân xơ gan mất bù và bất kỳ điều nào sau đây nên được đánh giá về suy thượng thận:
-
1) Hạ natri máu nặng (natri < 125 mEq/L), đặc biệt nếu không có giải thích thay thế rõ ràng,
-
2) Hạ huyết áp dai dẳng, đặc biệt là ở bệnh nhân ngoại trú, và/hoặc
-
3) Đau bụng không rõ nguyên nhân.
Trong dân số này, điều quan trọng là phải đánh giá cả hai thành phần chính và phụ cho suy thượng thận. Mức cortisol toàn phần vào sáng sớm có thể được xem xét cho mục đích sàng lọc, mặc dù việc sử dụng nó có thể lớn hơn trong trường hợp suy thượng thận tuyệt đối đang được xem xét thay vì phát hiện suy thượng thận tương đối. Đầu tiên, độ đặc hiệu cao của nồng độ cortisol toàn phần nền < 138 nmol/L (< 55 nmol/L với các xét nghiệm mới hơn) đối với suy thượng thận có nguồn gốc từ dân số nói chung và có rất ít tài liệu xác nhận việc sử dụng nó ở bệnh nhân xơ gan. Thứ hai, liệu nồng độ cortisol toàn phần nền có khác nhau giữa bệnh nhân có và không có suy thượng thận tương đối hay không vẫn chưa được giải quyết với các báo cáo mâu thuẫn [6, 7, 48, 75].
Thay vào đó, chúng tôi khuyến cáo nên thực hiện SD-SST với xét nghiệm cả cortisol toàn phần và cortisol tự do trong huyết tương kích thích nền và đỉnh (Hình 3). Thời gian dùng thuốc tối ưu ở bệnh nhân mắc bệnh gan vẫn chưa được biết. Các tài liệu gần đây cho thấy rằng trong dân số nói chung, kết quả kiểm tra kích thích là bất khả tri với thời gian trong ngày [76]. Tuy nhiên, ngoại suy cho dân số xơ gan có giá trị không chắc chắn. Vì vậy, chúng tôi đề nghị kiểm tra vào sáng sớm khi nồng độ cortisol được dự đoán là cao nhất. Do ảnh hưởng tiềm tàng của mức độ bệnh tật và gián đoạn nhịp sinh học ảnh hưởng đến kết quả, các bác sĩ lâm sàng cũng có thể muốn xem xét lặp lại SD-SST vào ngày hôm sau để xác nhận (hoặc bác bỏ) những phát hiện ban đầu.
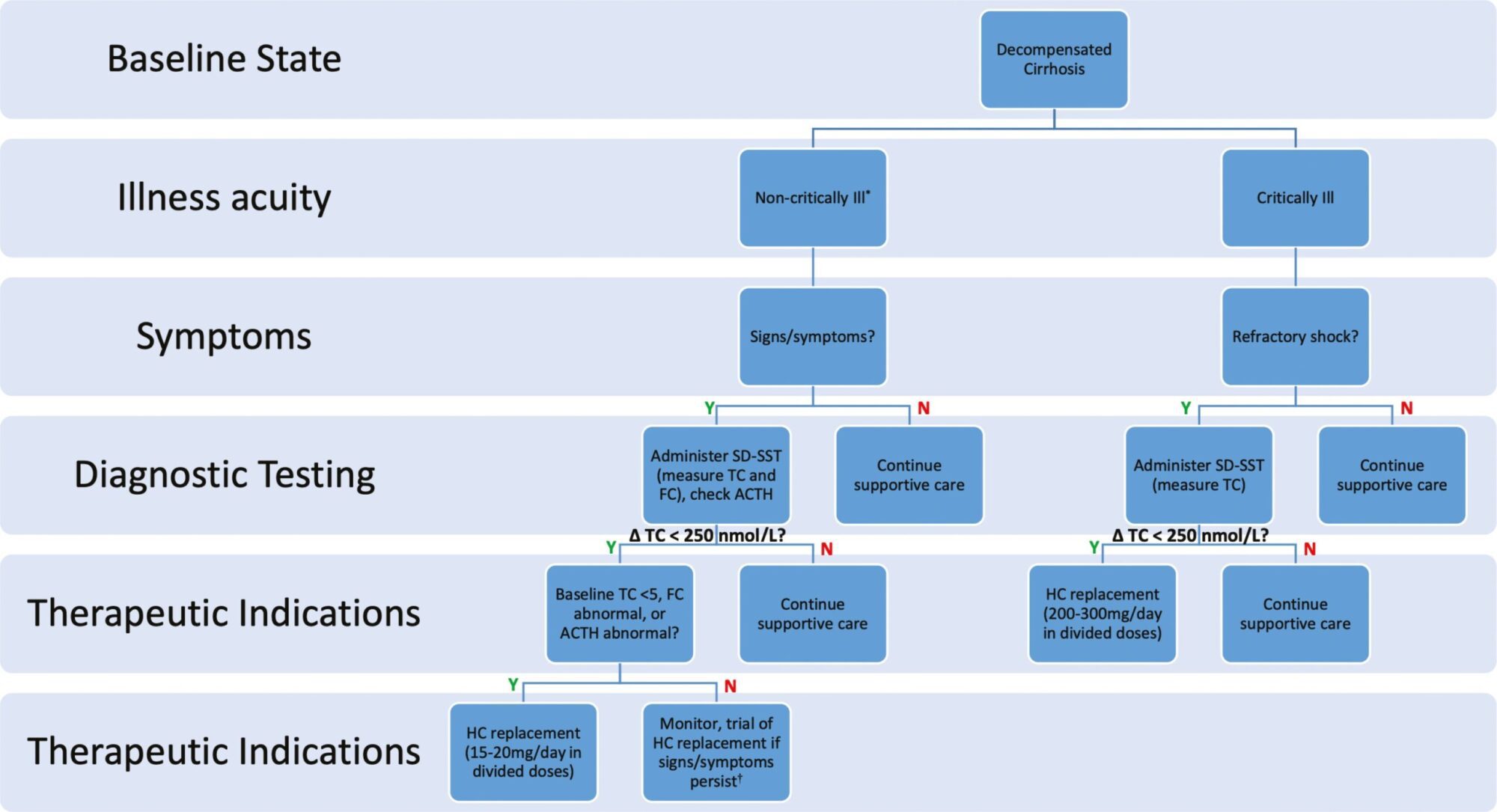
Hình 3. Thuật toán mới để chẩn đoán và quản lý suy thượng thận trong xơ gan. *Bao gồm bệnh nhân ngoại trú và bệnh nhân nhập viện trong môi trường đơn vị chăm sóc không ICU. †Ngưỡng thấp để xem xét thử nghiệm thay thế hydrocortison trong trường hợp mệt mỏi không rõ nguyên nhân hoặc nghiêm trọng, hạ huyết áp, hạ natri máu và/hoặc đau bụng sau khi loại trừ các yếu tố nguyên nhân có thể đảo ngược khác. Tên viết tắt: FPC, cortisol huyết tương tự do; HC, hydrocortison; SD-SST, xét nghiệm kích thích ACTH liều tiêu chuẩn; TC, cortisol toàn phần.
Như đã mô tả trước đây, suy thượng thận tương đối được xác định không đồng nhất. Việc giải thích nồng độ cortisol toàn phần nên phụ thuộc vào xét nghiệm và tính đến mức độ suy giảm tổng hợp gan. Sử dụng delta thay vì cortisol đỉnh cho phép đánh giá năng động hơn về đáp ứng tuyến thượng thận và ít bị ảnh hưởng bởi sự thiếu hụt protein liên kết nền. Mức cortisol toàn phần bất thường có thể nhanh chóng cung cấp chẩn đoán suy thượng thận tương đối tạm thời, mặc dù sẽ có một số lượng đáng kể các kết quả dương tính giả [5]. Khi các mức cortisol huyết tương tự do có sẵn, những mức này có thể hỗ trợ xác nhận hoặc bác bỏ suy thượng thân tương đối. Hiện tại không có đủ bằng chứng để xác định tiện ích của cortisol nước bọt hoặc xét nghiệm dung nạp insulin; Ngoài ra, sau này có thể không an toàn ở những bệnh nhân xơ gan mất bù. Đo đồng thời ACTH huyết tương ban đầu có thể hữu ích để phân biệt giữa đóng góp chính hay phụ cho AI, mặc dù giải thích thận trọng là tối quan trọng đối với bệnh đồng thời (ngay cả khi không nguy kịch). Đo nồng độ DHEAS cũng có thể được xem xét để đánh giá thành phần suy thượng thận trung ương. Tỷ lệ cortisol/DHEAS cao gợi ý về suy thượng thận trung ương vì sự hình thành androgen tuyến thượng thận trong lớp lưới vỏ thượng thận có tác dụng nuôi dưỡng ACTH mạnh và bài tiết androgen bị suy yếu có thể xảy ra trước khi thiếu glucocorticoid [77]. Tuy nhiên, phát hiện này đã được ghi nhận trong một dân số không xơ gan được quản lý LD-SST và giá trị bên ngoài của nó là không rõ ràng.
Trong dân số nói chung, nồng độ aldosterone huyết tương và hoạt tính renin có thể phân biệt thêm giữa suy thượng thận nguyên phát và trung ương. Ngược lại, trong xơ gan, tính hợp lệ của các xét nghiệm này chưa được chứng minh vì hệ thống renin-angiotensin-aldosterone thường được điều chỉnh cao. Hơn nữa, rối loạn chức năng thận đồng thời và/hoặc sử dụng thuốc đối kháng aldosterone là phổ biến, cả hai đều gây nhầm lẫn cho việc giải thích. Hiện tại, chúng tôi không thường xuyên khuyến cáo nên lấy nồng độ aldosterone hoặc nồng độ aldosterone huyết tương và hoạt tính renin bên ngoài bối cảnh nghiên cứu trừ khi tăng kali máu và huyết động không ổn định tồn tại trong trường hợp không có liệu pháp đối kháng aldosterone.
Quản lý và tiên lượng suy thượng thận ở bệnh nhân xơ gan
Phân loại thích hợp về hình thức suy thượng thận (tuyệt đối so với tương đối), ngoài bối cảnh bệnh nhân, là rất quan trọng khi đưa ra chiến lược quản lý. Ở những bệnh nhân có bằng chứng về suy thượng thận nguyên phát tuyệt đối (PAI), cần bắt đầu thay thế glucocorticoid kịp thời theo hướng dẫn hiện hành với tổng số 15 đến 25 mg hydrocortisone chia làm 2 hoặc 3 liều [3]. Tuy nhiên, liệu việc thay thế mineralocorticoid (liều điển hình 0,05-0,1 mg/ngày) có cần thiết trong trường hợp PAI và xơ gan hay không vẫn chưa rõ ràng. Sinh lý xơ gan có thể bắt chước thiếu hụt mineralocorticoid và sử dụng thuốc lợi tiểu quai đồng thời và/hoặc thuốc đối kháng aldosterone gây nhầm lẫn. Thay thế androgen gây tranh cãi ở phụ nữ bị PAI và chưa được nghiên cứu đầy đủ trong xơ gan.
Nếu suy thượng thận thứ phát tồn tại, cần đánh giá và điều trị bất kỳ sự thiếu hụt hormone tuyến yên đồng thời nào ngoài việc sử dụng glucocorticoid. Liệu pháp mineralocorticoid hoặc androgen thường không cần thiết vì ACTH không điều chỉnh bài tiết aldosterone. Kịch bản lâm sàng phổ biến hơn nhiều liên quan đến việc quản lý suy thượng thận trong xơ gan là khi mức độ suy tuyến thượng thận là “tương đối”.
Ở những bệnh nhân mắc bệnh nguy kịch, việc thay thế glucocorticoid đã được nghiên cứu kỹ trong dân số nói chung. Hướng dẫn hiện tại về chăm sóc tích cực và Chiến dịch Sống sót sau nhiễm trùng huyết khuyến cáo sử dụng corticosteroid ở bệnh nhân sốc nhiễm khuẩn không đáp ứng với hồi sức thể tích và liệu pháp thuốc vận mạch ban đầu nhằm cải thiện tình trạng giải quyết sốc, số ngày không dùng thuốc vận mạch và tỷ lệ tử vong ngắn hạn [52, 78]. Sử dụng hydrocortisone trong xơ gan với liều stress tiêu chuẩn từ 200 đến 300 mg/ngày chia làm 3 đến 4 liều đã cho thấy kết quả hỗn hợp hơn. Như đã thấy trong Bảng 2, 4 nghiên cứu quan sát hồi cứu đã cho thấy sự giảm liên tục nhu cầu thuốc vận mạch và tỷ lệ tử vong trong bệnh viện, mặc dù đã có một số tín hiệu liên quan đến sự gia tăng nhiễm khuẩn kháng thuốc [2, 11, 13, 15]. Một thử nghiệm ngẫu nhiên có đối chứng duy nhất cho thấy giảm liều thuốc vận mạch và đảo ngược sốc, nhưng nghiên cứu đã bị chấm dứt sớm do tăng tái phát sốc, xuất huyết tiêu hóa và không giảm tỷ lệ tử vong trong 28 ngày [14]. Sự khác biệt về phương pháp, bao gồm thiết kế nghiên cứu, có thể giải thích cho những phát hiện tương phản này và nên thận trọng cho các bác sĩ lâm sàng.
| Tác giả | Năm | N | Dân số | Thiết kế nghiên cứu | Thử nghiệm kích thích ACTH | Định nghĩa RAI | Tỷ lệ RAI | Liều HC | Kết quả |
|---|---|---|---|---|---|---|---|---|---|
| Harry và cộng sự. | 2003 | 40 | Hỗn hợp – suy gan cấp tính hoặc xơ gan mất bù + phụ thuộc thuốc vận mạch | Đối chứng ca bệnh hồi cứu • Nhóm 1 (20): HC • Nhóm 2 (20): không có HC |
SD-SST | 1) Cortisol toàn phần cơ sở < 250 nmol/L HOẶC 2) ΔCortisol toàn phần < 250 nmol/LHOẶC3) Cortisol toàn phần đỉnh < 500 nmol/L |
Đường cơ sở: 28% Δ: 69% Đỉnh: 44% | 300 mg/ngày | ↓ liều thuốc vận mạch lúc 48 giờ ↑ LOS ICU, nhiễm vi khuẩn ↔ MDR sống sót trong bệnh viện, xuất huyết đường tiêu hóa |
| Marik và cộng sự. | 2005 | 340 | Suy gan hỗn hợp – cấp tính và mãn tính, người nhận ghép gan trên giao thức không steroid, chảy máu đường tiêu hóa | Nhóm thuần tập hồi cứu | LD-SST | 4) Cortisol toàn phần ngẫu nhiên < 552 nmol/L (Stress cao)mộtHOẶC 5) Cortisol toàn phần ngẫu nhiên < 414 nmol/L (không Stress cao) HOẶC6) Cortisol toàn phần đỉnh < 552 nmol/L |
72% | 100 mg mỗi 8 giờ | ↓ liều thuốc vận mạch lúc 24 giờ, tỷ lệ tử vong tại bệnh viện |
| Fernandez và cộng sự. | 2006 | 75 | Xơ gan + sốc nhiễm trùng | Đoàn hệ tiến cứu/hồi cứu lai • Nhóm 1 (25): Đo chức năng tuyến thượng thận, HC nếu suy thượng thận tương đối (tương lai) • Nhóm 2 (50): Chức năng thượng thận không đo được (hồi cứu) |
Nhóm 1: SD-SST | 1) Cortisol toàn phần cơ sở < 414 nmol/L HOẶC 2) Δ TC< 250 nmol/L |
Nhóm 1: 68% | 50 mg mỗi 6 giờ (nếu RAI) | ↓ suy thận ↑ giải quyết sốc, sống sót sau ICU, tỷ lệ nhiễm trùng sống sót ↔ tại bệnh viện, xuất huyết đường tiêu hóa |
| Arabi và cộng sự. | 2010 | 75 | Xơ gan + sốc nhiễm trùng | RCT • 39 HC • 36 giả dược |
SD-SST | Δ Cortisol toàn phần < 250 nmol/L | 76% | 50 mg mỗi 6 giờ hoặc giả dược | ↓ liều thuốc vận mạch, đảo sốc ↑ tái phát sốc, xuất huyết ↔ đường tiêu hóa tử vong 28-d |
| Vũ và cộng sự. | 2020 | 64 | Xơ gan + phụ thuộc thuốc vận mạchb | Nhóm thuần tập hồi cứu • 40 HC • 24 không có |
SD-SST | 1) Cortisol toàn phần ngẫu nhiên < 552 nmol/L HOẶC 2) Cortisol toàn phần cơ sở < 414 nmol/L HOẶC
3) Δ TC < 250 nmol/L và Cortisol toàn phần cơ sở 386-938 nmol/L |
150-300 mg/ngày chia liềuc | ↓ ngày dùng thuốc vận mạch ↓ tỷ lệ nhiễm trùng tử vong ↔ trong bệnh viện, LOS |
Tên viết tắt: GI, gastrointestinal; HC, hydrocortison; ICU, đơn vị chăm sóc đặc biệt; LD-SST, xét nghiệm Synacthen ngắn liều thấp; LOS, thời gian nằm viện; MDR, đa kháng thuốc; RAI, suy thượng thận tương đối; RCT, thử nghiệm ngẫu nhiên có đối chứng; SD-SST, xét nghiệm Synacthen ngắn liều tiêu chuẩn; TC, Cortisol toàn phần
aStress cao được định nghĩa là suy hô hấp giảm oxy máu kèm theo hạ huyết áp hoặc cần dùng thuốc vận mạch.
bKhông bao gồm sốc xuất huyết hoặc sốc tim.
cLiều lượng chính xác theo quyết định của bác sĩ chuyên khoa.
Một lời giải thích khả dĩ khác cho việc thiếu lợi ích đồng đều đối với hydrocortisone liều cao là sự sẵn có globulin gắn corticosteroid hạn chế có thể dẫn đến lọc thận dư thừa và bài tiết cortisol qua nước tiểu. Ở những bệnh nhân không bị suy thận đáng kể, nồng độ cortisol trong nước tiểu tăng cao thường gặp ở tình trạng tăng cortisol [79]. Tuy nhiên, các tài liệu cũ cho thấy bệnh nhân mắc bệnh gan có thể đã giảm bài tiết cortisol qua nước tiểu [80]. Thật không may, việc thiếu phương pháp đo đồng thời tốc độ dịch lọc cầu thận làm mờ khả năng phân biệt xem hiệu ứng này có liên quan đến suy thận hay ảnh hưởng nội tại của bệnh gan hay không. Mối quan hệ này rất khó định lượng vì nhiều bệnh nhân xơ gan và bệnh nguy kịch bị tổn thương thận.
Ngược lại, liệu pháp glucocorticoid có thể gây ra hội chứng Cushing do thuốc do giảm cả nồng độ globulin liên kết và hoạt động enzyme 11β-HSD được thấy ở bệnh nhân mắc bệnh gan và / hoặc thận (bao gồm cả hội chứng gan thận). Điều này chưa được nghiên cứu kỹ nhưng glucocorticoid dư thừa được biết là làm thay đổi chức năng miễn dịch, dẫn đến tăng điều hòa các cytokine gây viêm và tăng tính nhạy cảm với nhiễm trùng [81]. Do đó, mặc dù liệu pháp glucocorticoid có thể được xem xét ở những bệnh nhân xơ gan bị bệnh nặng, nhưng cần nghiên cứu thêm để làm sáng tỏ cụ thể các quần thể phụ tối ưu và thời gian điều trị [18, 82].
Điều trị suy thượng thận tương đối trong bệnh không nguy kịch, kịch bản lâm sàng phổ biến nhất, vẫn còn gây tranh cãi. Mặc dù suy thượng thận tương đối có liên quan đến việc tăng tỷ lệ tử vong độc lập với điểm số của Bệnh gan giai đoạn cuối [6-9], nhưng không có thử nghiệm nào đánh giá hiệu quả và độ an toàn của việc thay thế steroid bên ngoài môi trường đơn vị chăm sóc đặc biệt. Do thiếu bằng chứng để hỗ trợ sử dụng thường quy và nguy cơ nhiễm trùng tiềm ẩn ở những bệnh nhân đã bị suy giảm miễn dịch chức năng, một động lực mạnh mẽ cho liệu pháp theo kinh nghiệm là cần thiết. Ở những bệnh nhân không có triệu chứng, chúng tôi không khuyến cáo hydrocortisone liều nạp trước, nhưng có thể cân nhắc thay thế theo kinh nghiệm trong tương lai nếu bệnh nguy kịch phát triển. Ở những bệnh nhân có các triệu chứng có thể quy cho suy thượng thận, chẳng hạn như hạ huyết áp dai dẳng hoặc đau bụng không rõ nguyên nhân, một thử nghiệm glucocorticoid có thể hợp lý để xem các triệu chứng có cải thiện hay không. Theo dõi chặt chẽ các dấu hiệu dư thừa cortisol hoặc nhiễm trùng là bắt buộc. Chúng tôi cảnh báo chống lại việc sử dụng bổ sung glucocorticoid ở những bệnh nhân chỉ bị rối loạn điện giải trừ khi tất cả các yếu tố đóng góp có thể khác đã được loại bỏ. Mệt mỏi như một triệu chứng quy cho suy thượng thận phải xuất hiện cùng với các đặc điểm khác gợi ý về suy thượng thận do tính phổ biến của nó trong bệnh gan mãn tính [83].
Bản chất dọc của suy thượng thận tương đối không được thiết lập. Sự hiểu biết về mầm bệnh hiện nay cho thấy bản chất không ngừng nếu có trong trường hợp không có bệnh nguy kịch. Gần đây, sự phát triển của suy thượng thận tương đối đã được coi là đại diện cho một suy nội tạng gần như rối loạn chức năng thận được công nhận rộng rãi hơn của xơ gan (hội chứng gan thận) [7]. Liệu pháp thay thế steroid, nếu được dung nạp và chứng minh cải thiện lâm sàng, do đó nên được tiếp tục vô thời hạn hoặc cho đến khi cấy ghép. Sự chuyển đổi sinh lý HPA từ trạng thái xơ gan sang không xơ gan đã được đặc trưng tốt liên quan đến các hormone khác [26]. Nhiều bệnh nhân được cấy ghép gan có thể được cai thành công từ liệu pháp steroid cảm ứng trong vòng 1 đến 3 tháng sau ghép, cho thấy suy thượng thận tương đối liên quan đến xơ gan giải quyết do hậu quả của bình thường hóa cân bằng nội môi trong trường hợp không có tăng áp lực tĩnh mạch cửa và viêm toàn thân. Liệu bệnh nhân có suy thượng thận tương đối đã biết và được điều trị bằng glucocorticoids trước khi cấy ghép có nên được chỉ định giảm dần lâu hơn do ức chế HPA tiềm năng hay không vẫn chưa được biết.
Tóm lại, điều trị suy thượng thận trong xơ gan đòi hỏi một cách tiếp cận cá nhân hóa do thiếu sự đồng thuận để quản lý tối ưu. Do tính mãn tính của bệnh và nhu cầu giải thích của chuyên gia về các xét nghiệm chẩn đoán, chúng tôi khuyyến cáo bệnh nhân xơ gan và suy thượng thận tiềm năng hoặc đã được xác nhận nên được quản lý chung bởi bác sĩ gan mật và bác sĩ nội tiết.
Kết luận
Đánh giá suy thượng thận trong xơ gan rất khó khăn và đòi hỏi sự chú ý cẩn thận đến nhiều biến số liên quan đến bệnh nhân. Các phương pháp nội tiết truyền thống để chẩn đoán và quản lý suy thượng thận không tính đến sinh lý ở trạng thái xơ gan. Điều quan trọng, phần lớn suy thượng thận trong xơ gan là “tương đối” nhưng đại diện cho một yếu tố dự báo độc lập về tỷ lệ tử vong ngắn hạn đến trung hạn. Cần nhiều nghiên cứu hơn để hiểu đầy đủ các cơ chế cơ bản của suy thượng thận trong xơ gan. Do thiếu lợi ích rõ ràng của việc thay thế glucocorticoid trong nhiều tình huống lâm sàng phổ biến, nồng độ Cortisol toàn phần thấp trong trường hợp không có dấu hiệu và triệu chứng nhất quán của suy thượng thận không đảm bảo điều trị theo kinh nghiệm. Ngoài ra, các bác sĩ lâm sàng nên xem xét nguy cơ của glucocorticoid ngoại sinh, bao gồm làm trầm trọng thêm tình trạng suy giảm miễn dịch ban đầu và/hoặc gây ra hội chứng Cushing do thuốc.
Viết tắt
-
-
11β-HSD: 11 beta-hydroxysteroid dehydrogenase
-
-
-
AI: suy thượng thận
-
-
-
CBG: globulin gắn corticosteroid
-
-
-
CIRCI: suy corticosteroid liên quan đến bệnh nguy kịch
-
-
-
CSRmax: tỷ lệ bài tiết cortisol tối đa
-
-
-
DHEAS: dehydroepiandrosterone sulfat
-
-
-
FPC: cortisol huyết tương tự do
-
-
-
HDL: lipoprotein mật độ cao
-
-
-
HPA: vùng dưới đồi-tuyến yên-thượng thận
-
-
-
LCAT: lecithin-cholesterol acyltransferase
-
-
-
LC-MS: sắc ký lỏng-khối phổ song song
-
-
-
LD-SST: thử nghiệm kích thích cosyntropin liều thấp (Synacthen)
-
-
-
PAI: suy thượng thận nguyên phát
-
-
-
RAI: suy thượng thận tương đối
-
-
-
SC: cortisol nước bọt
-
-
-
SD-SST: thử nghiệm kích thích cosyntropin liều tiêu chuẩn (Synacthen)
-
-
TC: cortisol toàn phần
TÀI LIỆU THAM KHẢO
1. Dichtel LE, Schorr M, Loures de Assis C, et al. Plasma free cortisol in states of normal and altered binding globulins: implications for adrenal insufficiency diagnosis. J Clin Endocrinol Metab. 2019;104(10):4827-4836. doi:10.1210/jc.2019-00022.
2. Marik PE, Gayowski T, Starzl TE, Group; HCRaAPS. The hepatoadrenal syndrome: a common yet unrecognized clinical condition. Crit Care Med. 2005;33(6):1254-1259. doi:10.1097/01.ccm.0000164541.12106.57
3. Bornstein SR, Allolio B, Arlt W, et al. Diagnosis and Treatment of Primary Adrenal Insufficiency: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2016;101(2):364-389. doi:10.1210/jc.2015-1710.
4. Moini M, Yazdani Sarvestani M, Shams M, Nomovi M. Evaluation of adrenal function in nonhospitalized patients with cirrhosis. Can J Gastroenterol Hepatol 2017;2017:2354253. doi:10.1155/2017/2354253.
5. Tan T, Chang L, Woodward A, et al. Characterising adrenal function using directly measured plasma free cortisol in stable severe liver disease. J Hepatol. 2010;53(5):841-848. doi:10.1016/j.jhep.2010.05.020.
6. Wentworth BJ, Haug RM, Northup PG, Caldwell SH, Henry ZH. Abnormal cholesterol metabolism underlies relative adrenal insufficiency in decompensated cirrhosis. Liver Int. 2021;41(8):1913-1921. doi:10.1111/liv.14970.
7. Piano S, Favaretto E, Tonon M, et al. Including relative adrenal insufficiency in definition and classification of acute-on-chronic liver failure. Clin Gastroenterol Hepatol. 2020;18(5):1188-1196.e3. doi:10.1016/j.cgh.2019.09.035.
8. Jang JY, Kim TY, Sohn JH, et al. Relative adrenal insufficiency in chronic liver disease: its prevalence and effects on long-term mortality. Aliment Pharmacol Ther. 2014;40(7):819-826. doi:10.1111/apt.12891.
9. Acevedo J, Fernández J, Prado V, et al. Relative adrenal insufficiency in decompensated cirrhosis: relationship to short-term risk of severe sepsis, hepatorenal syndrome, and death. Hepatology 2013;58(5):1757-1765. doi:10.1002/hep.26535.
10. Triantos CK, Marzigie M, Fede G, et al. Critical illness-related corticosteroid insufficiency in patients with cirrhosis and variceal bleeding. Clin Gastroenterol Hepatol. 2011;9(7):595-601. doi:10.1016/j.cgh.2011.03.033.
11. Fernández J, Escorsell A, Zabalza M, et al. Adrenal insufficiency in patients with cirrhosis and septic shock: effect of treatment with hydrocortisone on survival. Hepatology 2006;44(5):1288-1295. doi:10.1002/hep.21352.
12. Tsai MH, Peng YS, Chen YC, et al. Adrenal insufficiency in patients with cirrhosis, severe sepsis and septic shock. Hepatology 2006;43(4):673-681. doi:10.1002/hep.21101.
13. Vu T, Vallabh M, Laine G. Adrenal insufficiency and response to stress dose hydrocortisone in patients with cirrhosis and vasopressor dependency using cirrhosis-specific cortisol thresholds. Ann Pharmacother. 2020;54(8):742-749. doi:10.1177/1060028019900266.
14. Arabi YM, Aljumah A, Dabbagh O, et al. Low-dose hydrocortisone in patients with cirrhosis and septic shock: a randomized controlled trial. CMAJ 2010;182(18):1971-1977. doi:10.1503/cmaj.090707.
15. Harry R, Auzinger G, Wendon J. The effects of supraphysiological doses of corticosteroids in hypotensive liver failure. Liver Int. 2003;23(2):71-77. doi:10.1034/j.1600-0676.2003.00813.x.
16. Khan S. Understanding the cholesterol and cytokine network in patients with adrenal insufficiency and cirrhosis. J R Coll Physicians Edinb. 2020;50(1):92-95. doi:10.4997/JRCPE.2020.126.
17. Dirchwolf M, Podhorzer A, Marino M, et al. Immune dysfunction in cirrhosis: distinct cytokines phenotypes according to cirrhosis severity. Cytokine. 2016;77(January 2016):14-25. doi:10.1016/j.cyto.2015.10.006.
18. Moreau R, Weiss E. Should patients with cirrhosis and variceal hemorrhage receive glucocorticoid therapy? Hepatology 2015;61(5):1758-1760. doi:10.1002/hep.27762.
19. McNeilly AD, Macfarlane DP, O’Flaherty E, et al. Bile acids modulate glucocorticoid metabolism and the hypothalamic-pituitary-adrenal axis in obstructive jaundice. J Hepatol. 2010;52(5):705-711. doi:10.1016/j.jhep.2009.10.037.
20. Annane D, Pastores SM, Arlt W, et al. Critical illness-related corticosteroid insufficiency (CIRCI): a narrative review from a Multispecialty Task Force of the Society of Critical Care Medicine (SCCM) and the European Society of Intensive Care Medicine (ESICM). Intensive Care Med. 2017;43(12):1781-1792. doi:10.1007/s00134-017-4914-x.
21. Paz-Delgadillo J, Monreal-Robles R, Villarreal-Pérez JZ, Maldonado-Garza HJ, Bosques-Padilla FJ, Lavalle-González FJ. Algorithm for screening of adrenal function in stable patients with cirrhosis. Ann Hepatol. 2017;16(5):788-796. doi:10.5604/01.3001.0010.2797.
22. Theocharidou E, Giouleme O, Anastasiadis S, et al. Free cortisol is a more accurate marker for adrenal function and does not correlate with renal function in cirrhosis. Dig Dis Sci. 2019;64(6):1686-1694. doi:10.1007/s10620-019-5460-x.
23. Kalambokis GN, Tsiakas I, Christaki M, et al. Assessment of adrenal response in patients with stable cirrhosis and ascites using different short Synacthen tests and definitions. Eur J Gastroenterol Hepatol. 2021;33(1S Suppl 1):e540-e547. doi:10.1097/MEG.0000000000002153
24. Araz F, Soydaş B, Özer B, Serin E. The importance of salivary cortisol in the diagnosis of adrenal insufficiency in cirrhosis. Turk J Gastroenterol. 2016;27(3):268-272. doi:10.5152/tjg.2016.15544.
25. Montagnese S, Middleton B, Mani AR, Skene DJ, Morgan MY. On the origin and the consequences of circadian abnormalities in patients with cirrhosis. Am J Gastroenterol. 2010;105(8):1773-1781. doi:10.1038/ajg.2010.86.
26. Gariani K, Toso C, Philippe J, Orci LA. Effects of liver transplantation on endocrine function: a systematic review. Liver Int. 2016;36(10):1401-1411. doi:10.1111/liv.13158.
27. Oster H, Challet E, Ott V, et al. The functional and clinical significance of the 24-hour rhythm of circulating glucocorticoids. Endocr Rev. 2017;38(1):3-45. doi:10.1210/er.2015-1080.
28. Velissaris D, Karanikolas M, Kalogeropoulos A, et al. Pituitary hormone circadian rhythm alterations in cirrhosis patients with subclinical hepatic encephalopathy. World J Gastroenterol. 2008;14(26):4190-4195. doi:10.3748/wjg.14.4190.
29. Montagnese S, Middleton B, Mani AR, Skene DJ, Morgan MY. Changes in the 24-h plasma cortisol rhythm in patients with cirrhosis. J Hepatol. 2011;54(3):588-90; author reply 590; author reply 90-1. 10.1016/j.jhep.2010.08.015
30. Stewart PM, Burra P, Shackleton CH, Sheppard MC, Elias E. 11 beta-Hydroxysteroid dehydrogenase deficiency and glucocorticoid status in patients with alcoholic and non-alcoholic chronic liver disease. J Clin Endocrinol Metab. 1993;76(3):748-751. doi:10.1210/jcem.76.3.8445034.
Google ScholarPubMedWorldCat
31. Escher G, Nawrocki A, Staub T, et al. Down-regulation of hepatic and renal 11 beta-hydroxysteroid dehydrogenase in rats with liver cirrhosis. Gastroenterology 1998;114(1):175-184. doi:10.1016/s0016-5085(98)70645-6.
32. Lovato CM, Thévenot T, Borot S, et al. Decreased maximal cortisol secretion rate in patients with cirrhosis: relation to disease severity. JHEP Rep 2021;3(3):100277. doi:10.1016/j.jhepr.2021.100277.
33. Wiest R, Moleda L, Zietz B, Hellerbrand C, Schölmerich J, Straub R. Uncoupling of sympathetic nervous system and hypothalamic-pituitary-adrenal axis in cirrhosis. J Gastroenterol Hepatol. 2008;23(12):1901-1908. doi:10.1111/j.1440-1746.2008.05456.x.
34. McDonald JA, Handelsman DJ, Dilworth P, Conway AJ, McCaughan GW. Hypothalamic-pituitary adrenal function in end-stage non-alcoholic liver disease. J Gastroenterol Hepatol. 1993;8(3):247-253. doi:10.1111/j.1440-1746.1993.tb01195.x.
35. Garcia-Martinez R, Caraceni P, Bernardi M, Gines P, Arroyo V, Jalan R. Albumin: pathophysiologic basis of its role in the treatment of cirrhosis and its complications. Hepatology 2013;58(5):1836-1846. doi:10.1002/hep.26338.
36. Fede G, Spadaro L, Tomaselli T, et al. Adrenocortical dysfunction in liver disease: a systematic review. Hepatology 2012;55(4):1282-1291. doi:10.1002/hep.25573.
37. Miller JP. Dyslipoproteinaemia of liver disease. Baillieres Clin Endocrinol Metab 1990;4(4):807-832. doi:10.1016/s0950-351x(05)80080-1.
38. Florén CH, Franzén J, Albers JJ. Apolipoprotein A-I in liver disease. Scand J Gastroenterol. 1987;22(4):454-458. doi:10.3109/00365528708991490.
39. Chang L, Clifton P, Barter P, Mackinnon M. High density lipoprotein subpopulations in chronic liver disease. Hepatology 1986;6(1):46-49. doi:10.1002/hep.1840060109.
40. Kaiser T, Kinny-Köster B, Bartels M, et al. Cholesterol esterification in plasma as a biomarker for liver function and prediction of mortality. BMC Gastroenterol. 2017;17(1):57. doi:10.1186/s12876-017-0614-9.
41. Tahara D, Nakanishi T, Akazawa S, et al. Lecithin-cholesterol acyltransferase and lipid transfer protein activities in liver disease. Metabolism 1993;42(1):19-23. doi:10.1016/0026-0495(93)90166-l.
42. Bochem AE, Holleboom AG, Romijn JA, et al. Adrenal function in females with low plasma HDL-C due to mutations in ABCA1 and LCAT. PLoS One. 2014;9(5):e90967. doi:10.1371/journal.pone.0090967.
43. Singh RR, Walia R, Sachdeva N, Bhalla A, Singh A, Singh V. Relative adrenal insufficiency in cirrhotic patients with ascites (hepatoadrenal syndrome). Dig Liver Dis. 2018;50(11):1232-1237. doi:10.1016/j.dld.2018.05.011.
44. Bornstein SR. Predisposing factors for adrenal insufficiency. N Engl J Med. 2009;360(22):2328-2339. doi:10.1056/NEJMra0804635.
45. Fede G, Spadaro L, Privitera G, et al. Hypothalamus-pituitary dysfunction is common in patients with stable cirrhosis and abnormal low dose Synacthen test. Dig Liver Dis. 2015;47(12):1047-1051. doi:10.1016/j.dld.2015.08.006.
46. El-Farhan N, Pickett A, Ducroq D, et al. Method-specific serum cortisol responses to the adrenocorticotrophin test: comparison of gas chromatography-mass spectrometry and five automated immunoassays. Clin Endocrinol (Oxf) 2013;78(5):673-680. doi:10.1111/cen.12039.
47. Javorsky BR, Raff H, Carroll TB, et al. New cutoffs for the biochemical diagnosis of adrenal insufficiency after ACTH stimulation using specific cortisol assays. J Endocr Soc. 2021;5(4):bvab022. doi:10.1210/jendso/bvab022.
48. Fede G, Spadaro L, Tomaselli T, et al. Assessment of adrenocortical reserve in stable patients with cirrhosis. J Hepatol. 2011;54(2):243-250. doi:10.1016/j.jhep.2010.06.034.
49. Kazlauskaite R, Evans AT, Villabona CV, et al. Corticotropin tests for hypothalamic-pituitary-adrenal insufficiency: a metaanalysis. J Clin Endocrinol Metab. 2008;93(11):4245-4253. doi:10.1210/jc.2008-0710.
50. Wade M, Baid S, Calis K, Raff H, Sinaii N, Nieman L. Technical details influence the diagnostic accuracy of the 1 microg ACTH stimulation test. Eur J Endocrinol. 2010;162(1):109-113. doi:10.1530/EJE-09-0746.
51. Marik PE, Pastores SM, Annane D, et al. Recommendations for the diagnosis and management of corticosteroid insufficiency in critically ill adult patients: consensus statements from an international task force by the American College of Critical Care Medicine. Crit Care Med. 2008;36(6):1937-1949. doi:10.1097/CCM.0b013e31817603ba.
52. Annane D, Pastores SM, Rochwerg B, et al. Guidelines for the Diagnosis and Management of Critical Illness-Related Corticosteroid Insufficiency (CIRCI) in Critically Ill Patients (Part I): Society of Critical Care Medicine (SCCM) and European Society of Intensive Care Medicine (ESICM) 2017. Crit Care Med. 2017;45(12):2078-2088. doi:10.1097/CCM.0000000000002737.
53. Arafah BM. Hypothalamic pituitary adrenal function during critical illness: limitations of current assessment methods. J Clin Endocrinol Metab. 2006;91(10):3725-3745. doi:10.1210/jc.2006-0674.
54. Hamrahian AH, Oseni TS, Arafah BM. Measurements of serum free cortisol in critically ill patients. N Engl J Med. 2004;350(16):1629-1638. doi:10.1056/NEJMoa020266.
55. Meyer EJ, Torpy DJ, Chernykh A, et al. Pyrexia and acidosis act independently of neutrophil elastase reactive center loop cleavage to effect cortisol release from corticosteroid-binding globulin. Protein Sci. 2020;29(12):2495-2509. doi:10.1002/pro.3982.
56. Nenke MA, Rankin W, Chapman MJ, et al. Depletion of high-affinity corticosteroid-binding globulin corresponds to illness severity in sepsis and septic shock; clinical implications. Clin Endocrinol (Oxf) 2015;82(6):801-807. doi:10.1111/cen.12680.
57. Meyer EJ, Nenke MA, Davies ML, et al. Corticosteroid-binding globulin deficiency independently predicts mortality in septic shock. J Clin Endocrinol Metab. 2022;107(6):1636-1646. doi:10.1210/clinem/dgac035
58. Boonen E, Meersseman P, Vervenne H, et al. Reduced nocturnal ACTH-driven cortisol secretion during critical illness. Am J Physiol Endocrinol Metab. 2014;306(8):E883-E892. doi:10.1152/ajpendo.00009.2014.
59. Beishuizen A, Thijs LG, Vermes I. Decreased levels of dehydroepiandrosterone sulphate in severe critical illness: a sign of exhausted adrenal reserve? Crit Care. 2002;6(5):434-438. doi:10.1186/cc1530.
60. Arlt W, Hammer F, Sanning P, et al. Dissociation of serum dehydroepiandrosterone and dehydroepiandrosterone sulfate in septic shock. J Clin Endocrinol Metab. 2006;91(7):2548-2554. doi:10.1210/jc.2005-2258.
61. Marx C, Petros S, Bornstein SR, et al. Adrenocortical hormones in survivors and nonsurvivors of severe sepsis: diverse time course of dehydroepiandrosterone, dehydroepiandrosterone-sulfate, and cortisol. Crit Care Med. 2003;31(5):1382-1388. doi:10.1097/01.CCM.0000063282.83188.3D.
62. Tsai MH, Huang HC, Peng YS, et al. Dehydroepiandrosterone sulfate and dehydroepiandrosterone sulfate/cortisol ratio in cirrhotic patients with septic shock: another sign of hepatoadrenal syndrome? Crit Care. 2017;21(1):214. doi:10.1186/s13054-017-1768-0.
63. Charlton M, Angulo P, Chalasani N, et al. Low circulating levels of dehydroepiandrosterone in histologically advanced nonalcoholic fatty liver disease. Hepatology 2008;47(2):484-492. doi:10.1002/hep.22063.
64. Dorin RI, Qiao ZG, Bouchonville M, Qualls CR, Schrader RM, Urban FK. Characterization of cortisol secretion rate in secondary adrenal insufficiency. J Endocr Soc. 2017;1(7):945-956. doi:10.1210/js.2017-00198.
65. Dorin RI, Qualls CR, Torpy DJ, Schrader RM, Urban FK. Reversible increase in maximal cortisol secretion rate in septic shock. Crit Care Med. 2015;43(3):549-556. doi:10.1097/CCM.0000000000000721.
66. Dorin RI, Qiao Z, Qualls CR, Urban FK. Estimation of maximal cortisol secretion rate in healthy humans. J Clin Endocrinol Metab. 2012;97(4):1285-1293. doi:10.1210/jc.2011-2227.
67. Fede G, Spadaro L, Tomaselli T, Privitera G, Scicali R, Vasianopoulou P, et al. Comparison of total cortisol, free cortisol, and surrogate markers of free cortisol in diagnosis of adrenal insufficiency in patients with stable cirrhosis. Clin Gastroenterol Hepatol. 2014;12(3):504-12.e8; quiz e23.e8; quiz e23-4. doi:10.1016/j.cgh.2013.08.028
68. Thevenot T, Borot S, Remy-Martin A, et al. Assessment of adrenal function in cirrhotic patients using concentration of serum-free and salivary cortisol. Liver Int. 2011;31(3):425-433. doi:10.1111/j.1478-3231.2010.02431.x.
69. Coolens JL, Van Baelen H, Heyns W. Clinical use of unbound plasma cortisol as calculated from total cortisol and corticosteroid-binding globulin. J Steroid Biochem. 1987;26(2):197-202. doi:10.1016/0022-4731(87)90071-9.
70. Galbois A, Rudler M, Massard J, et al. Assessment of adrenal function in cirrhotic patients: salivary cortisol should be preferred. J Hepatol. 2010;52(6):839-845. doi:10.1016/j.jhep.2010.01.026.
71. Albert L, Profitós J, Sánchez-Delgado J, et al. Salivary cortisol determination in ACTH Stimulation test to diagnose adrenal insufficiency in patients with liver cirrhosis. Int J Endocrinol 2019;2019:7251010. doi:10.1155/2019/7251010.
72. Thevenot T, Dorin R, Monnet E, et al. High serum levels of free cortisol indicate severity of cirrhosis in hemodynamically stable patients. J Gastroenterol Hepatol. 2012;27(10):1596-1601. doi:10.1111/j.1440-1746.2012.07188.x.
73. Graupera I, Pavel O, Hernandez-Gea V, et al. Relative adrenal insufficiency in severe acute variceal and non-variceal bleeding: influence on outcomes. Liver Int. 2015;35(8):1964-1973. doi:10.1111/liv.12788.
74. Kim G, Huh JH, Lee KJ, Kim MY, Shim KY, Baik SK. Relative adrenal insufficiency in patients with cirrhosis: a systematic review and meta-analysis. Dig Dis Sci. 2017;62(4):1067-1079. doi:10.1007/s10620-017-4471-8.
75. Chiriac S, Stanciu C, Negru R, Trifan A. Assessment of adrenocortical dysfunction in patients with stable liver cirrhosis. Acta Endocrinol (Buchar) 2016;12(3):262-267. doi:10.4183/aeb.2016.262.
76. Munro V, Elnenaei M, Doucette S, Clarke DB, Imran SA. The effect of time of day testing and utility of 30 and 60 minute cortisol values in the 250 mcg ACTH stimulation test. Clin Biochem. 2018;54:37-41. doi:10.1016/j.clinbiochem.2018.02.010.
77. Sayyed Kassem L, El Sibai K, Chaiban J, Abdelmannan D, Arafah BM. Measurements of serum DHEA and DHEA sulphate levels improve the accuracy of the low-dose cosyntropin test in the diagnosis of central adrenal insufficiency. J Clin Endocrinol Metab. 2012;97(10):3655-3662. doi:10.1210/jc.2012-1806.
78. Evans L, Rhodes A, Alhazzani W, et al. Surviving Sepsis Campaign: international guidelines for management of sepsis and septic shock 2021. Crit Care Med. 2021;49(11):e1063-e1143. doi:10.1097/CCM.0000000000005337.
79. El-Farhan N, Rees DA, Evans C. Measuring cortisol in serum, urine and saliva – are our assays good enough? Ann Clin Biochem. 2017;54(3):308-322. doi:10.1177/0004563216687335.
80. McCann VJ, Fulton TT. Cortisol metabolism in chronic liver disease. J Clin Endocrinol Metab. 1975;40(6):1038-1044. doi:10.1210/jcem-40-6-1038.
81. Hasenmajer V, Sbardella E, Sciarra F, Minnetti M, Isidori AM, Venneri MA. The immune system in Cushing’s syndrome. Trends Endocrinol Metab. 2020;31(9):655-669. doi:10.1016/j.tem.2020.04.004.
82. Koch A, Tacke F. Variceal bleeding in liver cirrhosis at the ICU: sufficient data to treat adrenal insufficiency? Crit Care Med. 2014;42(12):2639-2640. doi:10.1097/CCM.0000000000000598.
83. Swain MG, Jones DEJ. Fatigue in chronic liver disease: new insights and therapeutic approaches. Liver Int. 2019;39(1):6-19. doi:10.1111/liv.13919.
© The Author(s) 2022. Published by Oxford University Press on behalf of the Endocrine Society.

BÌNH LUẬN