Rung nhĩ (AF) là chứng rối loạn nhịp tim được điều trị phổ biến nhất. AF thường liên quan đến nhịp thất không đều và không có sóng P riêng biệt. Chủ đề này sẽ cung cấp một cái nhìn tổng quan rộng rãi về phân loại, biểu hiện lâm sàng, chẩn đoán, quản lý và di chứng của AF, bao gồm cả AF mới khởi phát.
Tác giả: Kapil Kumar, MD; Dịch: Bs Lê Đình Sáng. Nguồn Uptodate, cập nhật đến 01 tháng 2 năm 2024
PHÂN LOẠI VÀ THUẬT NGỮ
AF có thể được phân loại theo thời gian và độ dài của các giai đoạn; những điều này đã được mô tả trong hướng dẫn của Hiệp hội Tim mạch Hoa Kỳ/Trường môn Tim mạch Hoa Kỳ/Hiệp hội Nhịp tim Hoa Kỳ năm 2014 về quản lý AF [1].
●AF kịch phát (tức là tự chấm dứt hoặc ngắt quãng) – AF kịch phát được định nghĩa là AF chấm dứt một cách tự nhiên hoặc có sự can thiệp trong vòng bảy ngày kể từ ngày khởi phát. Các cơn có thể tái diễn với tần suất thay đổi.
●AF dai dẳng – AF dai dẳng được định nghĩa là AF không tự chấm dứt trong vòng bảy ngày. Các giai đoạn thường cần chuyển nhịp bằng thuốc hoặc điện để khôi phục nhịp xoang. Trong khi bệnh nhân có AF dai dẳng có thể có các đợt AF kịch phát muộn hơn, AF thường được coi là một bệnh tiến triển.
●AF dai dẳng kéo dài – AF dai dẳng kéo dài đề cập đến AF kéo dài hơn 12 tháng.
●AF vĩnh viễn – AF vĩnh viễn là thuật ngữ được sử dụng để xác định AF dai dẳng mà bệnh nhân và bác sĩ lâm sàng đã đưa ra quyết định chung là không còn theo đuổi chiến lược kiểm soát nhịp nữa. Việc chấp nhận AF dai dẳng có thể thay đổi khi các triệu chứng, lựa chọn điều trị và sở thích của bệnh nhân và bác sĩ lâm sàng tiến triển [1].
Trong khi AF thường tiến triển từ trạng thái kịch phát đến trạng thái dai dẳng, bệnh nhân có thể biểu hiện cả hai loại trong suốt cuộc đời.
AF cũng có thể được phân loại dựa trên cách nó biểu hiện hoặc tình trạng van tim cụ thể hiện diện hay không:
●AF cận lâm sàng hoặc tiềm ẩn – Điều này đề cập đến AF phần lớn không có triệu chứng và chỉ trở nên rõ ràng trong bối cảnh xảy ra biến cố huyết khối tắc mạch, đợt cấp của suy tim cấp, bệnh nội khoa khác hoặc khi thực hiện điện tâm đồ định kỳ (ECG) cho các mục đích khác.
Sàng lọc AF được thảo luận riêng. (Xem phần ‘Sàng lọc’ bên dưới.)
●AF van tim – Điều này đề cập đến những bệnh nhân bị hẹp van hai lá từ trung bình đến nặng; những bệnh nhân này có nguy cơ đột quỵ cao hơn những bệnh nhân không mắc bệnh này.
●AF đơn độc – Thuật ngữ “AF đơn độc” là một thuật ngữ lịch sử hiện không được ưa chuộng vì nó có thể gây nhầm lẫn và không cải thiện việc chăm sóc bệnh nhân [1,2]. Thuật ngữ AF đơn độc đã được sử dụng để mô tả AF ở những bệnh nhân trẻ tuổi (ví dụ, ≤60 tuổi) có AF kịch phát, dai dẳng hoặc vĩnh viễn không có bệnh tim cấu trúc hoặc các yếu tố nguy cơ tim mạch. Những đặc điểm này xác định một nhóm cá nhân có điểm CHA 2 DS 2 -VASc là “0” và những người có nguy cơ thuyên tắc huyết khối do AF thấp nhất.
SÀNG LỌC
Hiện tại chúng tôi không sàng lọc bệnh nhân AF không có triệu chứng. Trong dân số nói chung và ở những người > 65 tuổi, việc sàng lọc chưa được chứng minh là tốt hơn chăm sóc thông thường (ví dụ, bắt mạch khi khám thực thể) để phát hiện AF. Hơn nữa, sàng lọc cho thấy mức độ khiêm tốn hoặc không có lợi ích trong việc giảm kết cục tim mạch và tử vong ở một trong hai nghiên cứu ngẫu nhiên. Việc sàng lọc có thể mang lại hiệu quả chống đông máu nhiều hơn, nhưng điều này chưa được chứng minh là có liên quan đến khả năng bảo vệ mạnh mẽ khỏi đột quỵ hoặc các biến cố huyết khối [3-5]. Lực lượng Đặc nhiệm Dịch vụ Phòng ngừa Hoa Kỳ (USPSTF) cũng không khuyến nghị sàng lọc AF.
●Ảnh hưởng đến kết quả tim mạch và tử vong – Hai nghiên cứu ngẫu nhiên về sàng lọc AF (với ECG đơn chuyển đạo hoặc thiết bị ghi lặp cấy ghép) chỉ cho thấy sự giảm nhẹ hoặc không giảm các biến cố lâm sàng và cũng bị hạn chế ở chỗ chúng bao gồm một nhóm bệnh nhân hẹp có thể không thể khái quát hóa một cách rộng rãi.
Một nghiên cứu nhóm song song, ngẫu nhiên, không được che giấu ở Thụy Điển (STROKESTOP) gồm 28.768 cá nhân từ 75 đến 76 tuổi đã so sánh kết quả (tức là sự kết hợp của đột quỵ do thiếu máu cục bộ hoặc xuất huyết, tắc mạch hệ thống, xuất huyết dẫn đến nhập viện và tử vong do mọi nguyên nhân) ở bệnh nhân những người đã trải qua sàng lọc ECG ngắt quãng trong hai tuần với chiến lược chống đông máu tiếp theo so với những người được chăm sóc thông thường [3]. Sau thời gian theo dõi trung bình là 6,9 năm, kết quả xảy ra ở nhóm can thiệp ít hơn một chút so với nhóm đối chứng (5,45 so với 5,68 biến cố trong 100 năm; tỷ lệ nguy cơ [HR] 0,96; KTC 95% 0,92-1,00), nhưng nhìn chung nguy cơ và lợi ích tuyệt đối là rất thấp. Tuy nhiên, mặc dù mức giảm nguy cơ tuyệt đối thấp, một phân tích sử dụng mô hình Markov dựa trên nghiên cứu STROKETOP cho thấy rằng việc sàng lọc AF ở nhóm người lớn tuổi này vẫn có thể hiệu quả về mặt chi phí và thậm chí có thể tiết kiệm chi phí [6].
Trong nghiên cứu LOOP, 6004 cá nhân có các yếu tố nguy cơ đột quỵ được phân ngẫu nhiên vào nhóm theo dõi máy ghi vòng lặp cấy ghép (còn gọi là máy theo dõi nhịp tim cấy ghép) hoặc chăm sóc thông thường [4]. Những người trong nhóm máy ghi vòng lặp cấy ghép có tỷ lệ phát hiện AF và bắt đầu chống đông gấp ba lần nhưng không có thay đổi về tỷ lệ đột quỵ hoặc tắc mạch động mạch.
●Phát hiện AF – Dữ liệu được trộn lẫn về việc liệu sàng lọc AF có làm tăng số trường hợp AF mới được phát hiện hay không; tuy nhiên, lợi ích tiềm năng dường như là nhỏ nhất. Việc lựa chọn xét nghiệm được sử dụng để phát hiện AF và các đặc điểm dân số có thể ảnh hưởng đến các kết quả này.
Trong thử nghiệm VITAL-AF, 16 phòng khám chính được phân ngẫu nhiên vào sàng lọc AF bằng cách sử dụng ECG một đầu cầm tay (AliveCor KardiaMobile) trong quá trình đánh giá dấu hiệu sinh tồn hoặc chăm sóc thông thường [7]. Hơn 30.000 bệnh nhân ≥65 tuổi được theo dõi trong một năm để phát hiện rung nhĩ mới khởi phát. Chẩn đoán AF mới ở nhóm sàng lọc và nhóm đối chứng là tương tự nhau (1,72 so với 1,59%). Trong một phân tích phân nhóm được xác định trước ở những người ≥85 tuổi, các chẩn đoán AF mới thường xuyên hơn ở nhóm sàng lọc so với nhóm đối chứng (5,56 so với 3,76%).
Trong một phân tích tổng hợp của ba nghiên cứu ngẫu nhiên theo cụm (không bao gồm VITAL-AF), sàng lọc đã xác định được nhiều trường hợp AF hơn so với không sàng lọc khi sử dụng các phương pháp tiếp cận một lần (sờ nắn mạch, ECG và/hoặc theo dõi Holter [phạm vi chênh lệch nguy cơ tuyệt đối] 0,06 đến 0,60 điểm phần trăm; phạm vi nguy cơ tương đối 1,04 đến 1,58]). Tuy nhiên, sự khác biệt này là nhỏ và có ý nghĩa thống kê chỉ ở một trong các nghiên cứu trong phân tích tổng hợp [5].
Apple Watch kết hợp với ứng dụng iPhone đã được đánh giá ở hơn 400.000 cá nhân không có tiền sử AF [8]. Thông báo xung không đều đã được gửi tới 2161 người tham gia (0,52%). Trong số này, 450 người tham gia đã được gửi và trả lại một bản vá ECG và không bị loại trừ theo quy trình nghiên cứu. AF hiện diện ở 34% trong số 450 bệnh nhân. Trong số những người được thông báo về nhịp tim không đều trên đồng hồ khi đeo miếng vá, 84% phù hợp với AF. Nghiên cứu của Apple Watch không sử dụng tham chiếu tiêu chuẩn vàng của ECG 12 chuyển đạo được phân tích bởi hai bác sĩ tim mạch, điều này hạn chế việc giải thích độ chính xác của thiết bị để phát hiện AF.
●Độ chính xác của phương pháp phát hiện – Độ chính xác của các thử nghiệm phát hiện AF cụ thể đã được USPSTF xem xét [5]. Trong hầu hết các nghiên cứu, độ chính xác của xét nghiệm được đo dựa trên tham chiếu của ECG 12 chuyển đạo (được giải thích bởi hai bác sĩ tim mạch). Độ nhạy và độ đặc hiệu nhìn chung cao đối với máy đo huyết áp dao động và ECG đơn đạo trình. Máy theo dõi tim cấy ghép có độ nhạy cao hơn ECG và máy theo dõi bên ngoài [9].
ECG không có vẻ hiệu quả hơn việc sờ nắn mạch khi phát hiện AF. Một đánh giá của USPSTF về các thử nghiệm ngẫu nhiên và nghiên cứu quan sát (17 nghiên cứu và 135.300 bệnh nhân từ 65 tuổi trở lên) cho thấy việc sàng lọc hệ thống bằng ECG đã xác định được nhiều trường hợp AF hơn là không sàng lọc (tăng tuyệt đối từ 0,6 đến 2,8% trong 12 tháng) [10] . Tuy nhiên, sàng lọc có hệ thống bằng ECG không phát hiện được nhiều trường hợp hơn phương pháp tiếp cận có hệ thống bằng cách sờ nắn mạch.
●Làm phong phú quần thể được sàng lọc – Mặc dù tại thời điểm này không có đủ bằng chứng để sàng lọc AF ở quần thể rộng, việc tập trung nỗ lực sàng lọc vào những bệnh nhân có nguy cơ phát triển AF cao hơn đáng kể có thể hiệu quả hơn. Sử dụng điểm CHADS2-VASc có thể là điểm khởi đầu, nhưng điểm nguy cơ như điểm CHARGE-AF bắt nguồn từ các biến lâm sàng [11] hoặc điểm nguy cơ đa gen bắt nguồn từ xét nghiệm di truyền [12] có thể hiệu quả hơn.
BIỂU HIỆN LÂM SÀNG
Triệu chứng – AF có thể có hoặc không có các triệu chứng liên quan và phổ triệu chứng rất rộng và không đặc hiệu. Các triệu chứng điển hình bao gồm:
●Đánh trống ngực
●Nhịp tim nhanh
●Mệt mỏi
●Suy nhược
●Chóng mặt
●Choáng váng
●Giảm khả năng tập luyện
●Đi tiểu nhiều
●Khó thở nhẹ.
Một số bệnh nhân có triệu chứng nặng hơn. Chúng bao gồm những điều sau đây:
●Khó thở khi nghỉ ngơi
●Đau thắt ngực
●Ngất
●Các triệu chứng của đột quỵ hoặc biến cố tắc mạch hệ thống khác
●Các triệu chứng của suy tim (ví dụ, khó thở khi gắng sức, phù ngoại biên, tăng cân và cổ trướng)
Mức độ nghiêm trọng và mức độ của các triệu chứng bị ảnh hưởng bởi tình trạng tim tiềm ẩn của bệnh nhân, tuổi tác, sự hiện diện của bệnh tiểu đường [13,14], cũng như tốc độ và tính đều đặn của phản ứng tâm thất. Ví dụ, một nghiên cứu trên 2400 bệnh nhân AF cho thấy 420 bệnh nhân mắc bệnh tiểu đường cảm thấy ít triệu chứng liên quan đến AF hơn (ví dụ như đánh trống ngực, chóng mặt, không dung nạp khi tập thể dục [tỷ lệ chênh lệch 0,74; KTC 95% 0,59-0,92]), nhưng có chất lượng kém hơn. của cuộc sống (beta = -4,54; 95% CI -6,40 đến -2,68) so với những người không mắc bệnh tiểu đường [13]. Chất lượng cuộc sống được đo lường dựa trên Bảng câu hỏi 100 điểm về Chất lượng Cuộc sống-5 Kích thước của Châu Âu (EQ-5D).
Các tình huống thường gặp — Một chẩn đoán mới về AF có thể xuất phát từ một số tình huống lâm sàng được mô tả dưới đây:
●Tại thời điểm khám định kỳ, khi bệnh nhân phàn nàn về các triệu chứng có thể do rung nhĩ hoặc đang được đánh giá vì lý do khác và được phát hiện có mạch không đều.
●Trên ECG thu được vì những lý do khác như đánh giá trước phẫu thuật.
●Một bệnh nhân bị đột quỵ hoặc thuyên tắc huyết khối động mạch khác có thể được phát hiện mắc AF mà trước đó chưa được chẩn đoán [15]. Trong một số trường hợp, AF được phát hiện trong quá trình theo dõi mở rộng nhằm chẩn đoán nguyên nhân gây đột quỵ.
AF cận lâm sàng cũng có thể được phát hiện bằng máy theo dõi trong tim, cấy ghép hoặc đeo được [16]. AF cận lâm sàng thường xảy ra ở những người không có triệu chứng đặc trưng của AF và không được chẩn đoán trước. Hầu hết những người này sẽ có AF kịch phát. Một tuyên bố khoa học của Hiệp hội Tim mạch Hoa Kỳ về AF được phát hiện bằng thiết bị điện tử cấy ghép vào tim và cận lâm sàng đã được công bố vào năm 2019 [16].
Nghiên cứu ASSERT trên 2580 bệnh nhân (65 tuổi trở lên) sử dụng máy tạo nhịp tim hai buồng hoặc máy khử rung tim cấy ghép, tăng huyết áp và không có tiền sử AF cho thấy sau 3 tháng, AF cận lâm sàng được phát hiện ở khoảng 10% bệnh nhân [17]. AF lâm sàng phát triển ở khoảng 16% bệnh nhân AF cận lâm sàng.
Trong một nghiên cứu trên 590 cá nhân có yếu tố nguy cơ đột quỵ nhưng không có rung nhĩ được sàng lọc bằng máy ghi vòng lặp cấy ghép trong thời gian trung bình 40 tháng, 35% người tham gia được phát hiện mắc rung nhĩ [9].
●Trong quá trình theo dõi ECG bằng máy theo dõi lưu động 24 giờ vì lý do nào khác hoặc trong quá trình thẩm vấn thiết bị nhịp tim được cấy ghép.
●Trong thời gian nằm viện vì một lý do khác như nhiễm trùng, nhồi máu cơ tim gần đây, nhiễm độc giáp, tắc mạch phổi, bệnh phổi tắc nghẽn mạn tính, viêm cơ tim và viêm màng ngoài tim, cùng những lý do khác [18-21].
●Bệnh nhân nhập viện trong phòng chăm sóc đặc biệt có tỷ lệ mắc AF đặc biệt cao [22]. Trong một nghiên cứu trên 1423 bệnh nhân ở đơn vị chăm sóc đặc biệt, tỷ lệ mắc AF là 15,6% (95% CI 13,8-17,6), trong đó AF khởi phát mới là 13,3% (95% CI 11,5-15,1).
●Trong hoặc sau khi phẫu thuật tim hoặc không phải tim.
●Trong quá trình ghi từ thiết bị ghi mà bệnh nhân mua (ví dụ: Apple watch, AliveCor KardiaMobile, v.v.).
ĐÁNH GIÁ
Lịch sử và khám thực thể – Mô tả về bất kỳ triệu chứng liên quan nào nên bao gồm:
●Bắt đầu hoặc ngày phát hiện
●Các yếu tố thúc đẩy có thể xảy ra
●Tần suất và thời lượng
●Mức độ nghiêm trọng của các giai đoạn và triệu chứng
●Tính chất
●Hồ sơ y tế trước đây về bất kỳ rối loạn nhịp trên thất nào trước đó
Một phương pháp bán định lượng để phân loại các triệu chứng đã được phát triển, nhưng tiện ích lâm sàng của hệ thống đó vẫn chưa được chứng minh [23].
●Các tình trạng liên quan – Cần xác định rõ sự hiện diện và tình trạng của các tình trạng liên quan như bệnh tim mạch khác, bệnh mạch máu não, tiểu đường, tăng huyết áp, bệnh phổi tắc nghẽn mạn tính, ngưng thở khi ngủ do tắc nghẽn.
Cần đánh giá sự hiện diện của các nguyên nhân có thể khắc phục được (ví dụ: cường giáp, sử dụng rượu không lành mạnh).
●Khám thực thể – Việc kiểm tra thể chất nên tập trung vào hệ thống tim mạch và mọi tình trạng liên quan. Những phát hiện bất thường có thể thông báo cho nhà cung cấp dịch vụ chăm sóc sức khỏe về các tình trạng liên quan có thể góp phần vào sự khởi phát của AF và/hoặc ảnh hưởng đến mức độ nghiêm trọng. Các ví dụ bao gồm tiếng thổi ở tim hoặc nhịp tim bất thường cho thấy hẹp hoặc hở van hai lá hoặc động mạch chủ, bệnh cơ tim phì đại cũng như các dấu hiệu và triệu chứng của suy tim.
Trong quá trình AF với nhịp tim không đều, thường có sự thay đổi nhỏ về cường độ của tiếng tim đầu tiên. Không nghe được âm S4 và không có sóng “a” tĩnh mạch cảnh do mất co tâm nhĩ.
Thiếu hụt xung đỉnh-xuyên tâm thường được quan sát thấy ở bệnh nhân rung nhĩ. Khi đánh giá đồng thời nhịp tim của đỉnh tâm thất trái và nhịp tim, nhịp tim có thể thấp hơn nhịp tim đỉnh. Vì nhịp tim không đều nên một số cơn co thắt tâm thất sẽ xảy ra, trước đó là thời gian tâm trương ngắn hơn, trong đó có sự giảm đổ đầy thất trái. Điều này dẫn đến nhịp thất không đủ thể tích nhát bóp để truyền sóng áp lực đến cánh tay. Sự thay đổi trong chỉ số huyết áp ở vòng quấn cũng phổ biến trong quá trình AF do thay đổi nhịp từng nhịp và thay đổi về độ đổ đầy thất trái và thể tích nhát bóp. Thường cần phải đo huyết áp nhiều lần và tính trung bình các giá trị này để có được kết quả huyết áp chính xác hơn. Ngoài ra, máy đo huyết áp tự động có thể gặp khó khăn trong việc đo huyết áp chính xác trong quá trình AF, do đó nên kiểm tra huyết áp thủ công.
Điện tâm đồ — Đối với tất cả các bệnh nhân nghi ngờ rung nhĩ mới khởi phát, chúng tôi thu được ECG 12 chuyển đạo. Trên ECG có AF, không có sóng P rời rạc nhưng nhìn thấy sóng rung (f) nhanh, biên độ thấp, thay đổi liên tục. Nhịp thất nói chung không đều (không có kiểu lặp đi lặp lại), mặc dù rung nhĩ ít khi liên quan đến tần số thất đều. ECG ở bệnh nhân AF được mô tả chi tiết riêng biệt (Hình 1).
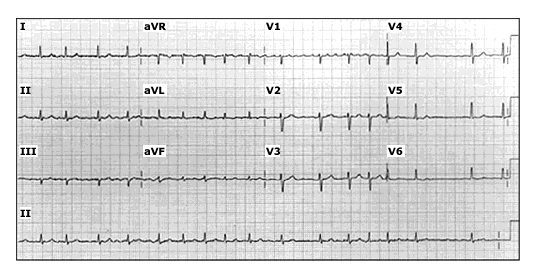
ECG 12 chuyển đạo cho thấy rung nhĩ. Phức hợp QRS hẹp, không có sóng P và đường cơ sở giữa các phức hợp QRS kế tiếp cho thấy các “sóng rung” thô không đều. Các phức hợp QRS xảy ra theo những khoảng thời gian không đều đặn.
Hình 1. ECG 12 chuyển đạo của rung nhĩ
Có một số cạm bẫy tiềm ẩn trong chẩn đoán ECG của AF. Các lỗi trong chẩn đoán AF đặc biệt phổ biến với giải thích ECG trên máy vi tính và ở những bệnh nhân có nhịp tim liên tục hoặc ngắt quãng. Do đó, điều quan trọng là việc diễn giải ECG tự động do máy cung cấp phải được xác nhận bởi người đọc có kỹ năng.
ECG cơ bản, tốt nhất là ở nhịp xoang, cũng cần được đánh giá với các thông tin sau:
●Các dấu hiệu của bệnh tim không do điện, chẳng hạn như phì đại thất trái (có thể tăng huyết áp) hoặc sóng Q (có thể là bệnh động mạch vành).
●Các dấu hiệu của bệnh tim điện, bao gồm sự hiện diện của bệnh tiền kích thích tâm thất hoặc bệnh dẫn truyền dưới nút (block nhánh).
●Khoảng QT (để xác định nguy cơ tiềm ẩn của liệu pháp chống loạn nhịp)
●Bằng chứng nhịp tim chậm nghiêm trọng hoặc rối loạn chức năng nút xoang
Siêu âm tim — Chúng tôi thu được siêu âm tim qua thành ngực (TTE) ngay cả khi kết quả khám thực thể là bình thường. Chúng tôi thu được TTE để đánh giá kích thước của tâm nhĩ phải và trái cũng như kích thước và chức năng tâm thu của tâm thất phải và trái; để phát hiện bệnh van tim có thể xảy ra, phì đại thất trái, rối loạn chức năng tâm trương và bệnh màng ngoài tim; và để đánh giá áp lực đỉnh thất phải và tâm nhĩ phải. TTE cũng có thể xác định huyết khối nhĩ trái, mặc dù độ nhạy thấp. Siêu âm tim qua thực quản nhạy hơn nhiều trong việc xác định huyết khối ở nhĩ trái hoặc phần phụ nhĩ trái và có thể được sử dụng để xác định nhu cầu dùng thuốc chống đông trước bất kỳ nỗ lực chuyển nhịp bằng thuốc hoặc điện nào.
Xét nghiệm tim bổ sung – Chúng tôi giới thiệu những bệnh nhân có dấu hiệu hoặc triệu chứng của bệnh tim thiếu máu cục bộ để thực hiện xét nghiệm gắng sức.
Test gắng sức rất hữu ích để giúp hướng dẫn điều trị bằng thuốc cho AF, vì một số thuốc chống loạn nhịp bị chống chỉ định ở bệnh nhân mắc bệnh động mạch vành.
Có thể sử dụng máy theo dõi tim cấp cứu bằng máy ghi sự kiện, máy theo dõi sự kiện trong thời gian kéo dài bằng keo hoặc máy theo dõi tim có thể lắp vào (đôi khi còn được gọi là máy theo dõi tim cấy ghép hoặc máy ghi vòng lặp cấy ghép) để xác định chứng loạn nhịp tim nếu nó không liên tục và không ghi được trên ECG thông thường. Theo dõi ECG cấp cứu cũng có thể được sử dụng để liên hệ các triệu chứng với rối loạn nhịp tim cùng với việc đánh giá gánh nặng AF. Theo dõi Holter từ 24 đến 48 giờ chủ yếu hỗ trợ đánh giá tỷ lệ đáp ứng thất tổng thể ở những cá nhân đã chọn chiến lược kiểm soát tần số và có lo ngại về việc kiểm soát nhịp tim hoặc nhịp tim chậm không đầy đủ.
Xét nghiệm thăm dò – Chúng tôi lấy công thức máu toàn phần, điện giải đồ trong huyết thanh và đánh giá chức năng thận, đặc biệt ở những bệnh nhân có thể bắt đầu dùng thuốc chống đông đường uống không chứa vitamin. Chúng tôi không yêu cầu troponin trừ khi nghi ngờ thiếu máu cục bộ cấp tính. Bệnh cường giáp lâm sàng hoặc cận lâm sàng xuất hiện ở ít hơn 5% bệnh nhân mắc AF [24]. Nên đo nồng độ hormone kích thích tuyến giáp và nồng độ T4 tự do ở tất cả các bệnh nhân có giai đoạn AF đầu tiên hoặc ở những người có tần số AF tăng lên.
Các xét nghiệm cơ bản quan trọng khác bao gồm công thức máu toàn phần để đánh giá tình trạng thiếu máu tiềm ẩn hoặc dấu hiệu nhiễm trùng và đánh giá bệnh đái tháo đường [25].
Các xét nghiệm khác – Chụp X quang ngực có thể là xét nghiệm chẩn đoán hữu ích ở những bệnh nhân được chọn có bằng chứng khó thở và suy tim tiềm ẩn hoặc nguy cơ viêm phổi.
QUẢN LÝ BAN ĐẦU
Một khuôn khổ hữu ích cho việc chăm sóc chung cho bệnh nhân AF (bao gồm cả những người mắc AF mới khởi phát cũng như AF lâu năm) là lộ trình ABC (Chăm sóc tốt hơn cho chứng rung nhĩ) [26,27].
●“A” có thể được xem xét cho thuốc chống đông máu
●“B” để quản lý triệu chứng tốt hơn
●“C” để đánh giá và quản lý yếu tố nguy cơ tim mạch và bệnh đi kèm.
Các nghiên cứu quan sát [28,29], phân tích hậu kiểm của thử nghiệm AFFIRM [30] và thử nghiệm ngẫu nhiên trong tương lai sử dụng ứng dụng di động [31] gợi ý rằng việc triển khai khuôn khổ chăm sóc như vậy cho bệnh nhân AF có thể có tác dụng tích cực tác động lên các biến cố tim mạch bất lợi và nhập viện, đồng thời tiết kiệm chi phí cho các hệ thống chăm sóc sức khỏe [32].
BỐI CẢNH QUẢN LÝ
●Khoa ngoại trú so với khoa cấp cứu – Trong khi hầu hết bệnh nhân mắc chứng AF mới được chẩn đoán thường có thể được quản lý ở cơ sở ngoại trú, một số bệnh nhân không ổn định cần phải nhập viện trực tiếp hoặc chuyển đến khoa cấp cứu từ cơ sở ngoại trú. Các chỉ định chuyển đến cơ sở có dịch vụ cấp cứu bao gồm:
•Huyết động không ổn định và/hoặc sốc (biểu hiện bằng hạ huyết áp, lú lẫn, tổn thương thận cấp tính, v.v.).
•Nghi ngờ hoặc xác nhận thiếu máu cục bộ/nhồi máu cơ tim.
•Nghi ngờ hoặc xác nhận suy tim.
•Bằng chứng về kích thích sớm (ví dụ hội chứng Wolff-Parkinson-White) trên ECG.
•Nhịp tim nhanh cực độ, không kiểm soát được.
•Các triệu chứng nghiêm trọng có thể cần kiểm soát tần số hoặc nhịp điệu khẩn cấp hơn.
•Hạ huyết áp mà rung nhĩ được nghi ngờ là nguyên nhân hoặc góp phần và điều trị tiêu chuẩn để điều trị nguyên nhân cơ bản và hạ huyết áp đã thất bại. Phải cẩn thận với các yếu tố có khả năng kích thích khác như nhiễm trùng huyết, giảm thể tích dịch hoặc giãn mạch.
Đối với những bệnh nhân có rung nhĩ được cho là thứ phát do bệnh đi kèm ban đầu như viêm phổi, việc điều trị nguyên nhân cơ bản của rung nhĩ là quan trọng và có thể làm giảm nguy cơ tái phát rung nhĩ về lâu dài.
Cuối cùng, đối với những bệnh nhân cần xử lý khẩn cấp, chúng tôi thường nhận được các xét nghiệm chẩn đoán cơ bản giống như ở những bệnh nhân ổn định trừ khi các đặc điểm lâm sàng khác gợi ý khác. Trong trường hợp này, phương pháp chẩn đoán cũng nên bao gồm việc xử lý các tình trạng nghi ngờ tiềm ẩn (ví dụ: viêm phổi, tắc mạch phổi, v.v.).
●Chỉ định nhập viện – Nhiều bệnh nhân AF mới khởi phát được đánh giá tại phòng cấp cứu có thể không cần phải nhập viện. Tuy nhiên, chỉ định nhập viện ở những bệnh nhân này bao gồm:
•Những bệnh nhân đang được xem xét triệt phá đường phụ, đặc biệt nếu AF có triệu chứng cao và liên quan đến trụy tim mạch và tốc độ đáp ứng thất nhanh.
•Nhịp tim chậm nghiêm trọng hoặc các khoảng dừng kéo dài, kể cả sau khi chuyển nhịp.
•Điều trị một vấn đề y tế liên quan, thường là nguyên nhân gây rối loạn nhịp tim (ví dụ: tăng huyết áp, nhiễm trùng, đợt cấp của bệnh phổi tắc nghẽn mạn tính, tắc mạch phổi, viêm màng ngoài tim, thiếu máu cơ tim dai dẳng). Cần lưu ý rằng rung nhĩ đơn thuần không phải là dấu hiệu để loại trừ nhồi máu cơ tim.
•Kiểm soát thêm suy tim hoặc hạ huyết áp sau khi kiểm soát được nhịp hoặc nhịp.
•Bắt đầu điều trị bằng thuốc chống loạn nhịp (nếu bệnh nhân và đặc điểm của thuốc cần phải nhập viện).
•Nhịp thất khó kiểm soát với bằng chứng thiếu máu cục bộ, các triệu chứng hoặc dấu hiệu suy tim sung huyết và các triệu chứng nghiêm trọng là dấu hiệu cần phải nhập viện ít nhất 24 giờ.
● Hội chẩn bác sĩ tim mạch – AF là một vấn đề y tế phổ biến và thường có thể được các bác sĩ chăm sóc chính quản lý mà không cần tham khảo ý kiến của bác sĩ tim mạch. Chúng tôi đề nghị giới thiệu bệnh nhân khi bác sĩ không thoải mái với việc ra quyết định hoặc khi việc triệt phá AF qua catheter đang được xem xét. Ngoài ra, khi cân nhắc sử dụng thuốc chuyển nhịp hoặc thuốc chống loạn nhịp, việc tư vấn về tim mạch là có lợi.
Chống đông máu — Mỗi bệnh nhân rung nhĩ nên được đánh giá về nhu cầu điều trị chống huyết khối để ngăn ngừa thuyên tắc hệ thống ngay cả trong giai đoạn rung nhĩ đầu tiên. Điều này được thực hiện bằng cách sử dụng hệ thống tính điểm nguy cơ đối với đột quỵ xảy ra được gọi là điểm CHA 2 DS 2 -VASc (bảng 1). Các yếu tố khác có thể cải thiện dự đoán nguy cơ đột quỵ cho từng bệnh nhân mắc gánh nặng rung nhĩ bao gồm kích thước và chức năng nhĩ trái và một số dấu ấn sinh học nhất định (ví dụ NT-proBNP và troponin-T có độ nhạy cao) [33]. Những bệnh nhân cần điều trị chống huyết khối bao gồm những người đang được xem xét chuyển nhịp (dù bằng điện hay bằng thuốc) theo nhịp xoang (bất kể điểm CHA 2 DS 2 -VASc hay phương pháp chuyển nhịp [điện hoặc dược lý]) và những người đáp ứng các tiêu chí trong thời gian dài. – chống đông máu lâu dài. Tất cả các bệnh nhân có nguy cơ tắc mạch vượt quá nguy cơ xuất huyết đều có thể điều trị chống huyết khối lâu dài.
Bảng 1. Các yếu tố nguy cơ lâm sàng đối với đột quỵ, cơn thiếu máu não thoáng qua và thuyên tắc hệ thống theo thang điểm CHA 2 DS 2 -VASc
| (A) Cách tiếp cận dựa trên yếu tố rủi ro được thể hiện dưới dạng hệ thống tính điểm dựa trên điểm, với từ viết tắt CHA 2 DS 2 -VASc (LƯU Ý: điểm tối đa là 9 vì độ tuổi có thể đóng góp 0, 1 hoặc 2 điểm) |
||
| CHA 2 DS 2 -VASc yếu tố nguy cơ | Điểm | |
| Suy tim sung huyết
Dấu hiệu/triệu chứng của suy tim hoặc bằng chứng khách quan của việc giảm phân suất tống máu thất trái |
+1 | |
| Tăng huyết áp
Huyết áp lúc nghỉ >140/90 mmHg ít nhất 2 lần hoặc đang điều trị hạ huyết áp |
+1 | |
| Từ 75 tuổi trở lên | +2 | |
| Đái tháo đường
Đường huyết lúc đói >125 mg/dL (7 mmol/L) hoặc điều trị bằng thuốc hạ đường huyết đường uống và/hoặc insulin |
+1 | |
| Đột quỵ trước đó, cơn thiếu máu não thoáng qua hoặc thuyên tắc huyết khối | +2 | |
| Bệnh đường máu
Nhồi máu cơ tim trước đây, bệnh động mạch ngoại biên hoặc mảng bám động mạch chủ |
+1 | |
| Tuổi 65 đến 74 | +1 | |
| Giới tính (nữ) | +1 | |
| (B) Tỷ lệ hành trình được điều chỉnh theo điểm CHA 2 DS 2 -VASc | ||
| CHA 2 DS 2 -VASc điểm | Bệnh nhân (n=73.538) |
Tỷ lệ biến cố đột quỵ và thuyên tắc huyết khối sau 1 năm theo dõi (%) |
| 0 | 6369 | 0,78 |
| 1 | 8203 | 2,01 |
| 2 | 12.771 | 3,71 |
| 3 | 17.371 | 5,92 |
| 4 | 13,887 | 9,27 |
| 5 | 8942 | 15,26 |
| 6 | 4244 | 19,74 |
| 7 | 1420 | 21:50 |
| số 8 | 285 | 22,38 |
| 9 | 46 | 23,64 |
Nguyên nhân — Trong một số trường hợp, khởi phát AF được kích hoạt bởi một chẩn đoán y tế cấp tính khác: cường giáp, tắc mạch phổi cấp tính, viêm cơ tim, viêm phổi, sau phẫu thuật tim và một số loại thuốc hoặc chất bổ sung. Điều trị các tác nhân kích thích cụ thể hoặc loại bỏ các yếu tố kích động có thể dẫn đến nhiều năm hoặc thậm chí suốt đời mà không có các đợt rung nhĩ tiếp theo.
Việc điều trị nguyên nhân nghi ngờ thúc đẩy có thể dẫn đến sự đảo ngược nhịp xoang.
Đối với những bệnh nhân cường giáp nặng, mục tiêu chính của điều trị ban đầu là kiểm soát nhịp tim, chống đông máu, điều trị cường giáp và phục hồi nhịp xoang khi họ bình giáp.
Điều trị AF ở bệnh nhân suy tim và/hoặc bệnh phổi tắc nghẽn mạn tính nói chung nên được thực hiện đồng thời với điều trị tình trạng khác của họ.
Các yếu tố nguy cơ tim mạch – Xác định và điều trị các yếu tố nguy cơ và bệnh đi kèm có thể giúp giảm bớt các triệu chứng và gánh nặng của AF. Các yếu tố nguy cơ phổ biến và bệnh đi kèm có thể dẫn đến sự phát triển của AF bao gồm tuổi cao, tăng huyết áp, tiểu đường, ngưng thở khi ngủ do tắc nghẽn, suy tim và béo phì. Đối với hầu hết các yếu tố nguy cơ được xác định, chúng tôi tin rằng việc điều trị yếu tố nguy cơ có thể làm giảm nhưng không loại trừ khả năng xảy ra các đợt AF tiếp theo. Mô tả toàn diện về các yếu tố nguy cơ đối với AF sẽ được thảo luận riêng.
Quản lý triệu chứng và huyết động
Bệnh nhân không ổn định – Ở một số bệnh nhân huyết động không ổn định có biểu hiện các dấu hiệu hoặc triệu chứng như hạ huyết áp, thay đổi trạng thái tâm thần hoặc suy tim, chúng tôi cố gắng kiểm soát nhịp thất. Làm chậm nhịp thất đôi khi sẽ dẫn đến sự đảo ngược tự phát về nhịp xoang. Kiểm soát tần số thường được thực hiện bằng thuốc chẹn beta hoặc thuốc chẹn kênh canxi (verapamil hoặc diltiazem).
Đối với bệnh nhân rung nhĩ và suy tim, chiến lược kiểm soát tần số thất sẽ được thảo luận riêng.
Nếu bệnh nhân vẫn không ổn định về huyết động, nên thực hiện chuyển nhịp khẩn cấp, đặc biệt nếu tổn thương huyết động là do nhịp thất nhanh không kiểm soát được và/hoặc chúng tôi tin rằng việc thiếu co bóp tâm nhĩ đang làm giảm cung lượng tim. Liệu pháp cấp cứu với kiểm soát tần số và/hoặc chuyển nhịp cho bệnh nhân không ổn định sẽ được thảo luận riêng.
Trừ khi AF quay trở lại một cách tự nhiên, quyết định sẽ được đưa ra liệu có thực hiện chuyển nhịp, khi nào và như thế nào hay không. Quản lý nguy cơ thuyên tắc huyết khối là vấn đề quan trọng cần cân nhắc khi cân nhắc chuyển nhịp.
Nếu chúng tôi quyết định thực hiện chuyển nhịp khẩn cấp, nguy cơ xảy ra biến cố huyết khối cần phải được xem xét. Hầu hết các bệnh nhân chuyển nhịp nên được điều trị chống đông ngay khi có quyết định chuyển nhịp hoặc sau khi đánh giá nguy cơ thuyên tắc huyết khối trên lâm sàng dựa trên điểm CHA 2 DS 2 -VASc. Các vấn đề liên quan đến chống đông máu xung quanh thời điểm chuyển nhịp sẽ được thảo luận chi tiết một cách riêng biệt.
Một khi bệnh nhân trở nên ổn định về mặt huyết động, phần còn lại của việc xử lý cấp tính và lâu dài cũng tương tự như đối với những bệnh nhân ổn định.
Bệnh nhân ổn định — Đối với những bệnh nhân ổn định có rung nhĩ mới khởi phát không đáp ứng các tiêu chí trên để xử lý cấp cứu và những người mà chúng tôi đã thực hiện đánh giá, chúng tôi cố gắng thực hiện những điều sau trong môi trường ngoại trú:
●Đánh giá sự cần thiết phải làm chậm nhịp thất.
●Thảo luận về nhu cầu chuyển nhịp với bệnh nhân. Nếu bệnh nhân có nhiều triệu chứng hoặc nếu có rung nhĩ mới khởi phát ngay cả khi không có triệu chứng, chúng tôi thường thử chuyển nhịp. Trong số những bệnh nhân có AF mới khởi phát, ngay cả khi dự tính chuyển nhịp, nó thường không cần phải thực hiện khẩn cấp; phần lớn những bệnh nhân này sẽ tự động chuyển sang nhịp xoang trong vòng 48 đến 72 giờ [34]. Trong số 1822 bệnh nhân nhập viện vì rung nhĩ, 356 bệnh nhân có thời gian rối loạn nhịp tim dưới 72 giờ. Sáu mươi tám phần trăm bệnh nhân có thời gian AF ngắn này tự động trở lại nhịp xoang [34]. Hai phần ba số người có sự đảo ngược tự phát có thời gian AF dưới 24 giờ; Thời gian AF dưới 24 giờ là yếu tố dự đoán duy nhất về sự đảo ngược tự phát.
Việc lựa chọn chuyển nhịp bằng điện hoặc thuốc đòi hỏi phải xem xét tính hiệu quả và an toàn của phương pháp này, các bệnh đi kèm, tính ổn định, sở thích của bệnh nhân và sự thoải mái của bác sĩ lâm sàng khi sử dụng phương pháp này hay phương pháp kia. Vấn đề này được thảo luận chi tiết ở nơi khác.
●Xác định nhu cầu điều trị chống đông máu cấp tính và lâu dài.
●Thảo luận về nguyên nhân (nếu biết) và diễn biến tự nhiên của AF.
●Hãy cân nhắc việc tư vấn với bác sĩ tim mạch. Các lý do cần tham khảo ý kiến bác sĩ tim mạch bao gồm nhu cầu chuyển nhịp hoặc nhu cầu điều trị bằng thuốc chống loạn nhịp hoặc cắt bỏ qua catheter.
●Lên lịch theo dõi. (Xem ‘Quản lý dài hạn’ bên dưới.)
QUẢN LÝ DÀI HẠN
Theo dõi sớm — Theo dõi sau một đợt AF cấp tính là cần thiết để đánh giá tính an toàn và hiệu quả của kiểm soát tần số hoặc nhịp, sự tuân thủ của bệnh nhân với liệu pháp chống đông máu và chống loạn nhịp, nhu cầu tiếp tục điều trị cho AF, để thảo luận về bất kỳ chiến lược nào để giảm AF tái phát và đánh giá tình trạng chức năng của bệnh nhân.
Đối với nhiều bệnh nhân, tái khám trong một tuần hoặc càng sớm càng tốt nếu một tuần không thực tế đối với một bệnh nhân cụ thể, là một chiến lược hợp lý. Việc quay lại sớm này đặc biệt quan trọng đối với những bệnh nhân bắt đầu điều trị bằng thuốc chống loạn nhịp để đánh giá tính an toàn, hiệu quả và các tác dụng phụ có thể đặc trưng cho liệu pháp của họ.
Phòng ngừa thuyên tắc huyết khối – Sau lần đầu sử dụng thuốc chống đông máu trước và sau chuyển nhịp, quyết định tiếp tục dùng thuốc chống đông dài hạn sau một biến cố có thể đảo ngược được vẫn còn gây tranh cãi, và quyết định này mang tính cá nhân hóa cao dựa trên nguy cơ AF tái phát được cho là trong tương lai ở cá nhân đó (so với CHA 2 DS 2 -VASc điểm). Cũng hợp lý khi thực hiện phương pháp quan sát sau nguyên nhân có thể đảo ngược của AF bao gồm theo dõi lâm sàng các triệu chứng và theo dõi cấp cứu để theo dõi khả năng tái phát.
●Ra quyết định chung về thuốc chống đông máu – Việc ra quyết định chung giữa bệnh nhân và nhà cung cấp bao gồm lợi ích so với nguy cơ của việc dùng thuốc chống đông máu và sự cân bằng giữa warfarin và DOAC; các nhà cung cấp cũng nên chuẩn bị sẵn sàng để giải quyết các thắc mắc của bệnh nhân về chi phí tự chi trả, vì nếu không làm như vậy có thể dẫn đến tổn hại cho bệnh nhân. Một nghiên cứu định tính gồm 37 cuộc gặp lâm sàng được ghi lại cho thấy các nhà cung cấp hiếm khi được chuẩn bị để giải quyết thỏa đáng các câu hỏi của bệnh nhân liên quan đến chi phí thuốc [35].
Trong số các bệnh nhân rung nhĩ, huyết khối ở phần phụ nhĩ trái là nguyên nhân chính gây ra huyết khối.
Một nhóm nhỏ bệnh nhân cần dùng thuốc chống đông dài hạn có thể không dùng được do nguy cơ chảy máu cao hoặc tuân thủ điều trị kém. Ở những bệnh nhân này, có thể xem xét tắc phần phụ nhĩ trái. Sau khi tắc phần phụ nhĩ trái, bệnh nhân được yêu cầu dùng thuốc chống đông ngắn hạn. Tắc phần phụ nhĩ trái được mô tả chi tiết riêng biệt.
AF tái phát — Các nghiên cứu theo dõi tim liên tục đã chỉ ra rằng khoảng 90% bệnh nhân AF có các đợt AF tái phát [36]. Tuy nhiên, có tới 90% các đợt bệnh không được bệnh nhân nhận ra [37], và các đợt không có triệu chứng kéo dài hơn 48 giờ thì không.
không phổ biến, xảy ra ở 17% bệnh nhân trong một nghiên cứu sử dụng theo dõi ECG liên tục để phát hiện AF [36]. Nghiên cứu thứ hai cũng cho thấy 40% bệnh nhân có các đợt triệu chứng giống AF khi không có AF.
Một số phương pháp để giảm tái phát và/hoặc gánh nặng AF bao gồm:
●Giảm rượu – Rượu là một yếu tố nguy cơ có thể thay đổi được đối với rung nhĩ, và trong số những người tiêu thụ quá nhiều rượu, việc giảm và kiêng rượu dường như làm giảm nguy cơ rung nhĩ tái phát và thời gian ở rung nhĩ.
Trong một nghiên cứu, 140 bệnh nhân có triệu chứng rung nhĩ kịch phát hoặc dai dẳng có nhịp xoang lúc ban đầu và uống 10 ly tiêu chuẩn trở lên mỗi tuần (khoảng 120 g rượu nguyên chất) được phân ngẫu nhiên vào nhóm kiêng rượu hoặc uống rượu thông thường [38] . Sau sáu tháng, bệnh nhân được theo dõi nhịp tim toàn diện.
Bệnh nhân được chỉ định kiêng cữ có:
•Họ giảm nhiều hơn lượng rượu tiêu thụ từ 16,8 xuống 2,1 ly tiêu chuẩn mỗi tuần, trong khi những người thuộc nhóm tiêu thụ thông thường giảm mức tiêu thụ từ 16,4 xuống 13,2 mỗi tuần.
•Tỷ lệ AF tái phát thấp hơn (53 so với 73 phần trăm của hai nhóm). Sự tái phát của AF cũng bị trì hoãn ở nhóm kiêng khem và gánh nặng AF thấp hơn đáng kể.
●Giảm cân và hoạt động thể chất – Trong số những bệnh nhân mắc AF, cả hai biện pháp này đều có thể dẫn đến việc tái cấu trúc tim khỏe mạnh [39] và giảm gánh nặng AF [39,40] và tử vong do tim mạch [41,42]:
•Trong một nghiên cứu, 150 bệnh nhân bị rung nhĩ có triệu chứng và chỉ số khối cơ thể ở mức thừa cân hoặc cao hơn (≥ 25 kg/m 2) được chọn ngẫu nhiên để can thiệp quản lý cân nặng hoặc tư vấn chung về lối sống [39]. Sau 15 tháng, những người tham gia được chỉ định can thiệp cho thấy cân nặng giảm nhiều hơn so với nhóm được tư vấn về lối sống chung (14,3 so với 3,6 kg). Nhóm can thiệp cũng giảm nhiều hơn gánh nặng triệu chứng AF (11,8 so với 2,6 điểm), điểm mức độ nghiêm trọng của triệu chứng (8,4 so với 1,7 điểm), số đợt AF (ít hơn 2,5 so với không thay đổi) và thời gian AF tích lũy (giảm 692 phút). so với mức tăng 419 phút). Các thông số tái tạo tim trên siêu âm tim cũng được cải thiện ở nhóm can thiệp so với nhóm đối chứng (tức là giảm độ dày vách liên thất [1,1 và 0,6 mm] và giảm diện tích nhĩ trái [3,5 và 1,9 cm 2]).
•Trong một nghiên cứu can thiệp không ngẫu nhiên, 149 bệnh nhân được triệt phá qua catheter để điều trị rung nhĩ có triệu chứng đã được cung cấp chương trình quản lý yếu tố nguy cơ tim mạch trong ba tháng [40]. Bệnh nhân có chỉ số khối cơ thể ≥27 kg/m2 cộng thêm ít nhất một yếu tố nguy cơ tim mạch. 61 bệnh nhân đã chọn can thiệp quản lý yếu tố nguy cơ và 88 bệnh nhân thì không (nhóm đối chứng). Khi theo dõi, những bệnh nhân chọn biện pháp can thiệp đã giảm cân, trong khi nhóm đối chứng tăng cân (-13,2 so với +1,5 kg). Nhóm can thiệp có mức giảm huyết áp tâm thu trung bình, trong khi nhóm đối chứng có huyết áp tăng (-34,1 so với 20,6). Việc kiểm soát rối loạn lipid máu ở nhóm can thiệp cao hơn so với nhóm đối chứng (46 so với 17%). Nhiều bệnh nhân trong nhóm đối chứng bị tái phát AF (32,9 so với 9,7%; tỷ lệ nguy cơ [HR] 2,6; CI 95%, 1,7-4,0) so với nhóm can thiệp.
•Trong số những bệnh nhân bị rung nhĩ, hoạt động thể chất có thể làm giảm tỷ lệ tử vong do tim mạch [41,42].
Kiểm soát tần số hoặc nhịp — Một khi đạt được kiểm soát tần số thất, nên đưa ra quyết định liên quan đến quản lý lâu dài (kiểm soát nhịp so với tần số) của AF; quyết định này phụ thuộc vào nhiều yếu tố. Những điều này sẽ được thảo luận chi tiết một cách riêng biệt.
Cần lưu ý những điểm sau đây bất kể chiến lược đã chọn:
●Cả hai chiến lược đều có thể thất bại trong ngắn hạn và dài hạn. Do đó, nhiều bệnh nhân cần được xem xét lại để có chiến lược thay thế khi diễn biến tự nhiên của bệnh tiến triển.
●Tất cả bệnh nhân rung nhĩ, bất kể chiến lược/nhịp tim được lựa chọn, nên được đánh giá nguy cơ huyết khối tắc mạch và quản lý phù hợp.
●Đối với những bệnh nhân được quản lý bằng chiến lược kiểm soát nhịp, việc kiểm soát tần số là cần thiết do khả năng tái phát AF.
Những ưu điểm và nhược điểm của việc kiểm soát nhịp và tần số, cũng như các phân nhóm bệnh nhân được ưu tiên sử dụng cái này hay cái kia, sẽ được thảo luận chi tiết hơn một cách riêng biệt.
Chiến lược kiểm soát nhịp sử dụng liệu pháp thuốc chống loạn nhịp, triệt phá qua catheter qua da và/hoặc thủ thuật phẫu thuật. Chuyển nhịp bằng điện có thể cần thiết để khôi phục nhịp xoang. Thuốc chống loạn nhịp thường được bắt đầu trước khi chuyển nhịp và tiếp tục duy trì nhịp xoang (trong trường hợp AF tái phát).
Trong số các bệnh nhân trải qua phẫu thuật tim vì một lý do khác (ví dụ, phẫu thuật van hai lá hoặc phẫu thuật bắc cầu động mạch vành), phẫu thuật cắt bỏ để kiểm soát AF kháng trị có thể được thực hiện trong cùng một quy trình. Một số kỹ thuật phẫu thuật đã được phát triển để kiểm soát AF kháng trị và duy trì nhịp xoang. Các thủ tục phẫu thuật này có vẻ hiệu quả trong việc loại bỏ hoặc giảm tần suất AF ở phần lớn bệnh nhân. Đối với những bệnh nhân có nguy cơ cao bị đột quỵ, vẫn tiếp tục dùng thuốc chống đông máu lâu dài. Điều này được thảo luận chi tiết một cách riêng biệt.
Chiến lược kiểm soát tần số thường sử dụng các thuốc làm chậm dẫn truyền qua nút nhĩ thất như thuốc chẹn beta, thuốc chẹn kênh canxi nondihydropyridine hoặc digoxin . Triệt phá điểm nối nhĩ thất với đặt máy điều hòa nhịp tim được sử dụng ở những bệnh nhân có nhịp tim nhanh dai dẳng, huyết động không ổn định và khả năng dung nạp kém và/hoặc AF có triệu chứng cao, ở những bệnh nhân này việc kiểm soát tần số không thành công. Những cách tiếp cận này để kiểm soát tần số thất ở AF được thảo luận chi tiết một cách riêng biệt.
Hầu hết bệnh nhân có biểu hiện rung nhĩ sẽ yêu cầu làm chậm nhịp thất để cải thiện triệu chứng.
Theo dõi lâu dài — Bệnh nhân bị rung nhĩ kịch phát, dai dẳng, dai dẳng hoặc vĩnh viễn sẽ cần được chăm sóc định kỳ và đánh giá khẩn cấp thường xuyên trong quá trình diễn biến tự nhiên của bệnh.
Chúng tôi đề nghị theo dõi định kỳ 12 tháng một lần ở những bệnh nhân ổn định và sớm hơn nếu có những thay đổi về triệu chứng. Bệnh nhân đang điều trị bằng thuốc chống loạn nhịp có nguy cơ cao, chẳng hạn như dofetilide hoặc sotalol , thường được khám sáu tháng một lần. Những bệnh nhân này có thể cần được chăm sóc bởi bác sĩ tim mạch và/hoặc chuyên gia điện sinh lý để quản lý thuốc chống loạn nhịp.
Thỉnh thoảng, bệnh nhân cần được theo dõi những điều sau:
●Hiệu quả và an toàn của liệu pháp chống huyết khối (tỷ lệ chuẩn hóa quốc tế cho bệnh nhân dùng warfarin và độ thanh thải creatinine cho bệnh nhân dùng liệu pháp chống loạn nhịp và các thuốc chống đông máu mới hơn khác).
●Tình trạng chức năng, bao gồm thay đổi triệu chứng (lịch sử).
●Hiệu quả và an toàn của điều trị bằng thuốc chống loạn nhịp (ví dụ ECG, đánh giá chức năng thận và gan).
●Hiệu quả của việc kiểm soát tần số (lịch sử, ECG và theo dõi Holter mở rộng nếu nghi ngờ có sự thay đổi nhịp tim).
Ở những bệnh nhân AF đang hoạt động, chúng tôi sử dụng kiểm tra gắng sức để đánh giá mức độ kiểm soát nhịp tim ở AF trong khi tập thể dục. Kiểm soát nhịp tim không đầy đủ ở AF là yếu tố chính gây ra tình trạng không dung nạp gắng sức ở AF.
Xét nghiệm – Chúng tôi lấy công thức máu toàn phần, điện giải đồ trong huyết thanh và đánh giá chức năng thận, đặc biệt ở những bệnh nhân có thể bắt đầu dùng thuốc chống đông đường uống không chứa vitamin. Chúng tôi không yêu cầu troponin trừ khi nghi ngờ thiếu máu cục bộ cấp tính. Bệnh cường giáp lâm sàng hoặc cận lâm sàng xuất hiện ở ít hơn 5% bệnh nhân mắc AF [24]. Nên đo nồng độ hormone kích thích tuyến giáp và nồng độ T4 tự do ở tất cả các bệnh nhân có giai đoạn AF đầu tiên hoặc ở những người có tần số AF tăng lên.
Hậu quả
Nhồi máu cơ tim — Nhồi máu cơ tim đã được chứng minh là xảy ra do huyết khối động mạch vành do rung nhĩ [43,44]. Tuy nhiên, còn thiếu các nghiên cứu lớn về di chứng này của AF.
Ngoài ra, nhồi máu cơ tim do thiếu máu cục bộ do nhu cầu (còn gọi là nhồi máu cơ tim loại 2) cũng có thể do rung nhĩ, thường là do nhịp thất nhanh.
Trong khi rối loạn nhịp tim nhanh đã được chứng minh là nguyên nhân chiếm khoảng 25% nguyên nhân nhồi máu cơ tim loại 2 [45], thì vẫn còn thiếu các nghiên cứu cụ thể về AF và nhồi máu cơ tim loại 2.
Ở những bệnh nhân bị nhồi máu cơ tim gần đây, sự phát triển tiếp theo của AF làm tăng tỷ lệ tử vong [46,47]. Tác động này chủ yếu là do các yếu tố nguy cơ liên quan như suy tim và sốc tim chứ không phải do bản thân AF [47,48].
Tỷ lệ tử vong
AF và tử vong – AF là một yếu tố nguy cơ độc lập gây tử vong ở nhiều độ tuổi và ở cả nam và nữ, nhưng không đủ bằng chứng để xác định AF là nguyên nhân gây tử vong quá mức thay vì chỉ là dấu hiệu của nguy cơ cao [49].
Các thử nghiệm kiểm soát nhịp ở bệnh nhân rung nhĩ gợi ý rằng những người có nhịp xoang có tỷ lệ tử vong thấp hơn so với những người mắc rung nhĩ [50,51]. Trong phân tích thứ cấp của thử nghiệm AFFIRM ngẫu nhiên có đối chứng về kiểm soát nhịp so với kiểm soát tần số trong AF, sự hiện diện của nhịp xoang có liên quan đến việc giảm đáng kể tỷ lệ tử vong (tỷ lệ nguy hiểm [HR] 0,54; CI 95% 0,42-0,70) [50]. Lợi ích tương tự từ việc duy trì nhịp xoang (nguy cơ tương đối 0,44; KTC 95% 0,4-0,64) đã được ghi nhận trong một thử nghiệm riêng biệt về dofetilide ở những bệnh nhân bị suy giảm chức năng tâm thất trái [51].
●Sức mạnh của sự liên kết – Các nghiên cứu đoàn hệ quan sát cũng cho thấy AF có liên quan đến việc tăng tỷ lệ tử vong [52-55]. Trong một phân tích hậu kiểm của Nghiên cứu Sức khỏe Phụ nữ trên 34.772 phụ nữ có độ tuổi trung bình là 53 không bị AF, 2,9% đã phát triển AF sau thời gian theo dõi trung bình là 15,4 năm [52]. AF mới khởi phát có liên quan đến tăng đáng kể nguy cơ tử vong do mọi nguyên nhân, tim mạch và không do tim mạch (HR 2,14, KTC 95% 1,64-2,77; HR 4,18, KTC 95% 2,69-6,51; và HR 1,66, KTC 95% tương ứng là 1,19-2,30). Việc điều chỉnh các biến cố tim mạch không gây tử vong như nhồi máu cơ tim, đột quỵ hoặc suy tim đã làm giảm những nguy cơ này, nhưng sự cố AF vẫn liên quan đáng kể với tất cả các loại tử vong (HR 1,7, HR 2,57, HR và 1,42, tương ứng).
●Sự khác biệt về giới tính – Một số nghiên cứu quan sát cho thấy mối liên quan giữa AF và tử vong ở phụ nữ mắc AF cao hơn so với nam giới [53,54]. Trong một nghiên cứu hồi cứu trên 272.186 bệnh nhân mắc AF ngẫu nhiên tại thời điểm nhập viện và 544.344 bệnh nhân đối chứng không có AF, nguy cơ tử vong tương đối được điều chỉnh do AF ở nữ cao hơn so với nam ở mọi nhóm tuổi (2,15 so với 1,76 đối với những người <65). năm, 1,72 so với 1,36 đối với những người từ 65 đến 74 tuổi và 1,44 so với 1,24 đối với những người từ 75 đến 85 tuổi) [53]. Trong 621 người tham gia Nghiên cứu Tim Framingham, rung nhĩ dẫn đến nguy cơ tử vong gần như tăng gấp đôi ở cả nam và nữ (tỷ lệ chênh lệch được điều chỉnh là 1,9 đối với nữ và 1,5 đối với nam) (hình 2) [54]. Sự khác biệt giới tính trong mối liên hệ giữa AF và tỷ lệ tử vong cũng được thể hiện trong một nghiên cứu riêng biệt trên 15.000 nam và nữ [55].
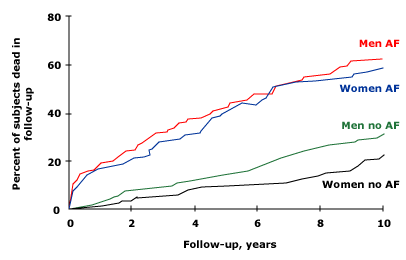
Trong số 5209 đối tượng trong Nghiên cứu Tim Framingham, tỷ lệ tử vong sau 10 năm theo dõi cao hơn ở cả nam và nữ, độ tuổi từ 55 đến 74, bị rung nhĩ (AF) so với những người không bị rung nhĩ (p <0,001). Một mối quan hệ tương tự cũng được thấy ở các đối tượng trong độ tuổi từ 75 đến 94 (không được hiển thị).
Hình 2. Rung làm tăng tỷ lệ tử vong ở nam và nữ
●Nguyên nhân gây tử vong quá mức – Ở những người tham gia mắc chứng AF trong Nghiên cứu Tim Framingham, cả suy tim và đột quỵ đều góp phần gây ra tỷ lệ tử vong quá mức [54]. Ngoài ra, trong một nghiên cứu quan sát trên 20.000 cá nhân trong hai đoàn hệ, sự cố rung nhĩ có liên quan đến tăng nguy cơ đột tử do tim (HR 2,47; KTC 95% 1,95-3,13) cũng như tử vong do tim không đột ngột (HR 2,98; 95% CI 2,52-3,53) [56]. Các nguyên nhân cụ thể gây tử vong, cũng như tần suất và các yếu tố dự đoán, được đánh giá bằng cách sử dụng dữ liệu theo dõi từ thử nghiệm RE-LY so sánh dabigatran với warfarin [57]. Trong số 18.113 bệnh nhân được chọn ngẫu nhiên với thời gian theo dõi trung bình là 2 năm, tỷ lệ tử vong hàng năm là 3,84%. Tử vong do tim (đột tử do tim và suy tim tiến triển) chiếm 37,4% trong số này; đột quỵ và tử vong do xuất huyết chiếm 9,9%.
●Các yếu tố dự báo tử vong ở bệnh nhân AF – Trong thử nghiệm RE-LY, các yếu tố dự báo lâm sàng độc lập mạnh nhất về tử vong do tim là suy tim, chậm dẫn truyền trong thất trên ECG và nhồi máu cơ tim trước đó [57]. Trong một phân tích hậu kiểm của thử nghiệm RACE II, nguy cơ mắc bệnh và tử vong do tim mạch cao nhất ở những người có gánh nặng triệu chứng lớn nhất được đánh giá bằng Thang đo mức độ nghiêm trọng của rung nhĩ Toronto [58]. Phát hiện này được thúc đẩy bởi tỷ lệ nhập viện do suy tim ngày càng tăng.
Lợi ích của hoạt động thể chất – Giống như dân số nói chung, ở những bệnh nhân mắc AF, hoạt động thể chất có thể làm giảm đáng kể tỷ lệ tử vong do tim mạch [41,42].
Trong một nghiên cứu tiến cứu của Đan Mạch trên hơn 1100 cá nhân mắc AF, các chỉ số trao đổi chất tương đương được sử dụng để ước tính tình trạng tim mạch và hô hấp, và bệnh nhân được theo dõi tới 9 năm về kết quả tử vong. Nghiên cứu này quan sát thấy rằng mỗi nhiệm vụ tương đương với một quá trình trao đổi chất cao hơn có liên quan đến nguy cơ tử vong do mọi nguyên nhân thấp hơn (HR 0,88; KTC 95% 0,81-0,95) và tỷ lệ tử vong do bệnh tim mạch (HR 0,85; KTC 95% 0,76-0,95) [41]. Những bệnh nhân đáp ứng các khuyến nghị về hoạt động thể chất của Hiệp hội Tim mạch Châu Âu có nguy cơ tử vong do tim mạch thấp hơn so với những bệnh nhân không hoạt động (HR 0,54; KTC 95% 0,34-0,86) [42].
Đột quỵ và thiếu máu não thầm lặng
●Đột quỵ – Đột quỵ là biến chứng lớn thường gặp nhất của AF; chủ đề này được thảo luận chi tiết một cách riêng biệt.
●Thiếu máu não thầm lặng – Thiếu máu não thầm lặng xảy ra ở một bệnh nhân có tổn thương cụ thể trên nghiên cứu hình ảnh mà không có khiếu nại hoặc phát hiện lâm sàng. Trong số bệnh nhân rung nhĩ, những tổn thương này tương đối phổ biến; điều này được thảo luận chi tiết một cách riêng biệt.
Suy giảm nhận thức và sa sút trí tuệ – AF làm tăng nguy cơ suy giảm nhận thức, sa sút trí tuệ do mọi nguyên nhân, sa sút trí tuệ mạch máu và bệnh Alzheimer [59,60]. Không rõ liệu thuốc chống đông máu có bảo vệ chống lại chứng sa sút trí tuệ hay không [60,61]. Điều này được thảo luận chi tiết một cách riêng biệt.
Suy tim – AF là yếu tố nguy cơ gây suy tim mới khởi phát. Điều này được thảo luận riêng.
Lo âu và trầm cảm – AF có liên quan đến trầm cảm, lo âu và đau khổ tâm lý [62-64]. Trong 10.000 người từ Nghiên cứu Sức khỏe Gutenberg, mức độ trầm cảm được đo bằng Bảng câu hỏi Sức khỏe Bệnh nhân (PHQ-9). Điểm PHQ-9 trung bình (phân vị thứ 25/75) của các triệu chứng trầm cảm cao hơn ở những bệnh nhân có so với không có AF (4 so với 3).
Trong số những người tham gia có triệu chứng AF, cắt bỏ qua catheter có thể cải thiện các triệu chứng tâm lý của lo âu và trầm cảm so với điều trị nội khoa. Trong nghiên cứu Tác động ngẫu nhiên của việc triệt phá AF qua catheter đối với căng thẳng tâm lý trong nghiên cứu Rung nhĩ (REMEDIAL), 100 người tham gia có triệu chứng AF được chỉ định ngẫu nhiên cắt bỏ AF qua catheter hoặc điều trị nội khoa và theo dõi kết quả chính của Thang điểm lo âu và trầm cảm tại bệnh viện (HADS) ở mức 12 tháng [65]. Dữ liệu về tái phát rối loạn nhịp tim và gánh nặng AF cũng được phân tích. Việc cô lập tĩnh mạch phổi thành công đã đạt được ở tất cả những người tham gia nhóm cắt bỏ. Điểm HADS tổng hợp thấp hơn trong nhóm cắt bỏ so với nhóm nội khoa ở thời điểm 6 tháng (8,2 [5,4] so với 11,9 [7,2]) và 12 tháng (7,6 [5,3] so với 11,8 [8,6]). Tỷ lệ đau khổ tâm lý nghiêm trọng cũng thấp hơn ở nhóm cắt bỏ so với nhóm điều trị nội khoa ở thời điểm 6 tháng (14,2 so với 34%) và 12 tháng (10,2 so với 31,9%); điểm lo lắng cũng thấp hơn ở nhóm cắt bỏ qua catheter.
TÀI LIỆU THAM KHẢO
BÌNH LUẬN