Michael W. Best & Craig S. Jabaley
Current Anesthesiology Reports volume 9, pages 151–157 (2019)
Dịch bài: BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
TÓM TẮT
Mục đích đánh giá
Để xem xét hiểu biết hiện tại của chúng tôi về khoảng nội mạch, mục tiêu điều trị của hồi sức bằng dịch truyền, các tiêu chí thích hợp của hồi sức và sự lựa chọn dịch truyền thích hợp.
Những phát hiện gần đây
Sự hiểu biết ngày càng tăng về nội mô và glycocalyx đã nâng cao hiểu biết của chúng ta về khoảng nội mạch. Hồi sức tích cực hơn bằng dịch truyền sau khi áp dụng các hướng dẫn của Chiến dịch Nhiễm trùng huyết sống sót đã dẫn đến giảm tỷ lệ tử vong ban đầu liên quan đến nhiễm trùng huyết; tuy nhiên, những tác động khôn lường của quá tải thể tích ngày càng rõ ràng. Khả năng đáp ứng dịch truyền có thể là điểm cuối tốt nhất để hồi sức. Albumin không được chứng minh là có hiệu quả vượt trội so với dung dịch tinh thể trong hồi sức bệnh nhân nhiễm trùng huyết. Vì nước muối 0,9% có liên quan đến chấn thương thận cấp tính, dung dịch muối đệm cân bằng được coi là dịch hồi sức ưu tiên được lựa chọn.
Tóm tắt
Hồi sức bằng dịch truyền bằng dung dịch tinh thể đệm được ưu tiên hơn và có thể nên tiếp tục nếu bệnh nhân vẫn đáp ứng với dịch truyền. Chiến lược này có nguy cơ quá tải về thể tích.
GIỚI THIỆU
Sốc nhiễm trùng được định nghĩa là một phản ứng của vật chủ bị rối loạn điều chỉnh đối với nhiễm trùng với bằng chứng rối loạn chức năng cơ quan thứ phát do tưới máu không đầy đủ [1].
Rộng hơn, sốc nhiễm trùng có thể được khái niệm là sự mất cân bằng giữa nhu cầu, phân phối và sử dụng oxy ở cấp độ tế bào do tác động lẫn nhau giữa nhiễm trùng và phản ứng của cơ thể đối với nhiễm trùng. Duy trì thể tích nội mạch đầy đủ để thúc đẩy cung lượng tim và cung cấp oxy trong quá trình giãn mạch toàn thân đồng thời đã trở thành phương pháp thực hành chính kể từ khi áp dụng liệu pháp hướng đến mục tiêu sớm (early goal–directed therapy − EGDT) và sự phát triển tiếp theo của Hướng dẫn Chiến dịch Nhiễm trùng huyết Sống sót (Surviving Sepsis Campaign) [2, 3 •• , 4••]. Sau thử nghiệm EGDT ban đầu, cuộc tranh luận vẫn tiếp diễn về các mục tiêu huyết động học tối ưu và cách tiếp cận để phục hồi chúng; tuy nhiên, các nguyên tắc chung để cố gắng tối ưu hóa việc cung cấp, tiêu thụ và sử dụng oxy đã tồn tại từ lâu [2, 3 ••, 4 ••]. Gói Chiến dịch Nhiễm trùng huyết Sống sót năm 2018 nêu bật việc sử dụng sớm thuốc kháng sinh và truyền dịch tĩnh mạch (intravenous fluid bolus − IVFB) 30 mL/kg là nền tảng của các khuyến nghị điều trị [4 ••]. Khi cơ sở bằng chứng không đồng nhất xung quanh việc hồi sức bằng dịch truyền ngày càng tăng về quy mô, phạm vi và độ phức tạp, các câu hỏi vẫn liên quan đến cả loại dịch truyền để sử dụng và các điểm cuối sinh lý nào sẽ sử dụng để xác định thể tích thích hợp hồi sức. Bài viết này sẽ xem xét hiểu biết hiện tại của chúng ta về khoảng nội mạch, mục tiêu điều trị của hồi sức dịch, lựa chọn dịch thực dụng và các thông số để quyết định liều lượng thích hợp.
XEM LẠI CÂN BẰNG STARLING
Nước bên ngoài tế bào tồn tại trong chất nền ngoại bào (extracellular matrix − ECM) hoặc khoảng nội mạch. Starling đã mô tả cách thức tác động của áp lực thủy tĩnh và áp lực keo tác động trên màng mao mạch quyết định sự cân bằng nước giữa ECM và khoảng nội mạch. Về mặt khái niệm, áp lực thủy tĩnh vượt quá áp lực keo sẽ dẫn đến sự chuyển dịch của nước từ khoảng nội mạch vào ECM. Nếu áp lực keo chiếm ưu thế, nước từ ECM sẽ chảy trở lại khoang nội mạch. Mặc dù mô hình khái niệm của Starling đã có từ lâu, nhưng một số độc giả của nó đã không chịu xem xét kỹ lưỡng hơn [5].
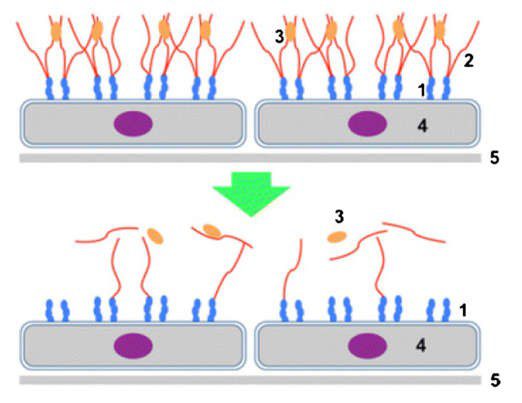
Hình 1 Sơ đồ mô tả một lớp glycocalyx nội mô khỏe mạnh (trên cùng) và bị tổn thương (dưới) ở phía lòng mạch của nội mô. (1) Phân tử kết dính, (2) Glycosaminoglycans, (3) Chất trung gian liên kết với glycocalyx, (4) Tế bào nội mô, (5) Màng nền nội mô. Sao lại với sự cho phép của Santi M, Lava SA, Camozzi P, et al. Santi M, Lava SA, Camozzi P, et al. “The great fluid debate: sale or so-called “balanced” salt solutions?” Ital J Pediatr. 2015 Jun 25; 41:47
Bây giờ chúng ta hiểu rằng một chất nền glycoprotein và proteoglycan phức tạp, có hoạt tính chuyển hóa và dường như mỏng manh xếp thành hàng dọc của nội mô, được gọi là lớp glycocalyx hoặc lớp glycocalyx nội mô (endothelial glycocalyx layer − EGL) [5-9]. Ở cấp độ của mao mạch, EGL đóng vai trò như một hàng rào bán thấm ngăn cản sự di chuyển của các phân tử lớn hơn (ví dụ, albumin) qua các lớp đệm và khoảng trống giữa các tế bào nội mô (Hình 1). EGL chịu trách nhiệm chính trong việc thiết lập gradient áp lực keo được mô tả trong mô hình của Starling. Tuy nhiên, trong thực tế, áp lực hướng vào chỉ có thể giảm đi chứ không thể thắng được áp lực thủy tĩnh. Ngoại trừ trong một số ít giường mô, nước không trực tiếp đi từ ECM vào khoảng nội mạch; thay vào đó, nước trong ECM trở lại khoảng nội mạch qua hệ bạch huyết.
THAY ĐỔI NỘI MẠCH TRONG NHIỄM TRÙNG HUYẾT
Nhiễm trùng huyết và phản ứng viêm lan rộng liên quan của nó tạo ra một số thay đổi chính đối với khoảng nội mạch và cấu trúc của nó [5,7-9]. Sự gia tăng nitric oxide synthetase và sự thiếu hụt tương đối của vasopressin dẫn đến giãn mạch ở cả giường động mạch và tĩnh mạch [9]. Sự giãn nở của các động mạch có tính đàn hồi cao chủ yếu làm giảm áp lực động mạch trung bình; Sự giãn nở của các tĩnh mạch độ giãn nở cao chủ yếu dẫn đến tăng dung tích tĩnh mạch tiềm tàng và dẫn đến giảm thể tích tuần hoàn.
Nhiều dấu hiệu viêm và các phân tử kết dính nội mô được kích hoạt trong quá trình nhiễm trùng huyết gây ra những thay đổi tế bào ở cấp độ nội mạch, có thể gây ra rối loạn chức năng cả đại tuần hoàn và vi tuần hoàn thông qua bệnh nội mô [10 •]. Ngoài tổn thương nội mô, huyết khối vi mạch và mở rộng khoảng cách giữa các tế bào nội mô, những chất trung gian gây viêm này cũng có liên quan đến sự rụng của EGL. Mức lưu hành của heparan sulfat, syndecan-1, và các thành phần phân tử lớn khác của EGL tăng cao trong tình trạng sốc và chấn thương [8]. Việc mất EGL góp phần vào một số hiện tượng được quan sát thấy ở nhiễm trùng huyết nặng:
Bằng chứng thực nghiệm cho thấy EGL có thể chiếm từ 700 đến 1500 mL thể tích trong lòng mạch [5, 6]. Do đó, việc mất EGL làm trầm trọng thêm tình trạng giảm thể tích tuần hoàn do giãn mạch đã được mô tả trước đây.
Sự thoái hóa của EGL cho phép các phân tử đi qua các khoảng trống tế bào và các lớp đệm trong thành nội mô. Sự cân bằng thay đổi này của các đại phân tử qua màng mao mạch làm cho áp lực thủy tĩnh bên ngoài không bị ảnh hưởng, làm tăng tốc độ nước thoát ra khỏi khoảng nội mạch đến ECM (tức là rò rỉ mao mạch). Tỷ lệ rò rỉ mao mạch tăng lên lấn át bạch huyết, và phù toàn thân phát triển [5, 7, 9].
Việc giải phóng các phân tử kết dính và viêm liên kết với glycocalyx làm lộ ra các tế bào nội mô và thúc đẩy quá trình viêm [10 •].
MỤC TIÊU CỦA HỒI SỨC DỊCH TRUYỀN TRONG NHIỄM TRÙNG HUYẾT
Các mục tiêu bao trùm trong hồi sức dịch cho bệnh nhân nhiễm trùng là làm đầy lại thể tích không bị nén và do đó tối ưu hóa tiền tải.
Dịch truyền trong hệ mạch tĩnh mạch có thể được khái niệm là thuộc về thể tích không bị nén hoặc bị nén (unstressed or stressed volume) [5, 7, 9, 11 •, 12]. Thể tích không bị nén là lượng dịch truyền cần thiết trước khi áp lực nội mạch bắt đầu tăng, cũng có thể được coi là thể tích trước điểm uốn trên đường cong độ giãn nở. Do đó, thể tích bị nén là lượng dịch truyền góp phần tích cực vào lực căng của thành mạch, áp lực tĩnh mạch, và do đó liên quan đến trở lại tĩnh mạch. Các giường tĩnh mạch nội tạng và da là những bể chứa dung tích tĩnh mạch lớn và là những yếu tố chính đóng góp vào thể tích không bị nén, có thể được huy động để duy trì tiền tải. Dịch hồi sức sớm trong nhiễm trùng huyết ban đầu sẽ lấp đầy thể tích không bị nén tạo ra bởi cả giãn mạch và mất EGL. Thuốc co mạch cũng có thể ảnh hưởng đến trương lực tĩnh mạch, chuyển máu không bị nén ra khỏi các mạch máu dung tích và góp phần làm tăng tiền tải. Tiếp tục hồi sức bằng dịch truyền sau đó làm tăng thể tích bị nén, thúc đẩy cung lượng tim. Một khi thể tích không bị nén đã đầy, việc hồi sức bằng dịch truyền sẽ trở thành một tác động cân bằng. Thể tích bị nén quá ít làm giảm sự trở lại của tĩnh mạch và cung lượng tim; quá nhiều làm tăng áp lực thủy tĩnh hướng ra bên ngoài và rò rỉ mao mạch.
Sự trở lại của tĩnh mạch là một yếu tố quyết định chính của thể tích tâm thất cuối tâm trương và do đó tiền tải của tim [5, 7, 9, 11 •, 12].
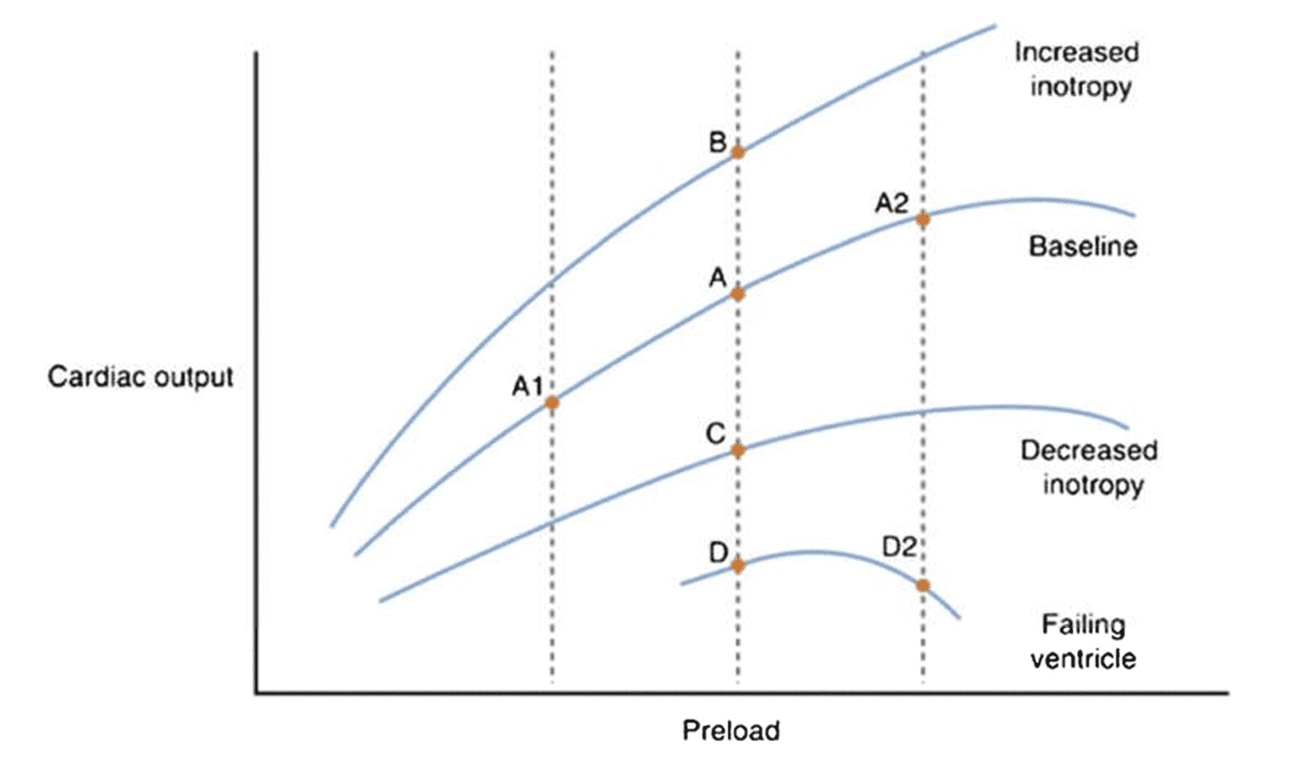
Hình 2 Đường cong Frank-Starling thể hiện mối quan hệ giữa cung lượng tim và tiền tải. Các đường thẳng đứng (đứt nét) cho thấy mức độ tiền tải tương tự nhau và cách chúng liên quan ở các trạng thái co bóp tâm thất khác nhau. A1, A và A2 chứng minh mức độ tăng tiền tải thường dẫn đến tăng cung lượng tim dọc theo đường nền Frank-Starling. D và D2 chứng minh việc tăng tiền tải có thể dẫn đến cung lượng tim xấu đi trong suy tâm thất như thế nào. A, B, C, D so sánh mức độ thay đổi co bóp của tim với tiền tải cố định có thể dẫn đến cung lượng tim khác nhau. Sao lại từ Mann D. (2017) “Đường cong Frank-Starling.” Trong: Raj TD (Ed.) Data Interpretation in Anesthesia – A Clinical Guide
Đường cong Frank-Starling được xác định bằng mối quan hệ giữa độ dài và lực căng quan sát được trong cơ tim (Hình 2) [6]. Khi các sợi cơ được kéo căng ra, sự bắc cầu chéo actin-myosin tăng lên dẫn đến tăng khả năng co bóp. Do đó, thể tích nhát bóp ban đầu tăng khi thể tích cuối tâm trương tăng. Khi cơ tim tiếp tục bị kéo căng, sẽ có sự suy giảm khả năng bắc cầu chéo actinmyosin và rối loạn chức năng tâm thất xảy ra. Độ dốc của đường cong tương đối nông đối với một tâm thất có độ giãn nở khác nhưng lại có biểu hiện phì đại tâm thất và rối loạn chức năng tâm trương. Đồng thời, cần phải chú ý đến các áp lực làm đầy để đảm bảo duy trì một gradient thuận lợi cho sự hồi lưu của tĩnh mạch sao cho áp lực tĩnh mạch không ảnh hưởng đến tưới máu cơ quan [7].
Do đó, lượng dịch truyền chính xác cho một bệnh nhân phụ thuộc vào độ giãn nở của mạch và tim. Thể tích dịch truyền lý tưởng sẽ cung cấp đủ tiền tải cho tim để hoạt động gần đỉnh của đường cong Frank-Starling mà không tạo ra áp lực thủy tĩnh nội mạch quá mức. Có thể không đạt được sự cân bằng dịch lý tưởng này, đặc biệt là ở những bệnh nhân có hệ thống mạch máu và/hoặc tâm thất kém. Những bệnh nhân này có cửa sổ điều trị hẹp hơn nhiều và cần được theo dõi chặt chẽ hơn và truyền dịch cẩn thận. Sự thay đổi dịch truyền và những thay đổi động trong độ giãn nở càng thách thức việc quản lý những bệnh nhân này.
CÁC ĐIỂM CUỐI CỦA HỒI SỨC
Một số biến số lâm sàng đã được đề xuất để dự đoán khi nào một bệnh nhân có sự cân bằng dịch truyền tối ưu [7, 9, 11-15]. Rivers và các đồng nghiệp đã chỉ ra rằng một giao thức tối ưu hóa áp lực tĩnh mạch trung tâm (CVP), áp lực động mạch trung bình (MAP) và cung cấp oxy (được xác định trong thử nghiệm này bằng độ bão hòa oxy tĩnh mạch trung tâm, hemoglobin, cung lượng tim và mức tiêu thụ oxy) làm giảm đáng kể tỷ lệ tử vong liên quan đến nhiễm trùng huyết [2]. Có tên là EGDT, quy trình này ban đầu sử dụng CVP để hướng dẫn hồi sức bằng dịch, sau đó dùng thuốc vận mạch và thuốc co mạch để điều chỉnh độ giãn nở mạch máu và đường cong FrankStarling. Các sản phẩm máu cũng được sử dụng để tăng khả năng vận chuyển oxy với hemoglobin mục tiêu là 10 g/dL.
Mặc dù các tiêu chí cụ thể do Tiến sĩ Rivers đề xuất đã gây ra nhiều tranh luận, nhưng EGDT đã chuyển hướng quản lý không chỉ đơn giản là nhắm vào huyết áp và CVP. Một số nghiên cứu tiếp theo sử dụng các giao thức giống hoặc tương tự như nhóm của Tiến sĩ Rivers đã không thể chứng minh lợi ích về tỷ lệ tử vong [16-21]. Nhiều thử nghiệm trong số này xảy ra sau khi áp dụng rộng rãi Hướng dẫn Chiến dịch Nhiễm trùng huyết sống sót, trong đó kết hợp một số thành phần chính của giao thức EGDT ban đầu [3 ••].
Các hướng dẫn về nhiễm trùng huyết hiện tại đề xuất sử dụng IVFB ban đầu để cung cấp đầy đủ thể tích không bị nén [3 ••, 4 ••]. Sau đó, hồi sức bằng dịch truyền được tiếp tục miễn là bệnh nhân “đáp ứng dịch truyền”, được định nghĩa là khả năng tăng cung lượng tim với IVFB bổ sung [3 ••, 7, 11 •, 12, 15]. Giả thiết được đặt ra rằng nếu một bệnh nhân đáp ứng với dịch truyền, thì họ sẽ ở bên trái đỉnh của đường cong Frank-Starling và có thể được hưởng lợi từ việc trở về tĩnh mạch bổ sung.
Một số dấu hiệu lâm sàng đã được sử dụng để dự đoán xem bệnh nhân có đáp ứng với dịch truyền hay không. Một cách tiếp cận như vậy dựa vào việc kiểm tra các thay đổi động trong tuần hoàn vĩ mô trong quá trình thay đổi nhịp thở của áp lực trong lồng ngực khi thông khí áp lực dương [11 •, 12, 15]. Sự thay đổi hô hấp của áp lực mạch (PPV), huyết áp tâm thu (SPV) và thể tích nhát bóp (SVV) đều đã được xác nhận là phương pháp để dự đoán bệnh nhân nào sẽ đáp ứng với dịch truyền miễn là bệnh nhân được thông khí áp lực dương, độ giãn nở máy thở, có nhịp tim đều và nhận được thể tích khí lưu thông ít nhất 8–10 mL/kg trọng lượng cơ thể dự đoán. Ở những bệnh nhân này, các biến thiên lớn hơn 10–13% dự đoán một cách hợp lý khả năng đáp ứng với dịch truyền. Ở những bệnh nhân thở tự nhiên, phép đo siêu âm của sự thay đổi theo hô hấp của đường kính của tĩnh mạch chủ dưới cũng đã được chứng minh là có thể dự đoán một cách hợp lý khả năng đáp ứng với dịch truyền. Các thao tác này là những phần thông tin bổ sung phải được sử dụng trong bối cảnh khám lâm sàng, diễn biến lâm sàng và sinh lý bệnh cơ bản của bệnh nhân.
Một khi bác sĩ lâm sàng tin rằng bệnh nhân có thể có lợi khi bổ sung dịch truyền, điều quan trọng là phải sử dụng một dấu hiệu khách quan để đánh giá liệu dịch truyền bổ sung có mang lại lợi ích hay không. Trong thực hành hiện đại, một số kết hợp giữa thể tích nhát bóp, cung lượng tim, MAP, độ bão hòa oxy tĩnh mạch trung tâm hoặc hỗn hợp, và độ thanh thải lactate thường được đánh giá theo phương pháp [3 ••, 7, 9, 11 •, 12, 13, 15, 22]. Nếu bệnh nhân nghi ngờ có cửa sổ điều trị hẹp đến mức thử nghiệm dịch truyền theo kinh nghiệm là không thận trọng, thì có thể áp dụng thử nghiệm nâng chân thụ động [11 •, 12]. Bằng cách đặt bệnh nhân nằm ngửa và nâng cao chân lên hơn 45 độ, có thể thu nhận khoảng 500 mL thể tích máu từ các mạch dung tích tĩnh mạch. Phương pháp này kiểm tra đáp ứng của bệnh nhân với liều truyền dịch mà không cần liên kết với kế hoạch điều trị. Một khi bệnh nhân không còn đáp ứng đáng kể, thì nên sử dụng thuốc vận mạch hoặc thuốc co mạch.
Mặc dù các dấu hiệu đánh giá khả năng đáp ứng với dịch truyền rất nhạy trong việc xác định bệnh nhân giảm thể tích, nhưng chúng không đặc hiệu và có nguy cơ hồi sức quá mức [7, 9]. Các tác giả tin rằng thiếu sự khác biệt đáng kể giữa EGDT và các phương pháp thực hành tốt nhất hiện nay cho thấy rằng các tiêu chí lâm sàng đáng tin cậy của hồi sức vẫn chưa được làm sáng tỏ. Hầu hết các máy monitor lâm sàng cung cấp thông tin về tuần hoàn vĩ mô – áp lực động mạch trung bình, nhịp tim, cung lượng tim, v.v. Ngay cả các phép đo chức năng cơ quan cuối, chẳng hạn như lượng nước tiểu, cũng không được chứng minh là có tương quan có ý nghĩa với tưới máu mô [14]. Nhiều nghiên cứu đã chứng minh rằng tối ưu hóa tuần hoàn vĩ mô không đảm bảo tối ưu hóa vi tuần hoàn, điều này thể hiện một lĩnh vực nghiên cứu quan trọng trong tương lai kết hợp với việc khám phá các can thiệp điều trị nhắm vào EGL [23 •, 24].
DUNG DỊCH KEO SO VỚI DUNG DỊCH TINH THỂ
Có hai loại dịch truyền truyền tĩnh mạch (IV) rộng rãi: dung dịch keo và dung dịch tinh thể. Ba loại dung dịch keo chính được bán trên thị trường: albumin, tinh bột hydroxyetyl (HES) và gelatin. Là dịch truyền hoạt động tạo áp lực keo, dung dịch keo theo giả thuyết làm chậm tốc độ rò rỉ mao mạch bằng cách tăng áp lực dương bên trong qua màng mao mạch; tuy nhiên, tác dụng này chỉ tồn tại trong thời gian ngắn ở bệnh nhân nhiễm trùng vì việc mất đi EGL sẽ cho phép các phân tử hoạt động keo cuối cùng cân bằng giữa khoảng nội mạch và ngoại bào [5, 7, 9]. Các nghiên cứu về thời gian bán hủy nội mạch của dung dịch keo và tinh thể đều nhất quán, chứng tỏ thời gian bán hủy nội mạch dài hơn đối với dung dịch keo nhưng cuối cùng rò rỉ mao mạch vào ECM cho cả hai [25]. Các lợi ích có thể có khác của dung dịch keo, cụ thể là albumin, bao gồm phần lớn là các tác dụng chống viêm theo giả thuyết và các đặc tính thu gom oxit nitric [26].
Chưa có bất kỳ thử nghiệm đối chứng ngẫu nhiên lớn nào chứng minh được sự khác biệt rõ ràng về tỷ lệ tử vong giữa hồi sức sử dụng dung dịch tinh thể hoặc dung dịch keo trong nhiễm trùng huyết. Thử nghiệm SAFE là một thử nghiệm ngẫu nhiên có đối chứng thực dụng, lớn, kiểm tra nước muối 0,9% so với albumin như một dịch truyền hồi sức cho một số lượng lớn người lớn bị bệnh nặng [27]. Mặc dù không có sự khác biệt đáng kể về tỷ lệ tử vong trong 28 ngày đối với tất cả các bệnh nhân, nhưng có một gợi ý về kết quả được cải thiện ở những bệnh nhân nhiễm trùng huyết nặng và hội chứng suy hô hấp cấp (ARDS). Hai nghiên cứu sau đó cũng chứng minh lợi ích về tỷ lệ tử vong nhẹ liên quan đến việc sử dụng dung dịch keo ở bệnh nhân nhiễm trùng huyết nặng, mặc dù cả hai đều không đạt được ý nghĩa thống kê [26, 28].
Thử nghiệm ALBIOS đã kiểm tra việc bổ sung albumin ở những bệnh nhân bị nhiễm trùng huyết nặng và sốc nhiễm trùng [26]. Albumin huyết thanh được duy trì ở 3 g/dL bằng cách dùng 20% albumin. Các bệnh nhân khác đã được hồi sức bằng các dung dịch tinh thể. Mặc dù không có sự thay đổi về tỷ lệ tử vong trong 28 ngày hoặc 90 ngày, phân tích hậu kỳ cho thấy lợi ích về tỷ lệ tử vong có thể xảy ra đối với những bệnh nhân sốc nhiễm trùng, mặc dù kết luận này đã được xem xét kỹ lưỡng sau khi công bố [29].
Mặc dù việc sử dụng albumin để hồi sức bằng dịch truyền không liên quan một cách thuyết phục với việc cải thiện kết quả lâm sàng ở người lớn bị bệnh nặng, một phân tích nhóm phụ của dữ liệu thử nghiệm SAFE đã chứng minh kết quả tồi tệ hơn ở những bệnh nhân bị chấn thương sọ não nặng (TBI) được hồi sức bằng albumin [30].
Các dung dịch HES có liên quan đến chấn thương thận cấp tính (AKI) ở những bệnh nhân bị bệnh nặng với sự giám sát quy định đáng kể sau đó của Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ và Cơ quan Dược phẩm Châu Âu tại EU [31,32,33]. Việc sử dụng chúng trên toàn thế giới sau đó đã giảm rõ rệt [15]. Nghiên cứu tiền cứu lớn nhất bao gồm HES ở người lớn bị bệnh nặng là thử nghiệm CRISTAL: một nghiên cứu nhãn mở đa lục địa so sánh kết quả của 2857 bệnh nhân được nhận vào phòng chăm sóc đặc biệt (ICU) [28]. Mặc dù không có sự khác biệt về tỷ lệ tử vong trong 28 ngày, nhưng tỷ lệ tử vong trong 90 ngày đã giảm có ý nghĩa thống kê đối với những người được hồi sức bằng dung dịch keo (RR 0,92, KTC 95% 0,86–0,99). Nhóm dung dịch keo cũng được chứng minh là có nhu cầu vận mạch thấp hơn và giảm số ngày thở máy. Thử nghiệm này không phân biệt giữa dung dịch tinh thể ưu trương và đẳng trương. Nó cũng bao gồm HES và các công thức keo khác không còn được sử dụng phổ biến cho những bệnh nhân bị bệnh nặng.
Một lớp quan trọng khác của dung dịch keo là các sản phẩm từ máu. Thử nghiệm TRICC ban đầu đã chứng minh rằng mục tiêu hemoglobin thấp hơn 7–9 g/dL là an toàn ở những bệnh nhân bị bệnh nặng [34]. Một thử nghiệm tương tự chỉ xem xét những bệnh nhân bị sốc nhiễm trùng, thử nghiệm TRISS, so sánh mục tiêu hemoglobin là 7 g/dL so với 9 g/dL [35]. Không có sự khác biệt về tỷ lệ tử vong trong 90 ngày giữa các nhóm, mặc dù mục tiêu hemoglobin thấp hơn là 7 g/dL có liên quan đến việc truyền ít hơn (trung bình 1 đơn vị so với 3 đơn vị). Do các rủi ro liên quan, chi phí và nguồn cung cấp các sản phẩm máu hạn chế, các phương pháp hay nhất hiện nay chỉ khuyến nghị các sản phẩm máu trong hồi sức khi điều chỉnh tình trạng thiếu máu hoặc rối loạn đông máu [3 ••]. Mục tiêu hemoglobin cao hơn có thể phù hợp dựa trên các bệnh đi kèm của bệnh nhân và tình trạng lâm sàng tổng thể.
Hướng dẫn Chiến dịch Nhiễm trùng huyết Sống sót gần đây nhất khuyến cáo không nên sử dụng dung dịch keo làm dịch hồi sức ban đầu [3 ••]. Các hướng dẫn này viện dẫn chi phí gia tăng và lợi ích chưa được chứng minh về tính hợp lý của khuyến nghị này. Có thể hợp lý khi sử dụng albumin để giảm thiểu việc truyền dịch tổng thể ở những bệnh nhân có nguy cơ cao bị quá tải dịch (ví dụ, bệnh nhân bị rối loạn chức năng tâm trương nặng hoặc suy tim phải).
TẠI SAO CÂN BẰNG LÀ TỐT NHẤT
Lần đầu tiên được phát triển để điều trị tình trạng mất nước do dịch tả bùng phát vào cuối những năm 1800, dung dịch nước muối đã được sử dụng để hồi sức dịch truyền trong hơn 100 năm và vẫn là lựa chọn ưu tiên hàng đầu [15]. Dung dịch tinh thể có sẵn dưới dạng dung dịch đệm hoặc dung dịch không đệm. Có một số dung dịch đệm có sẵn; tuy nhiên, dung dịch không đệm duy nhất được sử dụng trong thực tế thông thường là nước muối. Các dung dịch đệm đa điện giải khác nhau về thành phần của chúng nhưng thường có độ pH, nồng độ clorua và độ thẩm thấu tổng thể gần với huyết tương người hơn so với các dung dịch muối.
Hồi sức bằng nước muối 0,9% có liên quan, theo kiểu phụ thuộc vào liều lượng, với sự phát triển của nhiễm toan chuyển hóa tăng clo máu, AKI, và rối loạn chức năng cơ quan cuối có thể đe dọa tính mạng [15, 36, 37 •, 38 ••]. Bất chấp những kết quả này, hơn 200 triệu lít được sử dụng mỗi năm chỉ riêng ở Hoa Kỳ, và nó vẫn là một dung dịch thể tinh thể thường được ưa chuộng [39]. Nước muối 0,9% cũng là chất pha loãng phổ biến cho nhiều loại thuốc tiêm tĩnh mạch do tính chất hóa học trơ của nó, thường tích tụ theo kiểu được đánh giá thấp, là lượng dịch truyền tương đối lớn [36].
Thử nghiệm SPLIT đã chọn ngẫu nhiên một quần thể bệnh nhân ICU hỗn hợp để nhận Plasma-Lyte (đệm) hoặc nước muối 0,9% để duy trì hoặc truyền dịch truyền tĩnh mạch [40]. Bệnh nhân ở cả hai nhóm điều trị được truyền trung bình khoảng 2 L dịch truyền. Không có sự khác biệt về tỷ lệ AKI hoặc liệu pháp thay thế thận giữa hai nhóm. Mặc dù đối tượng nghiên cứu này là hỗn hợp, phần lớn bệnh nhân là người sau phẫu thuật. Đa số bệnh nhân sau phẫu thuật cũng là thủ thuật chương trình. Tỷ lệ bệnh nhân sau phẫu thuật chương trình cao có thể hạn chế tính khái quát của nghiên cứu này.
Hai nghiên cứu gần đây từ Vanderbilt, SALT-ED và SMART, đã sử dụng một thiết kế nghiên cứu mới để cho phép thực hiện một thử nghiệm ngẫu nhiên rất lớn bao gồm tất cả các bệnh nhân được nhận qua Khoa Cấp cứu (SALTED) hoặc thông qua bất kỳ ICU (SMART) nào của họ [37 •, 38 ••]. Dựa trên tháng, tất cả bệnh nhân trong hệ thống sẽ nhận được dung dịch đệm hoặc nước muối sinh lý thông thường. Lactated Ringer’s là dung dịch đệm được sử dụng phổ biến nhất trong nghiên cứu. Thử nghiệm SALTED cho thấy không có sự khác biệt đáng kể về dấu hiệu cho tỷ lệ tử vong ngắn hạn, nhưng nước muối sinh lý có liên quan đến tăng nguy cơ AKI. Thử nghiệm SMART cũng cho thấy nguy cơ gia tăng các biến cố có hại cho thận có thể bao gồm tử vong, điều trị thay thế thận hoặc rối loạn chức năng thận dai dẳng đối với những bệnh nhân được điều trị bằng nước muối sinh lý. Trong phân tích nhóm phụ, bệnh nhân nhiễm trùng huyết có khả năng bị tổn hại nhiều nhất khi sử dụng nước muối sinh lý. Nói chung, những điều tra này đã cung cấp bằng chứng tiềm năng kết luận đầu tiên cho việc sử dụng các tinh thể cân bằng trong thực hành chăm sóc quan trọng thường xuyên.
KẾT LUẬN
Duy trì thể tích nội mạch đầy đủ để thúc đẩy cung lượng tim là biện pháp chính trong xử trí sớm sốc nhiễm trùng. Sự giãn mạch do tăng sản xuất oxit nitric và sự thiếu hụt tương đối trong vasopressin thúc đẩy sự giãn nở mạch máu và tăng thể tích không bị nén. Làm trầm trọng thêm thể tích không bị nén tăng lên là sự giảm EGL. Nếu không có gradient oncotic trên EGL, tốc độ nước thoát từ khoảng nội mạch đến ECM sẽ tăng lên, lấn át bạch huyết và dẫn đến chứng phù. Mục tiêu của hồi sức truyền dịch là phục hồi thể tích không bị căng thẳng, tối ưu hóa tiền tải, và do đó tối ưu hóa cung lượng tim và cung cấp oxy. Mục đích hồi sức hiện tại tập trung vào việc truyền dịch cho đến khi bệnh nhân không còn đáp ứng với dịch truyền. Tại thời điểm này, độ giãn nở mạch máu và cung lượng tim được điều chỉnh bằng cách sử dụng thuốc vận mạch và thuốc co mạch. Dung dịch keo chưa được chứng minh là tốt hơn dung dịch tinh thể trong hồi sức bệnh nhân nhiễm trùng. Các dung dịch tinh thể có đệm đã được chứng minh là ít gây tổn thương thận hơn nước muối 0,9% và nên là dịch hồi sức ban đầu được lựa chọn. Các nghiên cứu trong tương lai về can thiệp điều trị nhắm vào EGL và tối ưu hóa vi tuần hoàn, thay vì chỉ đơn giản là đại tuần hoàn, là cần thiết và sắp tới.
REFERENCES
- Papers of particular interest, published recently, have been highlighted as: • Of importance •• Of major importance
- Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. The third international consensus definitions for Sepsis and septic shock (Sepsis-3). JAMA. 2016;315(8):801– 10.
- Rivers E, Nguyen B, Havstad S, Ressler J, Muzzin A, Knoblich B, et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med. 2001;345(19):1368–77.
- • Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Crit Care Med. 2017;45(3):486–552 The most recent guidelines from the Surviving Sepsis Campaign, often considered to set the standard of care for the management of patients with sepsis.
- • Levy MM, Evans LE, Rhodes A. The Surviving Sepsis Campaign Bundle: 2018 update. Crit Care Med. 2018;46(6):997–1000 A new 1-h sepsis bundle is defined and recommended.
- Woodcock TE, Woodcock TM. Revised Starling equation and the glycocalyx model of transvascular fluid exchange: an improved paradigm for prescribing intravenous fluid therapy. Br J Anaesth. 2012;108(3):384–94.
- Nieuwdorp M, van Haeften TW, Gouverneur MCLG, Mooij HL, van Lieshout MHP, Levi M, et al. Loss of endothelial glycocalyx during acute hyperglycemia coincides with endothelial dysfunction and coagulation activation in vivo. Diabetes. 2006;55(2):480–6.
- PE M. The physiology of volume resuscitation. Curr Anesthesiol Rep. 2014;4(4):353–9.
- Becker BF, Jacob M, Leipert S, Salmon AHJ, Chappell D. Degradation of the endothelial glycocalyx in clinical settings: searching for the sheddases. Br J Clin Pharmacol. 2015;80(3):389–402.
- Marik P, Bellomo R. A rational approach to fluid therapy in sepsis. Br J Anaesth. 2016;116(3):339–49.
- Johansson PI, Stensballe J, Ostrowski SR. Shock induced endotheliopathy (SHINE) in acute critical illness – a unifying pathophysiologic mechanism. Crit Care. 2017;21(1):25 A review of how endothelial changes during critical illness affect the disease process and observed pathophysiology.
- Bentzer P, Griesdale DE, Boyd J, MacLean K, Sirounis D, Ayas NT. Will this hemodynamically unstable patient respond to a bolus of intravenous fluids? JAMA. 2016;316(12):1298–309 A review of various physiologic markers used to define fluid responsiveness with an evaluation of their sensitivities and specifities.
- Lesur O, Delile E, Asfar P, Radermacher P. Hemodynamic support in the early phase of septic shock: a review of challenges and unanswered questions. Ann Intensive Care. 2018;8(1):102.
- Jones AE, Shapiro NI, Trzeciak S, Arnold RC, Claremont HA, Kline JA, et al. Lactate clearance vs central venous oxygen saturation as goals of early sepsis therapy: a randomized clinical trial. JAMA. 2010;303(8):739–46.
- Egal M, Erler NS, de Geus HRH, van Bommel J, Groeneveld ABJ. Targeting oliguria reversal in goaldirected hemodynamic management does not reduce renal dysfunction in perioperative and critically ill patients: a systematic review and meta-analysis. Anesth Analg. 2016;122(1):173–85.
- MacDonald N, Pearse RM. Are we close to the ideal intravenous fluid? Br J Anaesth. 2017;119(suppl_1):i63–71.
- Investigators A, et al. Goal-directed resuscitation for patients with early septic shock. N Engl J Med. 2014;371(16):1496–506.
- Pro CI, et al. A randomized trial of protocol-based care for early septic shock. N Engl J Med. 2014;370(18):1683–93.
- Mouncey PR, Osborn TM, Power GS, Harrison DA, Sadique MZ, Grieve RD, et al. Trial of early, goaldirected resuscitation for septic shock. N Engl J Med. 2015;372(14):1301–11.
- Kuan WS, Ibrahim I, Leong BSH, Jain S, Lu Q, Cheung YB, et al. Emergency department management of sepsis patients: a randomized, goal-oriented, noninvasive sepsis trial. Ann Emerg Med. 2016;67(3):367–378 e3.
- Andrews B, Semler MW, Muchemwa L, Kelly P, Lakhi S, Heimburger DC, et al. Effect of an early resuscitation protocol on in-hospital mortality among adults with sepsis and hypotension: a randomized clinical trial. JAMA. 2017;318(13):1233–40.
- Investigators P, et al. Early, goal-directed therapy for septic shock – a patient-level meta-analysis. N Engl J Med. 2017;376(23):2223–34.
- Rochwerg B, Alhazzani W, Sindi A, Heels-Ansdell D, Thabane L, Fox-Robichaud A, et al. Fluid resuscitation in sepsis: a systematic review and network meta-analysis. Ann Intern Med. 2014;161(5):347–55.
- Hernandez G, Teboul JL. Is the macrocirculation really dissociated from the microcirculation in septic shock? Intensive Care Med. 2016;42(10):1621–4 A review discussing when measures of the macrocirculation (e.g., blood pressure, stroke volume) is indicative or not indicative of microcirculation and the physiologic implications of these relationships.
- Ince C, Mik EG. Microcirculatory and mitochondrial hypoxia in sepsis, shock, and resuscitation. J Appl Physiol (1985). 2016;120(2):226–35.
- Hahn RG, Lyons G. The half-life of infusion fluids: an educational review. Eur J Anaesthesiol. 2016;33(7):475–82.
- Caironi P, Tognoni G, Masson S, Fumagalli R, Pesenti A, Romero M, et al. Albumin replacement in patients with severe sepsis or septic shock. N Engl J Med. 2014;370(15):1412–21.
- Finfer S, Bellomo R, Boyce N, French J, Myburgh J, Norton R, et al. A comparison of albumin and saline for fluid resuscitation in the intensive care unit. N Engl J Med. 2004;350(22):2247–56.
- Annane D, Siami S, Jaber S, Martin C, Elatrous S, Declère AD, et al. Effects of fluid resuscitation with colloids vs crystalloids on mortality in critically ill patients presenting with hypovolemic shock: the CRISTAL randomized trial. JAMA. 2013;310(17):1809–17.
- Patel A, Laffan MA, Waheed U, Brett SJ. Randomised trials of human albumin for adults with sepsis: systematic review and meta-analysis with trial sequential analysis of all-cause mortality. BMJ. 2014;349:g4561.
- Investigators SS, et al. Saline or albumin for fluid resuscitation in patients with traumatic brain injury. N Engl J Med. 2007;357(9):874–84.
- Brunkhorst FM, Engel C, Bloos F, Meier-Hellmann A, Ragaller M, Weiler N, et al. Intensive insulin therapy and pentastarch resuscitation in severe sepsis. N Engl J Med. 2008;358(2):125–39.
- Myburgh JA, Finfer S, Bellomo R, Billot L, Cass A, Gattas D, et al. Hydroxyethyl starch or saline for fluid resuscitation in intensive care. N Engl J Med. 2012;367(20):1901–11.
- Perner A, Haase N, Guttormsen AB, Tenhunen J, Klemenzson G, Åneman A, et al. Hydroxyethyl starch 130/0.42 versus Ringer’s acetate in severe sepsis. N Engl J Med. 2012;367(2):124–34.
- Hebert PC, et al. A multicenter, randomized, controlled clinical trial of transfusion requirements in critical care. Transfusion Requirements in Critical Care Investigators, Canadian Critical Care Trials Group. N Engl J Med. 1999;340(6):409–17.
- Holst LB, Haase N, Wetterslev J, Wernerman J, Guttormsen AB, Karlsson S, et al. Lower versus higher hemoglobin threshold for transfusion in septic shock. N Engl J Med. 2014;371(15):1381–91.
- Magee CA, Bastin MLT, Laine ME, Bissell BD, Howington GT, Moran PR, et al. Insidious harm of medication diluents as a contributor to cumulative volume and hyperchloremia: a prospective, openlabel, sequential period pilot study. Crit Care Med. 2018;46(8):1217–23.
- Self WH, Semler MW, Wanderer JP, Wang L, Byrne DW, Collins SP, et al. Balanced crystalloids versus saline in noncritically ill adults. N Engl J Med. 2018;378(9):819–28 A landmark study that demonstrated increased acute kidney injury associated with the use of 0.9% saline compared to balanced, buffered salt solutions in non-critically ill patients.
- • Semler MW, Self WH, Wanderer JP, Ehrenfeld JM, Wang L, Byrne DW, et al. Balanced crystalloids versus saline in critically ill adults. N Engl J Med. 2018;378(9):829–39 A landmark study that demonstrated increased adverse kidney events associated with the use of 0.9% saline compared to balanced, buffered salt solutions in criticially ill patients.
- Dalton C, Why did sterile salt water become the IV fluid of choice?, NPR. 2018: https://www.npr.org/sections/health-shots/2018/03/31/597666140/why-did-sterile-salt-waterbecome-the-iv-fluid-of-choice. accessed 2/4/2018.
- Young P, Bailey M, Beasley R, Henderson S, Mackle D, McArthur C, et al. Effect of a buffered crystalloid solution vs saline on acute kidney injury among patients in the intensive care unit: the SPLIT randomized clinical trial. JAMA. 2015;314(16):1701–10.a

BÌNH LUẬN