BS. Đặng Thanh Tuấn – BV Nhi Đồng 1 dịch
Theo dõi áp lực đường thở là cần thiết khi thở máy trong hội chứng nguy kịch hô hấp cấp tính (ARDS), ngay cả khi một số phế nang không thông với đường thở trung tâm trong thời gian làm thủ thuật tắc đường thở. Áp lực cao nguyên và áp lực đẩy tạo thành các mục tiêu có thể có đối với các cài đặt thông khí và đã được chứng minh là có tương quan chặt chẽ với tỷ lệ tử vong (1). Tuy nhiên, các bác sĩ lâm sàng cần lưu ý những tình huống mà áp lực đường thở tĩnh hoàn toàn không phản ánh áp lực phế nang (2). Trong trường hợp áp lực dương cuối kỳ thở ra nội tại (intrinsic PEEP), hoặc tự động PEEP (auto-PEEP), cần phải thực hiện thủ thuật tắc nghẽn cuối kỳ thở ra (end-expiratory occlusion maneuver) để tiết lộ áp lực phế nang thực tại cuối kỳ thở ra (3– 5). Trong trường hợp đóng đường thở, được cho là làm gián đoạn hoàn toàn thông tin liên lạc giữa cửa đường thở gần với các cấu trúc phế nang xa và/hoặc đường thở nhỏ, một số phế nang có thể vẫn phồng lên nhưng không thông với đường thở gần. Auto-PEEP, được đo bằng thủ thuật tắc nghẽn, sẽ đưa ra ước tính sai lệch về áp lực phế nang trung bình khi có đóng đường thở. Tương tự như vậy, sự bơm phồng (insufflation) sẽ chỉ xảy ra khi đường thở đã đóng được mở lại. Có ý kiến cho rằng việc đóng đường thở xảy ra ở bệnh nhân béo phì (6, 7), bệnh nhân bị hen suyễn (8), hoặc khi PEEP thấp được sử dụng trong ARDS (9). Cho đến nay, đây vẫn chưa được coi là một hiện tượng liên quan cần được đo lường trong ARDS.
Trong một nghiên cứu đang diễn ra, trong đó chúng tôi đo các đường cong áp lực – thể tích (P – V) với lưu lượng thấp ở các mức PEEP khác nhau để ước tính huy độngphế nang trong ARDS (10, 11), chúng tôi nhận thấy tỷ lệ đóng đường thở cao bất ngờ. Điều quan trọng, chúng tôi nhận ra rằng chúng tôi đã hoàn toàn bỏ sót việc đóng đường thở nếu không đo các đường cong P – V ở PEEP thấp. Ở đây, chúng tôi mô tả tám bệnh nhân có hiện tượng này với áp lực mở đường thở (AOP, airway opening pressure) cao hơn 5 cm H2O. Bằng cách so sánh đường cong P – V của hệ thống hô hấp của bệnh nhân với độ giãn nở của bộ dây máy thở, chúng tôi chứng minh thực tế của hiện tượng này.
PHƯƠNG PHÁP
Là một phần của nghiên cứu về huy động phế nang (https://clinicaltrials.gov, NCT0245 7741), chúng tôi đo đường cong P – V bơm phồng ở lưu lượng thấp (5 L/phút) ở các mức PEEP khác nhau ở 30 bệnh nhân có ARDS trung bình/nặng do do các nguyên nhân khác nhau và đang được dùng thuốc an thần sâu và thuốc chẹn thần kinh cơ.
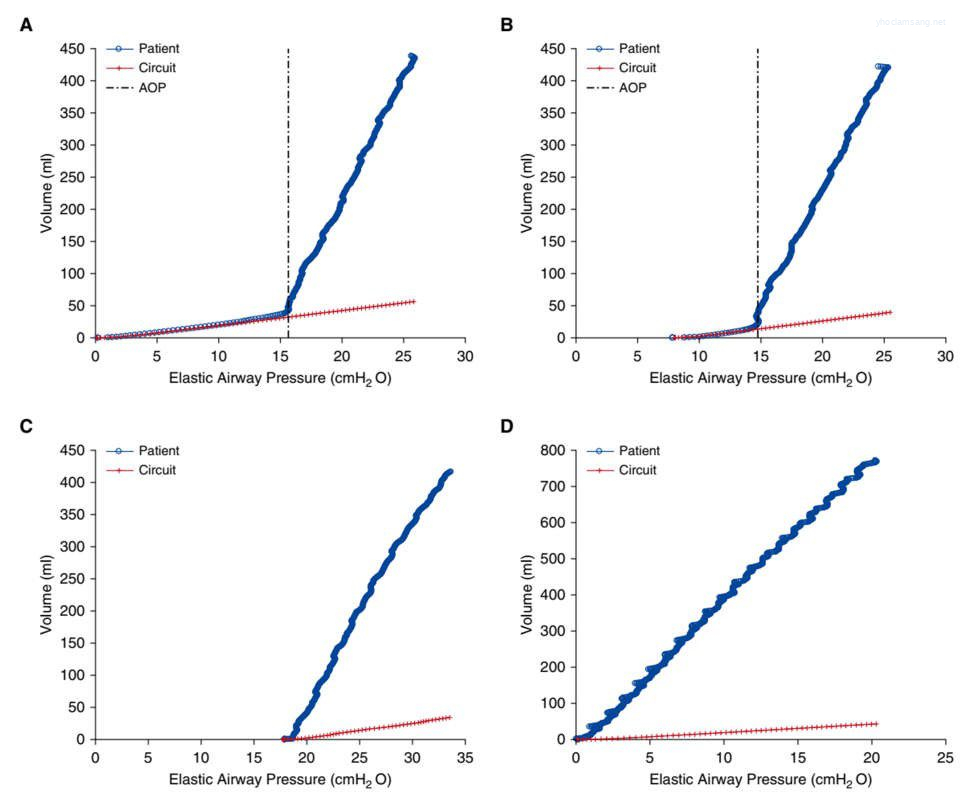
Hình 1. Đường cong áp lực – thể tích bơm phồng lưu lượng thấp thu được từ hai bệnh nhân (đường màu xanh lam với điểm đánh dấu vòng tròn) và được đo trong thử nghiệm với một bộ dây máy thở bị tắc (đường màu đỏ có dấu cộng). Các đường cong A, B và C thu được từ bệnh nhân số 4 ở PEEP là 0, 8 và 18 cm H2O tương ứng. Đường cong D thu được từ bệnh nhân # 27 ở PEEP là 0 cm H2O của (bệnh nhân không đóng đường thở, không được mô tả trong Bảng 1). Chúng tôi định nghĩa áp lực mở đường thở (AOP) là áp lực đường thở đàn hồi tại đó thể tích khí cung cấp cho bệnh nhân lớn hơn 4 ml so với thể tích nén trong bộ dây thở bị tắc và lớn hơn PEEP 1 cm H2O. Sự hiện diện của AOP cho thấy sự đóng toàn bộ đường thở (A và B). Ngược lại, ở C và D, bơm phồng phổi (tức là thể tích khí được cung cấp nhiều hơn thể tích khí bị nén) bắt đầu ngay lập tức khi áp lực đường thở chỉ tăng thêm ≤ 1 cm H2O trên PEEP, cho thấy rằng đường thở vẫn mở ở cuối thì thở ra.
Tất cả các bệnh nhân được thở máy ở chế độ kiểm soát thể tích với thể tích khí lưu thông là 6 ml/kg trọng lượng cơ thể dự đoán. Cả lưu lượng và áp lực đều được đo lưu lượng bằng bộ chuyển đổi chênh lệch áp lực tại nối chữ Y. Lưu lượng và áp lực đã được hiệu chuẩn trước khi thu được các phép đo và không khí rò rỉ đã được loại trừ thông qua thủ thuật tắc nghẽn cuối thì hít vào kéo dài 6 giây. Đường cong P – V (Hình 1) được bắt đầu sau khi thở ra kéo dài (15–20 giây) để giảm thiểu PEEP tự động. Kỹ thuật lưu lượng thấp được sử dụng để giảm thiểu thành phần sức cản của áp lực đường thở, do đó cho phép ước lượng rất gần về áp lực đàn hồi (12). Độ giãn nở của bộ dây máy thở ở các mức PEEP khác nhau được đo bằng các đường cong P – V trong một thử nghiệm. Tất cả các bản ghi được xử lý, phân tích và vẽ biểu đồ tự động với việc sử dụng một chương trình tùy chỉnh trong MATLAB (The MathWorks, Natick, MA). Chúng tôi xác định chính xác AOPs bằng cách so sánh đường cong P – V của bộ dây máy thở với đường cong P – V của hệ hô hấp của bệnh nhân (Hình 1).
KẾT QUẢ
Phần lớn trong số 30 bệnh nhân (73%, số liệu không được hiển thị) biểu hiện mối quan hệ P – V cổ điển, với sự gia tăng dần dần cả về thể tích và áp lực kể từ khi bắt đầu cung cấp khí. Độ dốc của đường cong P – V lưu lượng thấp ở những bệnh nhân này cao hơn nhiều so với độ giãn nở của bộ dây (Hình 1). Tuy nhiên, ở 8 trong số 30 bệnh nhân, phần ban đầu của đường cong P – V bắt đầu từ PEEP thấp có độ dốc cực kỳ thấp, tương ứng với độ giãn nở của bộ dây máy thở (độ dốc của đường cong màu đỏ trong Hình 1, ∼2,4 ml/cm H2O). Sau đó, độ dốc đột ngột thay đổi trên một mức AOP nhất định, tương đối không đổi ở các mức PEEP khác nhau (Hình 1A và 1B). Khi PEEP cao hơn AOP, hình dạng của đường cong trông gần như tuyến tính, không có độ uốn (Hình 1C). Điều quan trọng là ở bảy trong số tám bệnh nhân này, PEEP tổng số, được đo với tắc nghẽn đường thở cuối kỳ cổ điển, về cơ bản thấp hơn đáng kể so với AOP (Bảng 1).
Bảng 1. Đặc điểm và cơ học hô hấp của bệnh nhân bị đóng đường thở vào ngày nghiên cứu

THẢO LUẬN
Dữ liệu của chúng tôi cho thấy rằng khoảng một phần tư đến một phần ba số bệnh nhân ARDS vừa/nặng đang được thở máy có kiểm soát, đường thở sẽ đóng hoàn toàn cho đến khi đạt được AOP đủ cao. Mặc dù AOP ở mức cao, việc đóng đường thở hoàn toàn không thể xảy ra ở đầu giường. Một kỹ thuật ghi cẩn thận, chẳng hạn như kỹ thuật được mô tả ở đây, phải được thực hiện để phát hiện nó. Do đường thở bị đóng hoàn toàn, không có phế nang nào thông với đường thở trung tâm. Áp lực đường thở rất khác với áp lực phế nang, ngay cả trong thủ thuật tắc nghẽn cuối kỳ thở ra. Điều này có thể gây hiểu lầm đáng kể cho bác sĩ lâm sàng.
AOP lớn hơn đáng kể so với tổng PEEP được đo bằng tắc bộ dây máy thở cuối kỳ thở ra. Mặc dù rất khó để đảm bảo rằng mức độ đóng đường thở giống nhau ở mỗi nhịp thở trong nhịp hô hấp bình thường, các đường cong P – V lưu lượng thấp được đo ngay sau khi bơm phồng phổi trước đó ở hai bệnh nhân của chúng tôi, tức là không thở ra kéo dài, cho thấy AOP cao như nhau.
Trước đây, hiện tượng này chưa được xác định rõ ràng và thường được hiểu là auto-PEEP, như một điểm uốn thấp, hoặc thậm chí là ngưỡng áp lực đường thở vượt quá áp lực màng phổi vùng thấp nhất mà tại đó áp lực xuyên phổi vùng sẽ trở thành dương. Áp lực mở đường thở có thể được quan sát trên đường cong P – V trong phổi chó đã cắt ra khỏi cơ thể (13) độc lập với cơ học thành ngực hoặc màng phổi. Điều thú vị là áp lực mở này được quan sát thấy trong phổi chứa đầy không khí, nhưng không phải trong phổi chứa đầy chất lỏng (13), có thể là do loại bỏ sức căng bề mặt phát triển tại bề mặt phân cách chất lỏng – khí. Đáng chú ý, cả phổi chứa đầy chất lỏng và phổi chứa đầy không khí đều có lực đàn hồi mô hướng vào trong như nhau và áp lực xuyên phổi như nhau (bằng áp lực khí quyển). Do đó, áp lực mở, trong thí nghiệm cổ điển của Mead (13), không phải là áp lực vượt qua lực đàn hồi mô phổi cũng không phải là áp lực vượt qua áp lực màng phổi tăng cao. Người ta cũng có thể tham khảo phần trình diễn ấn tượng của Hubmayr (14) về áp lực mở cao trong thùy đuôi của chuột là kết quả của giao diện lỏng – khí. Hơn nữa, chụp cắt lớp vi tính được thực hiện cho mục đích lâm sàng ở bệnh nhân của chúng tôi không cho thấy phổi xẹp hoàn toàn, xác nhận rằng vị trí đóng lại là đường thở chứ không phải phế nang. Thực tế là một số bộ phận của phổi vẫn còn căng phồng cho thấy áp lực xuyên phế nang khu vực ở những bộ phận này vẫn dương (nghĩa là áp lực phế nang vẫn lớn hơn áp lực màng phổi ở những vùng này). Do đó, chúng tôi nghĩ rằng áp lực mở mà chúng tôi quan sát được ở bệnh nhân không thể giải thích đơn giản bằng việc tạo ra áp lực xuyên phế nang vùng dương đối với bơm phồng phổi. Chúng tôi thậm chí còn tìm thấy một số dấu vết cho thấy áp lực phế nang có thể thấp hơn AOP, tương tự như hiện tượng tuyết lở được mô tả bởi Suki và các đồng nghiệp (15). Tích hợp những phát hiện này, chúng tôi lý do rằng AOP có thể là một ngưỡng áp lực đường thở cần thiết để vượt qua sức căng bề mặt và phá vỡ các phân đoạn chất lỏng trong phế quản.
Áp lực màng phổi tăng cao hoặc thành ngực có khối lượng lớn (ví dụ, do béo phì) có thể ép phổi đến một thể tích mà tại đó chất lỏng làm tắc nghẽn rộng rãi đường thở và do đó tạo điều kiện cho việc đóng đường thở. Chúng tôi cũng đo áp lực xuyên phổi ở 24 bệnh nhân của chúng tôi bằng một ống thông thực quản tại chỗ. Áp lực xuyên phổi cuối kỳ thở ra ở mức PEEP thấp nhất (thường bằng không) ở năm bệnh nhân đóng đường thở không khác biệt đáng kể so với áp lực thu được ở 19 bệnh nhân không đóng đường thở (−13 ± 6 so với −9 ± 5 cm H2O, P = 0,227). Khi đường thở mở lại ở AOP, áp lực xuyên phổi thay đổi từ -6 đến 4 cm H2O ở các bệnh nhân.
Bỏ qua hiện tượng đóng đường thở này có thể gây ra những ảnh hưởng lâm sàng liên quan. Đầu tiên, các phép đo áp lực đường thở khi cuối thì thở ra sẽ bị sai lệch, dẫn đến việc tính toán sai lệch về áp lực đẩy. Thứ hai, nguy cơ tổn thương phổi do máy thở, bao gồm tổn thương tiểu phế quản do đóng và mở đường thở xa nhiều lần, sẽ tăng lên nếu PEEP được đặt thấp hơn AOP (16). Thứ ba, sự phát triển của xẹp phổi khử nitơ có thể xảy ra ở những vùng chỉ được mở lại không liên tục (9). Điều này có thể giải thích lợi ích của PEEP cao hoặc của các thủ thuật huy động được đề xuất ở một số bệnh nhân.
Chúng tôi tin rằng hiện tượng này đã bị bỏ qua trong nhiều năm. Dữ liệu sơ bộ mới của chúng tôi hỗ trợ đánh giá lại cẩn thận việc đóng đường thở trong quản lý bệnh nhân ARDS.
TÀI LIỆU THAM KHẢO
Amato MB, Meade MO, Slutsky AS, Brochard L, Costa EL, Schoenfeld DA, Stewart TE, Briel M, Talmor D, Mercat A, et al. Driving pressure and survival in the acute respiratory distress syndrome. N Engl J Med 2015;372:747–755.
Loring SH, Topulos GP, Hubmayr RD. Transpulmonary pressure: the importance of precise definitions and limiting assumptions. Am J Respir Crit Care Med 2016;194:1452–1457.
Pepe PE, Marini JJ. Occult positive end-expiratory pressure in mechanically ventilated patients with airflow obstruction: the auto-PEEP effect. Am Rev Respir Dis 1982;126:166–170.
Koutsoukou A, Bekos B, Sotiropoulou C, Koulouris NG, Roussos C, Milic-Emili J. Effects of positive endexpiratory pressure on gas exchange and expiratory flow limitation in adult respiratory distress syndrome. Crit Care Med 2002;30:1941–1949.
Vieillard-Baron A, Prin S, Schmitt JM, Augarde R, Page B, Beauchet A, Jardin F. Pressure-volume curves in acute respiratory distress syndrome: clinical demonstration of the influence of expiratory flow limitation on the initial slope. Am J Respir Crit Care Med 2002;165:1107–1112.
Behazin N, Jones SB, Cohen RI, Loring SH. Respiratory restriction and elevated pleural and esophageal pressures in morbid obesity. J Appl Physiol 1985;2010:212–218.
Loring SH, Behazin N, Novero A, Novack V, Jones SB, O’Donnell CR, Talmor DS. Respiratory mechanical effects of surgical pneumoperitoneum in humans. J Appl Physiol 1985;2014:1074–1079.
Leatherman JW, Ravenscraft SA. Low measured auto-positive end-expiratory pressure during mechanical ventilation of patients with severe asthma: hidden auto-positive end-expiratory pressure. Crit Care Med 1996;24:541–546.
Derosa S, Borges JB, Segelsjo M, Tannoia A, Pellegrini M, Larsson A, Perchiazzi G, Hedenstierna G. Reabsorption atelectasis in a porcine model of ARDS: regional and temporal effects of airway closure, oxygen, and distending pressure. J Appl Physiol 1985;2013:1464–1473.
Richard JC, Maggiore SM, Jonson B, Mancebo J, Lemaire F, Brochard L. Influence of tidal volume on alveolar recruitment. Respective role of PEEP and a recruitment maneuver. Am J Respir Crit Care Med 2001;163:1609– 1613.
Ranieri VM, Eissa NT, Corbeil C, Chassé M, Braidy J, Matar N, Milic-Emili J. Effects of positive end-expiratory pressure on alveolar recruitment and gas exchange in patients with the adult respiratory distress syndrome. Am Rev Respir Dis 1991;144:544–551.
Jonson B, Richard JC, Straus C, Mancebo J, Lemaire F, Brochard L. Pressure-volume curves and compliance in acute lung injury: evidence of recruitment above the lower inflection point. Am J Respir Crit Care Med 1999;159:1172–1178.
Mead J, Whittenberger JL, Radford EP Jr. Surface tension as a factor in pulmonary volume-pressure hysteresis. J Appl Physiol 1957;10:191–196.
Hubmayr RD. Perspective on lung injury and recruitment: a skeptical look at the opening and collapse story. Am J Respir Crit Care Med 2002;165:1647–1653.
Suki B, Barabási AL, Hantos Z, Peták F, Stanley HE. Avalanches and power-law behaviour in lung inflation. Nature 1994;368:615–618.
Tsuchida S, Engelberts D, Peltekova V, Hopkins N, Frndova H, Babyn P, McKerlie C, Post M, McLoughlin P, Kavanagh BP. Atelectasis causes alveolar injury in nonatelectatic lung regions. Am J Respir Crit Care Med 2006;174:279–289.

BÌNH LUẬN