Tăng triglycerid máu là một tình trạng lâm sàng phổ biến thường được xác định ở những người có hồ sơ lipid như một phần của đánh giá nguy cơ tim mạch. Chủ đề này đánh giá việc quản lý tăng triglycerid máu.
Tác giả: Robert S Rosenson, MDRobert H Eckel, MD; Dịch: Bs.Ths. Lê Đình Sáng.
Nguồn: Uptodate, ngày cập nhật 04.1.2024
MỤC TIÊU ĐIỀU TRỊ
Do mối liên quan giữa tăng triglycerid máu với viêm tụy và bệnh tim mạch do xơ vữa động mạch (ASCVD), mục tiêu điều trị bệnh nhân tăng triglycerid máu là giảm nguy cơ mắc cả hai loại tình trạng, mặc dù bằng chứng về hiệu quả giảm triglycerid (TG) còn hạn chế:
●Giảm nguy cơ viêm tụy – Giảm nồng độ TG huyết thanh (hoặc huyết tương) là biện pháp chính để phòng ngừa viêm tụy cấp, vì nguy cơ viêm tụy tăng dần khi nồng độ TG trên 500 mg/dL (5,6 mmol/L), với nguy cơ tăng rõ rệt ở những bệnh nhân bị viêm tụy cấp gần đây.
Trong khi các biện pháp can thiệp hạ lipid máu dùng thuốc và không dùng thuốc có thể làm giảm đáng kể nồng độ TG, thì chỉ có bằng chứng hạn chế về hiệu quả của các liệu pháp hạ lipid trong việc giảm nguy cơ viêm tụy ở những người bị tăng triglycerid máu.
●Giảm nguy cơ ASCVD – Hiệu quả của việc giảm TG trong việc giảm nguy cơ ASCVD chưa được thiết lập, trái ngược với việc giảm nguy cơ ASCVD được xác định bằng việc giảm cholesterol lipoprotein mật độ thấp (LDL-C).
Ngoài ra, nồng độ LDL-C có thể đánh giá thấp nguy cơ tim mạch ở bệnh nhân tăng triglycerid máu. Mức TG cao có liên quan đến các hạt LDL nhỏ, dày đặc, bị suy giảm cholesterol mà phép đo LDL-C có thể không thu được. Nồng độ cholesterol lipoprotein mật độ không cao (không phải HDL-C) và apolipoprotein B là thước đo tốt hơn về nồng độ dư thừa của lipoprotein gây xơ vữa ở bệnh nhân tăng triglycerid máu vừa và nặng.
•Giảm LDL-C – Vì bệnh nhân tăng triglycerid máu thường là ứng cử viên cho việc giảm LDL-C để giảm nguy cơ bệnh xơ vữa động mạch, điều trị tối ưu LDL-C là nền tảng điều trị cho những bệnh nhân này.
Các thuốc hạ LDL-C (như statin và ezetimibe) thường có tác dụng hạ TG nhẹ hoặc trung bình (bảng 1).
•Nhắm mục tiêu mức TG – Cơ chế tăng triglycerid máu có liên quan đến tăng nguy cơ bệnh xơ vữa động mạch chưa được biết rõ; do đó, việc nhắm mục tiêu mức TG để giảm nguy cơ ASCVD là một vấn đề. Bằng chứng về hiệu quả của các nhóm thuốc làm giảm TG còn mâu thuẫn nhau, như được thảo luận dưới đây. Các nghiên cứu liên quan đã được thực hiện trong nhiều thập kỷ và bao gồm các biện pháp can thiệp và so sánh khác nhau; ví dụ, các nghiên cứu ban đầu không liên quan đến bệnh nhân dùng statin. Một lời giải thích cho khó khăn trong việc chứng minh lợi ích lâm sàng của việc giảm TG có thể là mức TG không liên quan trực tiếp đến sự phát triển và tác động lâm sàng của chứng xơ vữa động mạch. Khi chúng ta điều trị để giảm mức TG, việc điều trị có thể làm giảm kích thước và số lượng các hạt lipoprotein mật độ rất thấp (VLDL) mang TG và ở mức độ thấp hơn là cholesterol, và do đó, cả hai giá trị đều giảm.
Như được thảo luận dưới đây, có bằng chứng cho thấy rằng axit béo omega-3 biển có độ tinh khiết cao ở liều cao (cụ thể là icosapent ethyl) làm giảm nguy cơ tim mạch, nhưng lợi ích lâm sàng này không liên quan đến mức độ giảm TG.
BIỆN PHÁP ĐIỀU TRỊ CHUNG
Việc quản lý tất cả những người bị tăng triglycerid máu bao gồm điều chỉnh lối sống và quản lý LDL-C, non-HDL-C và apolipoprotein B như được chỉ ra trong đánh giá nguy cơ ASCVD.
Quản lý bổ sung dựa trên mức độ tăng nồng độ TG và các yếu tố lâm sàng (các yếu tố nguy cơ viêm tụy và bệnh xơ vữa động mạch trước đó), như được thảo luận dưới đây.
Các biện pháp chung đầu tiên sau đây áp dụng cho tất cả bệnh nhân tăng triglycerid máu [1].
Giải quyết các nguyên nhân có thể điều chỉnh được
Vì tăng triglycerid máu thường được gây ra hoặc làm trầm trọng thêm bởi các rối loạn có thể điều trị được [2,3], nên cần giải quyết các tình trạng và yếu tố có thể gây ra hoặc làm trầm trọng thêm tình trạng tăng triglycerid máu. Đối với bệnh nhân tiểu đường không kiểm soát được, cải thiện kiểm soát đường huyết là liệu pháp đầu tay. Nên tránh các loại thuốc làm tăng nồng độ TG huyết thanh.
Các biện pháp không dùng thuốc
Các biện pháp không dùng thuốc hàng đầu bao gồm:
●Việc quản lý các yếu tố nguy cơ bệnh xơ vữa động mạch được chỉ định, bao gồm tối ưu hóa việc quản lý bệnh tăng huyết áp, cai thuốc lá và giải quyết lối sống ít vận động [1-5]. Các khuyến nghị bao gồm hoạt động aerobic thường xuyên (ít nhất 150 phút/tuần hoạt động với cường độ vừa phải, 75 phút/tuần với hoạt động cường độ mạnh hoặc kết hợp tương đương cả hai) [1].
●Giảm cân từ 5 đến 10 phần trăm trọng lượng cơ thể thường được khuyến nghị cho những bệnh nhân có TG tăng cao [1], mặc dù trọng lượng mục tiêu nên được cá nhân hóa cho từng bệnh nhân.
●Các khuyến nghị cụ thể về chế độ ăn uống và uống rượu khác nhau tùy thuộc vào mức độ tăng triglycerid máu và tiền sử viêm tụy, như được thảo luận dưới đây.
Đánh giá và điều trị LDL-C
Bệnh nhân tăng triglycerid máu nên được đánh giá về nguy cơ tim mạch do xơ vữa động mạch và mức độ LDL-C. Mức LDL-C trên mục tiêu được điều trị theo khuyến nghị tiêu chuẩn (thường bao gồm cả statin).
Trong khi mục tiêu chính của liệu pháp giảm LDL-C là giảm nguy cơ bệnh xơ vữa động mạch, thì hầu hết các loại thuốc hạ LDL-C cũng làm giảm mức TG lúc đói (bảng 1). Statin thường làm giảm mức TG từ 5 đến 15%; tuy nhiên, liệu pháp statin cường độ cao có thể làm giảm mức TG từ 25 đến 30% ở những bệnh nhân có mức TG lúc đói <400 mg/dL. Mức giảm TG lớn hơn 40% đã được báo cáo ở những bệnh nhân có mức TG lúc đói cao tới 800 mg/dL khi điều trị bằng statin cường độ cao từ trung bình đến cao (atorvastatin 80 mg mỗi ngày, rosuvastatin 20 hoặc 40 mg). mỗi ngày) [6,7]. Ezetimibe làm giảm mức TG khoảng 7 đến 8% và chất ức chế proprotein Convertase subtilisin/kexin loại 9 (PCSK9) làm giảm mức TG lúc đói từ 2 đến 23%. Axit Bempedoic không có tác dụng hạ TG [8].
ĐIỀU TRỊ BỔ SUNG DỰA TRÊN MỨC ĐỘ TG
Liệu pháp bổ sung ngoài phương pháp chung dựa trên mức TG cũng như tiền sử viêm tụy trước đó. Nhằm mục đích quản lý, chúng tôi phân loại nồng độ TG lúc đói theo các tiêu chí sau (chuyển từ mg/dL sang mmol/L, chia cho 88,5):
●Bình thường: <150 mg/dL (<1,7 mmol/L)
●Tăng triglycerid máu vừa phải: 150 đến 499 mg/dL (1,7 đến 5,6 mmol/L)
●Tăng triglycerid máu từ trung bình đến nặng: 500 đến 999 mg/dL (5,65 đến 11,3 mmol/L)
●Tăng triglycerid máu nặng: ≥1000 mg/dL (≥11,3 mmol/L)
Một định nghĩa nghiêm ngặt hơn về tăng triglycerid máu là mức TG lúc đói > 200 mg/dL mà không kèm theo tăng LDL-C (có hoặc không có điều trị bằng statin), vì bằng chứng hạn chế cho thấy lợi ích tim mạch của fibrate và axit béo omega biển trong bối cảnh này. Điều này dựa trên các phân tích dưới nhóm về tỷ lệ TG và TG/HDL-C trong huyết tương trong các thử nghiệm ngẫu nhiên có đối chứng, trong đó fibrate và axit béo omega-3 (đặc biệt là icosapent ethyl) có thể có một số tác dụng có lợi đối với nguy cơ mắc bệnh tim mạch [9,10] . Ngược lại, đối với những bệnh nhân có nồng độ TG từ 150 đến 200 mg/dL và tăng LDL-C, điều trị bằng statin liều trung bình đến cao sẽ điều trị tình trạng tăng LDL-C và thường làm giảm nồng độ TG xuống mức bình thường (<150 mg/ dL hoặc 1,7 mmol/L).
Tăng triglycerid máu vừa phải — Đối với những bệnh nhân tăng triglycerid máu vừa phải (150 đến 499 mg/dL; 1,7 đến 5,6 mmol/L), phương pháp sau đây được áp dụng (thuật toán 1) ngoài các biện pháp chung được mô tả ở trên (xem ‘Các biện pháp chung’ ở trên). Ở những bệnh nhân tăng triglycerid máu vừa phải, sau 4 đến 12 tuần áp dụng các biện pháp chung, chúng tôi đánh giá nhu cầu điều trị hạ TG thêm. Mục tiêu chính của điều trị cho phạm vi TG này là giảm nguy cơ mắc bệnh ASCVD vì những bệnh nhân này thường không cần điều trị để giảm nguy cơ viêm tụy.
●Sửa đổi lối sống
•Chế độ ăn uống – Quản lý chế độ ăn uống nên tập trung vào việc đạt được và duy trì cân nặng khỏe mạnh và giảm lượng carbohydrate đơn giản, đặc biệt là thực phẩm và đồ uống có hàm lượng đường huyết cao và nhiều fructose (bảng 2) với mục tiêu <6% lượng calo đường bổ sung và 30 tới 35% lượng calo trong tổng lượng chất béo. Chất béo trong chế độ ăn không phải là nguồn chính tạo ra TG gan và chế độ ăn nhiều chất béo không làm tăng nồng độ TG huyết tương lúc đói ở hầu hết mọi người. Tuy nhiên, nên thay đổi loại chất béo (tức là giảm chất béo bão hòa so với chất béo không bão hòa đa và không bão hòa đơn) [11]. Chúng tôi đề nghị tăng cường tiêu thụ cá có chứa lượng axit béo omega-3 cao (bảng 3).
•Sử dụng rượu – Đối với những bệnh nhân tăng triglycerid máu vừa phải (không có tiền sử viêm tụy), chúng tôi khuyên nên hạn chế uống rượu không quá hai ly mỗi ngày ở nam và không quá một ly mỗi ngày đối với nữ. Tác động của việc uống rượu vừa phải ở bệnh nhân tăng triglycerid máu vừa phải ít rõ ràng hơn so với tăng triglycerid máu nặng và tác động lên nồng độ TG có thể bị hạn chế [12]. Tuy nhiên, uống rượu là nguồn cung cấp lượng calo dư thừa thường bị đánh giá thấp và có thể làm suy yếu nỗ lực giảm cân.
Nên tránh uống rượu cho những bệnh nhân bị viêm tụy do tăng triglycerid máu trước đó.
●Đánh giá và điều trị mức độ LDL-C như đã thảo luận ở trên.
●Liệu pháp bổ sung dựa trên nguy cơ bệnh xơ vữa động mạch – Trong bối cảnh này, “nguy cơ bệnh xơ vữa động mạch cao” được định nghĩa là bệnh xơ vữa động mạch hoặc đái tháo đường đã xác định cộng với hai yếu tố nguy cơ bệnh xơ vữa động mạch bổ sung (tuổi ≥50, hút thuốc lá, tăng huyết áp, HDL-C ≤40 mg/dL đối với nam giới hoặc 50 mg/dL đối với nữ giới, protein phản ứng C có độ nhạy cao [hs-CRP] >3 mg/L [0,3 mg/dL], độ thanh thải creatinine <60 mL/phút, bệnh võng mạc, albumin niệu vi thể hoặc đại thể, và chỉ số cổ chân-cánh tay [ABI] <0,9).
•Đối với những bệnh nhân có nguy cơ mắc bệnh ASCVD cao – Đối với những bệnh nhân có nguy cơ mắc bệnh ASCVD cao có mức TG vẫn >150 mg/dL sau khi can thiệp lối sống và liệu pháp tối ưu để giảm LDL-C, chúng tôi khuyên bạn nên điều trị bằng axit béo omega-3 biển liều cao. Đối với chỉ định này, chúng tôi khuyên dùng icosapent ethyl hơn là các axit béo omega-3 biển khác.
•Đối với bệnh nhân không có nguy cơ mắc bệnh ASCVD cao – Đối với bệnh nhân không có nguy cơ mắc bệnh ASCVD cao, việc quản lý tập trung vào việc tiếp tục các biện pháp chung nêu trên bao gồm điều chỉnh lối sống và tối ưu hóa điều trị LDL-C.
Tăng triglycerid máu từ trung bình đến nặng — Đối với những bệnh nhân tăng triglycerid máu từ trung bình đến nặng (500 đến 999 mg/dL; 5,65 đến 11,3 mmol/L), phương pháp sau đây được áp dụng (thuật toán 1) ngoài các biện pháp chung được mô tả ở trên. Mục tiêu của liệu pháp điều trị cho phạm vi TG này là giảm nguy cơ mắc bệnh ASCVD và viêm tụy. Tuy nhiên, các thử nghiệm ngẫu nhiên về thuốc hạ TG chủ yếu tập trung vào kết quả bệnh xơ vữa động mạch và có rất ít bằng chứng về tác dụng của thuốc hạ TG đối với nguy cơ viêm tụy.
●Sửa đổi lối sống
•Chế độ ăn uống – Quản lý chế độ ăn uống nên tập trung vào việc đạt được và duy trì cân nặng khỏe mạnh, giảm lượng carbohydrate đơn giản, đặc biệt là thực phẩm và đồ uống có hàm lượng đường huyết cao và nhiều fructose (bảng 2), với mục tiêu <5% lượng calo bổ sung từ đường, và hạn chế tổng lượng chất béo trong chế độ ăn uống ở mức 20 đến 25 phần trăm calo [1]. Nên thay đổi loại chất béo (tức là giảm chất béo bão hòa so với chất béo không bão hòa đa và không bão hòa đơn) [11]. Chúng tôi đề nghị tăng cường tiêu thụ cá có chứa lượng axit béo omega-3 cao (bảng 3).
•Sử dụng rượu – Đối với những bệnh nhân tăng triglycerid máu từ trung bình đến nặng (có hoặc không có viêm tụy trước đó), chúng tôi khuyên nên kiêng uống rượu [1]. Trong trường hợp này, rượu có thể làm tăng bài tiết VLDL-TG và làm tăng thêm nồng độ TG, điều này có thể thúc đẩy viêm tụy.
●Đánh giá và điều trị mức độ LDL-C như đã thảo luận ở trên. (Xem ‘Các biện pháp chung’ ở trên.)
●Liệu pháp bổ sung – Đối với những bệnh nhân tăng triglycerid máu từ trung bình đến nặng (500 đến 999 mg/dL; 5,65 đến 11,3 mmol/L) mặc dù đã áp dụng các biện pháp trên, liệu pháp sau đây sẽ được bổ sung.
Trong bối cảnh này, “nguy cơ bệnh xơ vữa động mạch cao” được định nghĩa là bệnh xơ vữa động mạch hoặc đái tháo đường cộng với hai yếu tố nguy cơ bệnh xơ vữa động mạch bổ sung (tuổi ≥50, hút thuốc lá, tăng huyết áp, HDL-C ≤40 mg/dL đối với nam giới hoặc ≤50 mg/dL đối với nữ, hs-CRP >3,00 mg/L [0,3 mg/dL], độ thanh thải creatinine <60 mL/phút, bệnh võng mạc, albumin niệu vi mô hoặc đại thể và ABI <0,9).
•Bệnh nhân có nguy cơ mắc ASCVD cao – Đối với những bệnh nhân có nguy cơ mắc ASCVD cao với mức TG từ 500 đến 999 mg/dL mặc dù đã can thiệp lối sống và điều trị tối ưu để giảm LDL-C, thuốc bổ sung ban đầu được đề xuất là icosapent ethyl .
Đối với những bệnh nhân có mức TG dai dẳng từ 500 đến 999 mg/dL mặc dù đã điều trị bằng icosapent ethyl , chúng tôi khuyên bạn nên bổ sung liệu pháp fibrate.
•Đối với những bệnh nhân không có nguy cơ cao mắc ASCVD – Đối với những bệnh nhân tăng triglycerid máu từ trung bình đến nặng mặc dù đã can thiệp lối sống và điều trị hạ LDL-C tối ưu, thuốc bổ sung ban đầu được đề xuất là fibrate. Liệu pháp Fibrate được bắt đầu sau khi thảo luận về lợi ích và rủi ro với bệnh nhân.
Nếu mức TG vẫn ở mức 500 đến 999 mg/dL mặc dù đã điều trị bằng fibrate, chúng tôi khuyên bạn nên bổ sung liệu pháp bổ sung axit béo omega-3 biển. Trong trường hợp này, có thể sử dụng bất kỳ chế phẩm axit béo omega biển liều cao theo toa nào.
Một cách tiếp cận khác là bắt đầu bằng liệu pháp axit béo omega-3 biển và bổ sung liệu pháp fibrate nếu cần.
Chúng tôi không điều trị thường xuyên cho bệnh nhân tăng triglycerid máu bằng niacin (axit nicotinic) do lợi ích hạn chế và nguy cơ tác dụng phụ (bao gồm cả tình trạng kháng insulin trầm trọng hơn). Đối với những bệnh nhân được chọn bị tăng triglycerid máu từ trung bình đến nặng mặc dù đã can thiệp lối sống, liệu pháp tối ưu để giảm LDL-C, điều trị bằng axit béo omega-3 biển liều cao và liệu pháp fibrate, và ước tính nguy cơ không dung nạp glucose ở mức thấp (nghĩa là không có tiền sử đái tháo đường). hoặc không dung nạp glucose và chỉ số khối cơ thể bình thường hoặc thấp), một số bác sĩ lâm sàng điều trị bằng niacin.
Tăng triglycerid máu nặng – Chúng tôi xác định tăng triglycerid máu nặng là >1000 mg/dL hoặc 11,3 mmol/L. Một số chuyên gia sử dụng điểm cắt thấp hơn (tức là 880 mg/dL hoặc 10 mmol/L) vì nguy cơ viêm tụy cấp tăng đáng kể ở ngưỡng thấp hơn này [13]. Sau đây là cách tiếp cận của chúng tôi đối với những bệnh nhân bị tăng triglycerid máu nặng:
●Sửa đổi lối sống – Những sửa đổi lối sống sau đây được áp dụng cùng với các biện pháp chung ở trên:
•Chế độ ăn uống – Trong bối cảnh này (đặc biệt đối với những người bị viêm tụy cấp trước đó), điều quan trọng là phải hạn chế chất béo trong chế độ ăn ở mức 10 đến 15% (tốt nhất là <5%) tổng lượng calo với mục tiêu giảm mức TG xuống <1000 mg/ dL [1].
Bệnh nhân nên được nhắc nhở rằng ngay cả “chất béo tốt” như dầu thực vật và các loại hạt, cũng như chất béo có trong khoai tây chiên và bánh ngọt, cũng có thể làm tăng mức TG và gây viêm tụy. Ở mức TG lúc đói >500 đến 1000 mg/dL (5,6 đến 11,3 mmol/L), quá trình thanh thải chylomicron trong máu trở nên chậm hơn, do đó chylomicron từ bữa ăn tối hôm trước vẫn có thể hiện diện trong máu lúc đói buổi sáng. Điều này tạo tiền đề cho sự tích tụ chylomicron TG có nguồn gốc từ chất béo trong chế độ ăn uống, dẫn đến nguy cơ viêm tụy và các biểu hiện khác của chứng chylomicron máu lúc đói.
•Sử dụng rượu – Đối với những bệnh nhân tăng triglycerid máu nặng (có hoặc không có viêm tụy trước đó), chúng tôi khuyên nên tránh uống rượu, điều này có thể làm tăng thêm nguy cơ viêm tụy [1].
●Đánh giá và điều trị mức độ LDL-C như mô tả ở trên.
●Nói chung trì hoãn điều trị bằng thuốc đối với tình trạng tăng triglycerid máu – Khi mức TG > 1000 mg/dL, các loại thuốc dùng để hạ TG có hiệu quả hạn chế. Các thuốc này hoạt động chủ yếu bằng cách giảm tổng hợp và bài tiết TG ở gan dưới dạng VLDL-TG và do đó tương đối không hiệu quả khi nồng độ TG tăng cao.
•Đối với hầu hết bệnh nhân – Điều trị bằng thuốc điều trị tăng triglycerid máu (ngoài điều trị LDL-C) được hoãn lại đối với hầu hết bệnh nhân (bao gồm tất cả bệnh nhân ngoại trú) cho đến khi mức TG giảm xuống 1000 mg/dL.
Với tốc độ giảm nhanh chóng mức TG có thể đạt được bằng việc hạn chế chất béo trong chế độ ăn kiêng nghiêm ngặt, với sự theo dõi chặt chẽ, có thể bắt đầu điều trị bằng thuốc điều trị tăng triglycerid máu trong vòng vài ngày.
•Đối với bệnh nhân viêm tụy cấp – Đối với bệnh nhân nội trú bị viêm tụy và tăng triglycerid máu nặng, fibrate là một thành phần trong liệu pháp giảm nồng độ TG cùng với các biện pháp trên. Nhu cầu tiếp tục điều trị bằng fibrate sẽ được đánh giá lại trong quá trình quản lý bệnh nhân ngoại trú tiếp theo.
Viêm tụy trước đó – Đối với bệnh nhân bị viêm tụy do tăng triglycerid máu trước đó, việc quản lý tăng triglycerid máu được mô tả ở trên ngoại trừ khuyến cáo tránh uống rượu, bất kể mức TG hiện tại.
Đối với những bệnh nhân bị viêm tụy cấp tái phát trong khi dùng fibrate và axit béo omega-3, chúng tôi đánh giá các nguyên nhân khác gây viêm tụy, đặc biệt nếu mức TG < 500 mg/dL.
Việc kiểm soát viêm tụy cấp do tăng triglycerid máu sẽ được thảo luận riêng.
THEO DÕI TRỊ LIỆU
Tần suất theo dõi nồng độ TG phụ thuộc vào mức độ nghiêm trọng của tình trạng tăng triglycerid máu.
●Đối với những bệnh nhân tăng triglycerid máu nặng được điều trị bằng chế độ ăn hạn chế chất béo nghiêm ngặt (<5% chất béo trong chế độ ăn mỗi ngày), chúng tôi đo mức TG thường xuyên (ví dụ ba ngày một lần) để hướng dẫn bắt đầu dùng thuốc hạ TG nhanh chóng.
●Đối với những bệnh nhân tăng triglycerid máu ở mức độ trung bình hoặc trung bình đến nặng, chúng tôi thường kiểm tra nồng độ TG từ 6 đến 8 tuần sau khi bắt đầu hoặc thay đổi liệu pháp điều trị bằng thuốc.
Các liệu pháp dùng thuốc và điều chỉnh lối sống khác nhau về mức độ nhanh chóng và hiệu quả của chúng làm giảm mức TG (bảng 1):
●Với mức TG ≥500 đến 1000 mg/dL (5,6 đến 11,3 mmol/L), mức giảm TG lúc đói dự kiến với <5% chất béo trong khẩu phần ăn là 25% mỗi ngày [14].
●Phần lớn sự giảm TG bằng liệu pháp axit béo omega-3 biển được thấy trong hai tuần.
●Phản ứng với fibrate được thấy sớm nhất là sau hai tuần điều trị, với hiệu quả tối đa sau sáu đến tám tuần [15-17].
●Phần lớn phản ứng với niacin (axit nicotinic) được thấy sau hai tuần.
TÁC NHÂN CỤ THỂ
Statin
Lựa chọn thuốc và cách dùng — Việc sử dụng Statin được thảo luận riêng.
Tác dụng của statin – Mặc dù statin được sử dụng chủ yếu để giảm nguy cơ bệnh xơ vữa động mạch, nhưng statin cũng có một số tác dụng hạ TG có thể làm giảm nguy cơ viêm tụy:
●Giảm nguy cơ bệnh xơ vữa động mạch và LDL-C – Ở những bệnh nhân tăng triglycerid máu, mục tiêu chính của liệu pháp statin là giảm nguy cơ bệnh xơ vữa động mạch mặc dù làm giảm LDL-C và có lẽ có tác dụng đa hướng. Tác dụng của statin đối với nguy cơ ASCVD được thảo luận riêng.
●Giảm nguy cơ viêm tụy và TG – Statin thường có tác dụng hạ TG ở mức độ nhẹ đến trung bình (bảng 1), như đã thảo luận ở trên. Có một số bằng chứng cho thấy statin có thể giúp giảm nguy cơ viêm tụy, mặc dù còn thiếu bằng chứng ở những bệnh nhân tăng triglycerid máu từ trung bình đến nặng hoặc nặng. Một phân tích tổng hợp bao gồm 16 thử nghiệm statin với 113.800 người tham gia có mức TG bình thường hoặc tăng triglycerid máu ở mức độ trung bình thấp cho thấy liệu pháp statin có liên quan đến việc giảm nguy cơ viêm tụy so với giả dược hoặc chăm sóc tiêu chuẩn (tỷ lệ nguy cơ [RR] 0,77; 95% CI 0,62-0,97) [18].
Fibrate – Chỉ định điều trị bằng fibrate đã được thảo luận ở trên.
Lựa chọn tác nhân – Khi chọn liệu pháp fibrate, chúng tôi thường thích fenofibrate hơn gemfibrozil vì nó có ít tương tác thuốc hơn, thường được dung nạp tốt hơn và sự tuân thủ của bệnh nhân tốt hơn do dùng liều một lần mỗi ngày. Fenofibrate cũng là fibrate được ưu tiên ở những bệnh nhân cần điều trị kết hợp statin và fibrate [19,20]. Fibrate có liên quan đến độc tính trên cơ [21,22], tác động này rõ rệt hơn ở những bệnh nhân cũng được điều trị bằng statin [23,24]. Gemfibrozil có nguy cơ gây độc cơ cao hơn, đặc biệt khi dùng chung với statin [25]. Quá trình glucuronid hóa, một con đường quan trọng để bài tiết qua thận các statin ưa mỡ, dường như bị ức chế đáng kể bởi gemfibrozil nhưng không bị ức chế bởi fenofibrate [26]. Trong các nghiên cứu lâm sàng, nồng độ statin trong huyết thanh tăng gấp 1,9 đến 5,7 lần ở những đối tượng được điều trị bằng gemfibrozil nhưng không thay đổi ở những đối tượng được điều trị bằng fenofibrate. Trong một thử nghiệm ngẫu nhiên về fenofibrate, tỷ lệ mắc bệnh cơ thấp dù bệnh nhân có dùng statin hay không [27].
Cả fenofibrate và gemfibrozil hiếm khi gây tổn thương gan; Cảnh báo của Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) cảnh báo về khả năng gây tổn thương gan nghiêm trọng khi sử dụng fenofibrate.
Cách dùng — Khi điều trị bằng fibrate, chúng tôi hướng tới mức TG <500 mg/dL (5,6 mmol/L) để giảm thiểu mức tăng lớn (hai đến ba lần) nồng độ TG sau bữa ăn có thể xảy ra sau bữa ăn có chứa chất béo, lượng carbohydrate và/hoặc uống rượu quá mức có thể dẫn đến viêm tụy.
Fibrate cản trở quá trình chuyển hóa của warfarin [23]. Do đó, nên giảm liều warfarin 30% ở những bệnh nhân được điều trị bằng thuốc này.
Sau đây là các fibrate thường được sử dụng:
●Fenofibrate – Fenofibrate có thể được kê đơn dưới dạng công thức tinh thể nano (145 mg mỗi ngày uống không liên quan đến bữa ăn), viên nang micronized (liều lượng và cách dùng phụ thuộc vào sản phẩm), viên nang hoặc viên nén không micronized (liều lượng phụ thuộc vào sản phẩm; uống cùng với thức ăn), hoặc dưới dạng axit fenofibric (còn gọi là choline fenofibrate; 145 mg mỗi ngày không tính đến bữa ăn) [15]. Người kê đơn nên làm quen với một công thức có sẵn và tuân theo thông tin kê đơn cho sản phẩm đó. Chúng tôi thường thích sử dụng liều tối đa trừ khi cần giảm liều do tác dụng phụ hoặc suy giảm chức năng thận.
●Gemfibrozil – Gemfibrozil được kê đơn với liều 600 mg hai lần mỗi ngày và được uống trước bữa sáng và bữa tối.
●Bezafibrate – Bezafibrate được kê đơn với liều 200 mg ba lần mỗi ngày hoặc liều giải phóng kéo dài hàng ngày là 400 mg mỗi ngày [28]. Bezafibrate không được chấp thuận ở Hoa Kỳ nhưng được chấp thuận ở nhiều khu vực khác trên thế giới.
●Ciprofibrate – Ciprofibrate được kê đơn với liều 100 mg mỗi ngày. Nó không được chấp thuận sử dụng ở Hoa Kỳ nhưng được chấp thuận ở nhiều nước khác.
●Pemafibrate – Thuốc này được kê đơn với liều 0,2 mg hai lần mỗi ngày. Thuốc này được chấp thuận sử dụng ở Nhật Bản nhưng không được phép sử dụng ở nơi khác.
Tác dụng của fibrate – Mặc dù có tác dụng thuận lợi của fibrate đối với nồng độ lipid, nhưng có rất ít bằng chứng cho thấy những loại thuốc này có tác dụng thuận lợi đối với kết quả lâm sàng.
●Ảnh hưởng đến nồng độ lipid – Liệu pháp Fibrate làm giảm nồng độ TG huyết thanh từ 50 đến 70% [5,29] và tăng HDL-C từ 5 đến 20% (bảng 1) [27,30]. Fibrate làm giảm số lượng hạt LDL nhưng làm tăng nhẹ LDL-C. Tác dụng của fibrate lên LDL-C và HDL-C được thảo luận riêng. Fibrat có tác dụng mạnh hơn (nghĩa là làm giảm TG nhiều hơn) và có ít tác dụng phụ hơn axit nicotinic (niacin).
●Ảnh hưởng đến kết quả tim mạch – Không giống như statin, đã chứng minh hiệu quả lâm sàng trên nhiều mức độ LDL-C, fibrate đã cho thấy giảm các biến cố tim mạch chủ yếu ở các nhóm bệnh nhân có TG cao (trên 200 mg/dL [2,2 mmol/L]) và/hoặc HDL-C thấp (dưới 40 mg/dL [1 mmol/L]) [30-34]. Một phân tích tổng hợp gồm 18 thử nghiệm fibrate (45.058 người tham gia) được thực hiện trong thời gian trung bình 4,1 năm cho thấy không có tác dụng đối với tỷ lệ tử vong do mọi nguyên nhân (nguy cơ tương đối [RR] 1,00, KTC 95% 0,93-1,08) hoặc tỷ lệ tử vong do tim mạch (RR 0,97, 95). % CI 0,85-1,02) và xu hướng tăng tỷ lệ tử vong không do tim mạch (RR 1,10, CI 95% 0,995-1,21) [32]. Liệu pháp fibrate làm giảm nguy cơ biến cố mạch vành (RR 0,87, KTC 95% 0,81-0,93), nhưng không làm giảm đột quỵ (RR 1,03, KTC 95% 0,91-1,16).
Trong một thử nghiệm lâm sàng tiềm năng về pemafibrate, chất chủ vận alpha thụ thể kích hoạt peroxisome proliferator kích hoạt chọn lọc, bệnh nhân mắc bệnh tiểu đường loại 2, tăng triglycerid máu nhẹ đến trung bình (mức triglyceride từ 200 đến 499 mg mỗi deciliter) và nồng độ HDL-C là 40 mg mỗi deciliter. hoặc thấp hơn được chỉ định dùng pemafibrate hoặc giả dược [35]. Các biến cố tim mạch đầu tiên (nhồi máu cơ tim không tử vong, đột quỵ, tái thông mạch vành hoặc tử vong) tương tự ở nhóm dùng pemafibrate so với giả dược (10,9 so với 10,7%).
●Ảnh hưởng đến nguy cơ viêm tụy – Thiếu bằng chứng về tác động của liệu pháp fibrate đối với nguy cơ viêm tụy ở bệnh nhân tăng triglycerid máu từ trung bình đến nặng, vì bằng chứng hiện có phần lớn chỉ giới hạn ở những bệnh nhân có mức TG thấp hơn. Một phân tích tổng hợp bảy thử nghiệm fibrate (40.162 người tham gia), được thực hiện trong thời gian trung bình 5,3 năm ở những bệnh nhân có mức TG bình thường cao đến tăng triglycerid máu vừa phải ở mức thấp, đã xác định xu hướng tăng nguy cơ viêm tụy khi điều trị bằng fibrate, nhưng tổng số ca viêm tụy các biến cố là nhỏ (84 với liệu pháp fibrate, 60 với giả dược; RR 1,39, KTC 95% 1,00-1,95) [18].
●Sự an toàn:
•Fenofibrate – Độc tính chính của fenofibrate là tăng men gan, thỉnh thoảng tăng creatine phosphokinase và hiếm khi gây tiêu cơ vân. Vào năm 2021, FDA Hoa Kỳ đã sửa đổi các cảnh báo về fenofibrate để mô tả các báo cáo về tổn thương gan nghiêm trọng do thuốc gây ra, bao gồm cả ghép gan và tử vong [36]. Nhãn sản phẩm đề nghị theo dõi alanine aminotransferase (ALT), aspartate aminotransferase (AST) trong huyết thanh và bilirubin toàn phần lúc ban đầu và định kỳ trong quá trình điều trị, đồng thời ngừng thuốc nếu có dấu hiệu hoặc triệu chứng tổn thương gan phát triển hoặc nếu nồng độ enzyme tăng cao vẫn tồn tại (ALT). hoặc AST > 3 lần giới hạn trên của mức bình thường hoặc nếu kèm theo tăng bilirubin).
Độc tính trên thận liên quan đến Fenofibrate là một tác dụng phụ thường không được nhận biết [37]. Mặc dù cơ chế vẫn chưa rõ ràng, sự gia tăng creatinine huyết thanh có thể xảy ra trước thận do tác dụng của fenofibrate lên cơ xương hoặc lên huyết động học thận thông qua khiếm khuyết trong sản xuất prostaglandin giãn mạch. Tác dụng này của fenofibrate thường có thể đảo ngược [38]. Ở những bệnh nhân bị tăng creatinine huyết thanh do fenofibrate, gemfibrozil là một lựa chọn thay thế.
Nguy cơ mắc bệnh cơ tương đối thấp khi điều trị bằng fenofibrate đã được thảo luận ở trên.
•Gemfibrozil – Nguy cơ bệnh cơ khi dùng gemfibrozil , đặc biệt khi kết hợp với liệu pháp statin, đã được thảo luận ở trên.
Liệu pháp Gemfibrozil có liên quan đến tình trạng tăng aminotransferase huyết thanh nhẹ và thoáng qua và hiếm khi gây tổn thương gan cấp tính.
•Bezafibrate và ciprofibrate – Tác dụng phụ chính của bezafibrate và ciprofibrate là bệnh cơ và tổn thương gan.
Axit béo omega-3 từ biển – Chỉ định dùng axit béo omega-3 có nguồn gốc từ biển liều cao ở những bệnh nhân tăng triglycerid máu vừa hoặc trung bình đến nặng đã được thảo luận ở trên.
Lựa chọn tác nhân — Các chế phẩm axit béo omega-3 có nguồn gốc từ biển chứa este ethyl omega-3 axit eicosapentaenoic (EPA) có hoặc không có axit docosahexaenoic (DHA). Việc lựa chọn tác nhân khác nhau tùy thuộc vào mức độ nguy cơ bệnh xơ vữa động mạch (như được xác định ở trên).
●Đối với những bệnh nhân có nguy cơ mắc bệnh xơ vữa động mạch cao (như được định nghĩa ở trên), chúng tôi ưu tiên sử dụng icosapent ethyl nồng độ theo toa (ester ethyl của EPA; Vascepa).
Một ngoại lệ có thể xảy ra đối với trường hợp này là nếu bệnh nhân bị rung nhĩ kịch phát. Do lo ngại làm tình trạng rung nhĩ trở nên trầm trọng hơn, chúng tôi ưu tiên sử dụng fibrate ở những bệnh nhân này.
●Ở những bệnh nhân không có nguy cơ mắc bệnh ASCVD cao , có thể sử dụng bất kỳ chế phẩm axit béo omega biển theo toa nào có sẵn. Các lựa chọn bao gồm este ethyl của axit béo omega-3 (EPA và DHA) ở dạng chung hoặc nhãn hiệu (Lovaza) hoặc icosapent ethyl (Vascepa).
Các chế phẩm axit béo omega theo toa được khuyến nghị khác với nhiều loại dầu cá bổ sung chỉ chứa 30 đến 50% axit béo omega-3 và được dùng với liều lượng thấp. Để so sánh, chế phẩm thương mại Vascepa chứa hơn 95% icosapent ethyl [39]; liều icosapent ethyl trong thử nghiệm REDUCE-IT là 4 g mỗi ngày. Epanova, được sử dụng trong thử nghiệm STRENGTH, là một công thức axit cacboxylic chứa 4 g axit béo omega-3 (EPA và DHA) mỗi ngày. Những thử nghiệm này sẽ được thảo luận dưới đây.
Cách dùng — Liều lượng axit béo omega-3 theo toa (EPA+DHA hoặc chỉ EPA) để giảm mức TG ở bệnh nhân tăng triglycerid máu là 4 g mỗi ngày (tổng cộng EPA+DHA > 3 g mỗi ngày) [40].
●Liều icosapent ethyl (Vascepa, chỉ chứa este ethyl của EPA) là 2 g hai lần mỗi ngày trong bữa ăn. Sản phẩm icosapent ethyl có ≥96% EPA nên có 3,8 g EPA trong mỗi liều 4 g.
●Liều lượng este ethyl của axit béo omega-3 (EPA + DHA) ở dạng chung hoặc nhãn hiệu (Lovaza) là 4 g một lần mỗi ngày hoặc 2 g hai lần mỗi ngày cùng với thức ăn. Lovaza chứa 425 mg EPA và 345 mg DHA trên mỗi viên 1000 mg, do đó có 3,1 g EPA + DHA trên mỗi liều 4 g.
Tác dụng của axit béo omega-3 biển
Ảnh hưởng đến nồng độ lipid – Liệu pháp axit béo omega-3 biển liều cao làm giảm TG huyết thanh khoảng 20 đến 50%, tùy thuộc vào mức TG cơ bản [40-42]. Thiếu bằng chứng về tác dụng của liệu pháp axit béo omega-3 đối với nguy cơ viêm tụy. Axit béo omega-3 cũng có thể làm tăng cholesterol LDL (nói chung ở mức độ nhẹ), điều này có thể rõ rệt hơn với DHA so với EPA [43].
Ảnh hưởng đến kết quả tim mạch – Các thử nghiệm ngẫu nhiên có đối chứng kiểm tra tác dụng của axit béo omega-3 biển đối với kết quả bệnh tim mạch đã mang lại kết quả khác nhau [9,37,44-49]. Giả thuyết rằng liệu pháp giảm TG làm giảm nguy cơ ASCVD được hỗ trợ bởi một phân tích tổng hợp các thử nghiệm về tác dụng của liệu pháp statin (n = 25) và nonstatin (n = 24) (fibrate, niacin và axit béo omega-3 biển) trên Kết quả ASCVD ở 197.270 người tham gia [48]. Trong mô hình hồi quy tổng hợp đa biến, mức giảm nguy cơ tương đối là 0,84 (KTC 95% 0,75-0,94) trên 1 mmol/L hoặc mức giảm TG 0,92 trên 40 mg/dL. Tuy nhiên, thử nghiệm REDUCE-IT [9] đã ảnh hưởng mạnh mẽ đến kết quả phân tích này. Nếu không có thử nghiệm này, nguy cơ tương đối là 0,91 (KTC 95% 0,81-1,01) trên mỗi lần giảm TG 1 mmol/L.
Trong thử nghiệm REDUCE-IT, 8179 bệnh nhân có nồng độ TG tăng cao (mức TG lúc đói 135 đến 499 mg/dL [1,52 đến 5,63 mmol/L]) đang dùng statin và có bệnh tim mạch hoặc tiểu đường cùng với hai yếu tố nguy cơ tim mạch khác được phân ngẫu nhiên vào nhóm bổ sung icosapent ethyl 4 g mỗi ngày hoặc dầu khoáng [9]. Các yếu tố nguy cơ tim mạch được xác định là tuổi ≥50, hút thuốc lá, tăng huyết áp, HDL-C ≤40 mg/dL đối với nam hoặc ≤50 mg/dL đối với nữ, protein phản ứng C có độ nhạy cao (hs-CRP) >3,00 mg /L (0,3 mg/dL), độ thanh thải creatinine <60 mL/phút, bệnh võng mạc, albumin niệu vi mô hoặc đại thể và chỉ số cổ chân-cánh tay (ABI) <0,9. Các kết quả sau đây đã được báo cáo:
●Từ lúc bắt đầu đến một năm, mức TG trung bình giảm 18% ở nhóm điều trị, tăng 2,2% ở nhóm đối chứng và mức LDL-C tăng ở cả hai nhóm (nhóm điều trị 3,1%, nhóm đối chứng 10,2%). Sau hai năm, mức CRP giảm 13,9% ở nhóm điều trị và tăng 32,2% ở nhóm đối chứng.
●Icosapent ethyl làm giảm nguy cơ mắc bệnh tim mạch kết hợp chính (CVD) như tử vong do tim mạch, nhồi máu cơ tim không tử vong, đột quỵ không tử vong, tái thông mạch vành hoặc đau thắt ngực không ổn định (17,2 so với 22,0%; tỷ lệ nguy cơ [HR] 0,75, KTC 95% 0,68- 0,83) sau thời gian theo dõi trung bình là 4,9 năm [9]. Hai phân tích được chỉ định trước cho thấy sự giảm tỷ lệ của cả biến cố thiếu máu cục bộ lần đầu và lần tiếp theo (tức là toàn bộ) [50] cũng như nhu cầu tái thông mạch máu lần đầu tiên và lần thứ hai [51]. Icosapent ethyl cho thấy mức giảm nguy cơ CVD nguyên phát tương tự ở nhóm nhỏ 1837 người tham gia REDUCE-IT đã phẫu thuật bắc cầu động mạch vành trước đó (22 so với 28%; HR 0,76, KTC 95% 0,63-0,92) [52].
●Những hạn chế của bản dùng thử REDUCE-IT bao gồm:
•Dầu khoáng làm đối chứng – Đã có mối lo ngại rằng dầu khoáng góp phần làm tăng lipoprotein gây xơ vữa động mạch (LDL-C, non-HDL-C, apolipoprotein B), CRP và nguy cơ tim mạch ở nhóm đối chứng. Trong khi một số nghiên cứu và đánh giá tiếp theo cho rằng việc kiểm soát dầu khoáng không ảnh hưởng đáng kể đến kết quả nghiên cứu [53,54], một nghiên cứu khác đã mở rộng các dấu ấn sinh học từ LDL-C và CRP sang non-HDL-C và apolipoprotein B cho rằng tác dụng của dầu khoáng có thể giải thích phần nào hầu hết sự khác biệt trong kết quả nghiên cứu [55].
•Thiếu mối tương quan giữa giảm TG và kết quả bệnh tim mạch – Cơ chế làm giảm các biến cố tim mạch với icosapent ethyl là không chắc chắn, vì mức giảm nhẹ mức TG lúc đói khó có thể giải thích được mức độ lợi ích. Hơn nữa, mức độ giảm TG không liên quan đến kết quả thuận lợi. Tác dụng đa hướng có thể bao gồm tác dụng có lợi đối với sự kết tập tiểu cầu, chức năng nội mô, chuyển hóa oxy hóa và viêm [56,57].
Lợi ích tương tự từ liệu pháp icosapent ethyl đã được quan sát thấy trong thử nghiệm JELIS nhãn mở, trong đó 18.645 bệnh nhân tăng cholesterol máu được điều trị bằng statin được chỉ định ngẫu nhiên để nhận icosapent ethyl (1,8 g mỗi ngày) hoặc nhóm đối chứng (không có liệu pháp bổ sung) [58]. Mức TG ban đầu ở mức bình thường đến tăng vừa phải (trung bình 154 mg/dL [1,74 mmol/L]; khoảng tứ phân vị 111 đến 220 mg/dL [1,25 đến 2,49 mmol/L]). Có sự giảm 19% về tổng hợp các biến cố tim mạch ở nhóm dùng icosapent ethyl (2,8 so với 3,5%), phần lớn là do giảm nhập viện vì đau thắt ngực không ổn định. Mức độ giảm TG không liên quan đến nguy cơ biến cố tim mạch [46].
Thử nghiệm STRENGTH (được công bố sau phân tích tổng hợp được trích dẫn ở trên [48]), phân ngẫu nhiên 13.078 bệnh nhân được điều trị bằng statin có nguy cơ tim mạch cao vào công thức axit cacboxylic của axit béo omega-3 (omega-3 CA, bao gồm EPA và DHA).) hoặc dầu ngô [49]. Tất cả các bệnh nhân đều có mức TG cơ bản từ 180 đến 500 mg/dL (mức trung bình là 240 mg/dL), cũng như HDL-C <42 mg/dL đối với nam và <47 mg/dL đối với nữ.
●Sau thời gian điều trị trung bình là 38,2 tháng, tiêu chí tổng hợp chính về tử vong do tim mạch, nhồi máu cơ tim không tử vong, đột quỵ không tử vong, tái thông mạch vành hoặc đau thắt ngực không ổn định cần nhập viện là tương tự nhau ở cả hai nhóm (lần lượt là 12,0 so với 12,2%; HR 0,99, 95%). KTC 0,90-1,09). Không có sự khác biệt đáng kể trong các thành phần riêng lẻ của hỗn hợp. Phiên tòa đã bị dừng sớm vì vô ích.
●Một phân tích thứ cấp của thử nghiệm STRENGTH đã đánh giá mối quan hệ giữa nồng độ axit béo omega-3 trong huyết tương và điểm cuối tổng hợp chính ở 10.382 người tham gia với nồng độ EPA hoặc DHA trong huyết tương lúc ban đầu và 12 tháng sau khi ngẫu nhiên hóa [59]. Những bệnh nhân đạt được mức EPA và DHA cao nhất không có kết quả tốt hơn so với những bệnh nhân dùng giả dược dầu ngô (HR 0,98, CI 95% 0,83-1,16 đối với EPA và HR 1,02, CI 95% 0,86-1,20 đối với DHA).
●Một hạn chế của thử nghiệm STRENGTH là nồng độ EPA trên omega-3 CA thấp hơn đáng kể so với nồng độ trong thử nghiệm REDUCE-IT và JELIS (89,6 so với 144 và 169 mcg/mL), do đó có lo ngại rằng liều omega- 3 CA có thể không đầy đủ. Ngoài ra, DHA có tác dụng sinh lý khác nhau trên màng có thể góp phần làm giảm tác dụng của riêng EPA [57].
Sự an toàn
●Các triệu chứng về đường tiêu hóa – Trong thử nghiệm STRENGTH, có nhiều rối loạn tiêu hóa hơn (chủ yếu là tiêu chảy) ở nhóm CA omega-3 so với nhóm dùng dầu ngô (24,7 so với 14,7%). Trong thử nghiệm REDUCE-IT, rối loạn tiêu hóa thường gặp ở cả hai nhóm điều trị với tỷ lệ mắc bệnh ở nhóm icosapent ethyl thấp hơn một chút so với nhóm dầu khoáng (33,0 so với 35,1%).
●Rung nhĩ – Mặc dù axit béo omega-3 có liên quan đến việc tăng nguy cơ rung nhĩ nhưng các nghiên cứu trước đây vẫn có những hạn chế quan trọng. Một phân tích tổng hợp các phát hiện được công bố từ bảy thử nghiệm ngẫu nhiên có đối chứng (RCT) trên 81.000 người cho thấy những người tham gia được chỉ định bổ sung axit béo omega-3 so với giả dược có nguy cơ rung nhĩ cao hơn (n = 2905; HR 1,25; CI 95% 1,07-1,46) [60]. Tuy nhiên, hai hạn chế quan trọng của nghiên cứu là AF không phải là tiêu chí tổng hợp chính được xác định trước của bất kỳ RCT nào được phân tích. Ngoài ra, chỉ một trong bảy RCT, (nghiên cứu VITAL [61]) có nguy cơ tử vong cạnh tranh [62]. Trong số các nghiên cứu không tính đến nguy cơ tử vong cạnh tranh, tỷ lệ tử vong cao gấp 1,5 đến 5 lần nguy cơ rung nhĩ. Do đó, việc không tính đến nguy cơ tử vong cạnh tranh có thể dẫn đến mối liên hệ gia tăng sai lệch giữa axit béo omega-3 và chứng rung nhĩ. Trong nghiên cứu VITAL, tỷ lệ rung nhĩ xảy ra tương tự nhau ở những bệnh nhân dùng axit béo omega-3 và những người dùng giả dược [61].
Niacin – Một chỉ định hạn chế về niacin đối với chứng tăng triglycerid máu đã được mô tả ở trên.
Liều lượng Niacin được thảo luận riêng.
Với liều 1500 đến 2000 mg mỗi ngày, axit nicotinic có thể làm giảm nồng độ TG từ 15 đến 25 phần trăm [29]. Tuy nhiên, không có nghiên cứu nào chỉ ra rằng axit nicotinic cải thiện kết quả tim mạch. Niacin có một số tác dụng phụ bất lợi, bao gồm làm trầm trọng thêm tình trạng kháng insulin có thể dẫn đến bệnh tiểu đường loại 2 mới khởi phát hoặc làm xấu đi việc kiểm soát bệnh tiểu đường ở bệnh nhân tiểu đường loại 2. Các tác dụng phụ khác bao gồm tăng axit uric máu (và nguy cơ mắc bệnh gút), nguy cơ nhiễm trùng, tăng transaminase huyết thanh và bilirubin cũng như các triệu chứng về đường tiêu hóa.
Các liệu pháp mới nổi và đang nghiên cứu – Các liệu pháp mới nổi sau đây nhằm mục đích tăng độ thanh thải TG qua trung gian lipoprotein lipase bằng cách giảm hoạt động của các protein ức chế lipoprotein lipase như apolipoprotein C-III (APOC3) và protein giống angiopoietin (ANGPTL) 3:
●Chất ức chế APOC3 – Volanesorsen, một chất ức chế oligonucleotide antisense của APOC3, được chấp thuận sử dụng ở Châu Âu cho những bệnh nhân mắc bệnh chylomicron máu đơn gen đã được xác nhận về mặt di truyền nhưng không được chấp thuận sử dụng lâm sàng ở Hoa Kỳ. Các nghiên cứu sau đây đã chứng minh rằng nó làm giảm nồng độ APOC3 và TG huyết thanh:
•Chylomicron máu đơn nhân – Trong thử nghiệm APPROACH, 66 bệnh nhân mắc bệnh chylomicron máu đơn nhân (bảng 4) (trước đây là tăng lipoprotein máu loại I hoặc hội chứng chylomicron máu gia đình; mức APOC3 trong huyết tương trung bình ban đầu là 30,2 mg/dL và mức TG trung bình lúc đói là 2209 mg/dL) được chọn ngẫu nhiên được chỉ định dùng volanesorsen (300 mg tiêm dưới da mỗi tuần một lần) hoặc giả dược [63]. Volanesorsen hạ mức TG xuống dưới 750 mg/dL ở 77% bệnh nhân sau 3 tháng, so với 10% bệnh nhân dùng giả dược. Volanesorsen làm giảm mức APOC3 xuống 84% và mức TG xuống 77% ở những bệnh nhân thiếu lipoprotein lipase, cho thấy rằng thuốc thúc đẩy quá trình thanh thải TG thông qua con đường độc lập với lipoprotein lipase cũng như thông qua lipoprotein lipase.
•Tăng triglycerid máu ít nghiêm trọng hơn – Một thử nghiệm ngẫu nhiên về tác nhân này ở những bệnh nhân có nồng độ APOC3 và TG tăng ít nghiêm trọng hơn đã chứng minh mức giảm ở các mức này có hoặc không có liệu pháp fibrate đồng thời [64]. Mức cơ bản trung bình của APOC3 và TG là 22,8 mg/dL và 581 mg/dL ở những bệnh nhân không được điều trị bằng các liệu pháp giảm TG khác và 17,6 mg/dL và 376 mg/dL ở những bệnh nhân cũng được điều trị bằng fibrate. Trong nhóm thuần tập đơn trị liệu, liều 300 mg làm giảm mức APOC3 trung bình 79,6% (so với mức tăng 4,2% ở nhóm dùng giả dược) và 70,9% TG (so với mức tăng 20,1% ở nhóm dùng giả dược). Trong nhóm bổ sung fibrate, liều 300 mg làm giảm mức APOC3 trung bình 70,9% (so với mức giảm 2,2% ở nhóm giả dược) và mức TG xuống 64,0% (so với mức giảm 7,7% ở nhóm giả dược). nhóm).
•An toàn – Tác dụng phụ bất lợi thường gặp khi điều trị bằng volanesorsen là phản ứng tại chỗ tiêm (61 so với 0% với giả dược) và giảm tiểu cầu (33 so với 3% với giả dược) [63]. Sự phát triển của các liên hợp oligonucleotide N-acetyl-galactosamine antisense để đưa đến gan có thể cung cấp một phương tiện để tránh nguy cơ giảm tiểu cầu [65,66].
●Thuốc ức chế ANGPTL 3 – Thuốc ức chế ANGLPT3 đang được nghiên cứu bao gồm kháng thể đơn dòng (evinacumab) [67] và oligonucleotide antisense [68].
●Liệu pháp gen – Alipogene tiparvovec, liệu pháp gen điều trị tình trạng thiếu hụt lipoprotein lipase được cung cấp trong vec tơ virus liên quan đến adeno, làm giảm nồng độ TG ở những bệnh nhân mắc bệnh chylomicron máu đơn nhân (bảng 4) [69]. Liệu pháp này đã được phê duyệt để sử dụng lâm sàng ở Châu Âu, nhưng chưa được chấp thuận ở Hoa Kỳ. Nó không còn có sẵn.
TÓM TẮT VÀ KIẾN NGHỊ
●Mục tiêu điều trị – Mục tiêu quản lý bệnh nhân tăng triglycerid máu là giảm nguy cơ viêm tụy và bệnh tim mạch do xơ vữa động mạch (ASCVD), mặc dù bằng chứng về hiệu quả giảm triglycerid (TG) còn hạn chế.
●Các biện pháp chung – Đối với tất cả bệnh nhân tăng triglycerid máu, xử lý đầu tiên bao gồm (thuật toán 1):
•Giải quyết nguyên nhân – Cần giải quyết các yếu tố có thể gây ra hoặc làm trầm trọng thêm tình trạng tăng triglycerid máu.
•Điều chỉnh lối sống – Hạn chế ăn kiêng và uống rượu phụ thuộc vào mức độ tăng triglycerid máu.
Các biện pháp bổ sung bao gồm tập thể dục nhịp điệu và quản lý các yếu tố nguy cơ bệnh xơ vữa động mạch [2-4].
•Tối ưu hóa điều trị LDL-C – Đánh giá nguy cơ ASCVD và quản lý mức cholesterol lipoprotein mật độ thấp (LDL-C) được thực hiện theo khuyến nghị tiêu chuẩn.
●Quản lý bổ sung – Đối với những bệnh nhân có mức TG duy trì >150 mg/dL mặc dù đã áp dụng các biện pháp chung ở trên, quản lý bổ sung tùy thuộc vào mức TG, các yếu tố nguy cơ bệnh xơ vữa động mạch và tiền sử viêm tụy.
Trong thảo luận dưới đây, “nguy cơ bệnh xơ vữa động mạch cao” được định nghĩa là bệnh xơ vữa động mạch hoặc đái tháo đường cộng với hai yếu tố nguy cơ bệnh xơ vữa động mạch bổ sung (tuổi ≥50, hút thuốc lá, tăng huyết áp, cholesterol lipoprotein mật độ cao [HDL-C] ≤40 mg/dL đối với nam hoặc 50 mg/dL đối với nữ, protein phản ứng C có độ nhạy cao [hs-CRP] >3 mg/L [0,3 mg/dL], độ thanh thải creatinine <60 mL/phút, bệnh võng mạc, albumin niệu vi thể hoặc đại thể, và chỉ số cổ chân-cánh tay [ABI] <0,9).
Cách tiếp cận của chúng tôi như sau (Xem Thuật toán 1):
•Tăng triglycerid máu vừa phải (TG lúc đói 150 đến 499 mg/dL [1,7 đến 5,6 mmol/L])
–Bệnh nhân có nguy cơ ASCVD cao – Đối với những bệnh nhân tăng triglycerid máu vừa phải có nguy cơ ASCVD cao, chúng tôi khuyên bạn nên bổ sung liệu pháp điều trị bằng axit béo omega-3 biển (Cấp 2B). Trong cài đặt này, chúng tôi khuyên dùng icosapent ethyl thay vì các chế phẩm axit béo omega-3 biển khác (Loại 2C).
–Bệnh nhân không có nguy cơ mắc bệnh xơ vữa động mạch cao – Đối với những bệnh nhân tăng triglycerid máu vừa phải và thiếu các yếu tố nguy cơ bệnh xơ vữa động mạch ở trên, việc quản lý tập trung vào việc tiếp tục các biện pháp chung.
•Tăng triglycerid máu từ trung bình đến nặng (TG lúc đói 500 đến 999 mg/dL [5,65 đến 11,3 mmol/L]):
–Bệnh nhân có nguy cơ bệnh xơ vữa động mạch cao – Thuốc ban đầu được ưu tiên bổ sung cho bệnh nhân tăng triglycerid máu từ trung bình đến nặng và có nguy cơ bệnh xơ vữa động mạch cao là icosapent ethyl . Nếu mức TG vẫn ≥500 mg/dL mặc dù điều trị bằng icosapent ethyl, trừ khi bệnh nhân có chylomicron, chúng tôi đề nghị bổ sung liệu pháp fibrate để phòng ngừa hoặc giảm nguy cơ viêm tụy cấp (Cấp độ 2C).
–Bệnh nhân không có nguy cơ mắc bệnh xơ vữa động mạch cao – Đối với những bệnh nhân không có các yếu tố nguy cơ bệnh xơ vữa động mạch ở trên, chúng tôi đề nghị bổ sung liệu pháp fibrate (Cấp độ 2C). Nếu mức TG vẫn ≥500 mg/dL mặc dù đã điều trị bằng liệu pháp fibrate, chúng tôi khuyên bạn nên bổ sung thêm chất axit béo omega-3 biển (Cấp 2C). Trong trường hợp này, có thể sử dụng bất kỳ chế phẩm axit béo omega-3 biển liều cao theo toa nào có sẵn.
•Tăng triglycerid máu nặng (TG lúc đói ≥1000 mg/dL [≥11,3 mmol/L]) – Bệnh nhân tăng triglycerid máu nặng được quản lý bằng chế độ ăn kiêng cực kỳ hạn chế chất béo, kiêng rượu và điều trị hạ LDL với mục tiêu giảm mức TG xuống <1000 mg/dL. Đối với hầu hết bệnh nhân bị viêm tụy nặng (bao gồm tất cả bệnh nhân ngoại trú), việc bổ sung các thuốc hạ TG được trì hoãn cho đến khi mức TG ≤ 1000 mg/dL. Đối với bệnh nhân viêm tụy cấp, fibrate là một thành phần của liệu pháp làm giảm nồng độ TG cùng với các biện pháp trên.
BẢNG 1. Tác dụng của thuốc hạ lipid máu lên nồng độ lipid huyết thanh
| Thuốc | LDL-C huyết thanh (% thay đổi) |
HDL-C huyết thanh (% thay đổi) |
Triglyceride huyết thanh (% thay đổi) |
| Chất cô lập axit mật | ↓ 15 đến 30 | 0 đến tăng nhẹ | Không thay đổi hoặc tăng |
| Ezetimibe | ↓ 17 | ↑ 1 | ↓ 7 đến 8 |
| Fenofibrate (dạng micronized) | ↓ 6 đến 20 | ↑ 5 tới 20* | ↓ 41 đến 53 |
| Gemfibrozil ¶ | ↓ 10 đến 15 | ↑ 5 tới 20* | ↓ 35 đến 50 |
| Axit nicotinic (niacin) | ↓ 10 đến 25 | ↑ 15 đến 35 | ↓ 25 đến 30 |
| Axit béo omega-3 biển Δ | Dao động | ↑ 5 tới 9 | ↓ 23 đến 45 |
| Chất ức chế PCSK9 | ↓ 38 đến 72 | ↑ 4 tới 9 | ↓ 2 đến 23 |
| Statin | ↓ 20 đến 60 | ↑ 5 đến 10 | ↓ 10 đến 33 |
| Axit bempedoic | ↓ 15 đến 19 | Không thay đổi thành ↓ 4,5 | Không thay đổi |
* Tăng 20% được thấy ở những bệnh nhân có Triglyceride rất cao; mức tăng 5% là điển hình hơn khi dùng đơn trị liệu fibrate ở những bệnh nhân có Triglyceride thấp hơn.
¶ Khi dùng để điều trị tăng triglycerid máu, LDL-C có thể tăng lên.
Δ 4 g mỗi ngày các chế phẩm có độ tinh khiết cao hoặc 12 đến 15 g dạng axit béo omega-3 biển ít tinh khiết hơn.
Bảng 2. Chỉ số đường huyết trong chế độ ăn uống và tải lượng đường huyết của 20 loại thực phẩm cung cấp carbohydrate hàng đầu trong Nghiên cứu Sức khỏe Y tá năm 1984
| Thực phẩm | Chỉ số đường huyết*, % | Carbohydrate mỗi khẩu phần, g | Tải lượng đường huyết trên mỗi khẩu phần |
| 1. Khoai tây nấu chín (nghiền hoặc nướng) | 102 | 37 | 38 |
| 2. Bánh mì trắng | 100 | 13 | 13 |
| 3. Ngũ cốc ăn sáng lạnh | Khác nhau tùy theo loại ngũ cốc | Khác nhau tùy theo loại ngũ cốc | Khác nhau tùy theo loại ngũ cốc |
| 4. Bánh mì đen | 102 | 12 | 12 |
| 5. Nước cam | 75 | 20 | 15 |
| 6. Chuối | 88 | 27 | 24 |
| 7. Cơm trắng | 102 | 45 | 46 |
| 8. Pizza | 86 | 78 | 68 |
| 9. Mì ống | 71 | 40 | 28 |
| 10. Bánh nướng xốp kiểu Anh | 84 | 26 | 22 |
| 11. Sinh tố trái cây | 95 | 44 | 42 |
| 12. Cô-la | 90 | 39 | 35 |
| 13. Táo | 55 | 21 | 12 |
| 14. Sữa gầy | 46 | 11 | 5 |
| 15. Bánh xèo | 119 | 56 | 67 |
| 16. Đường ăn | 84 | 4 | 3 |
| 17. Mứt | 91 | 13 | 12 |
| 18. Nước ép nam việt quất | 105 | 19 | 20 |
| 19. Khoai tây chiên | 95 | 35 | 33 |
| 20. Kẹo | 99 | 28 | 28 |
Bảng 3.Khẩu phần cá hàng tuần để đạt được 250 mg EPA + DHA/ngày
| Tên cá | Số khẩu phần 3,5 ounce (100 gam)* |
| Cá có dầu | |
| Cá cơm, đóng hộp | 1 |
| Cá trích, Đại Tây Dương | 1 |
| Cá hồi, Đại Tây Dương | 1 |
| Cá ngừ, cá ngừ vây xanh | 2 |
| Cá thu, Đại Tây Dương | 2 |
| Cá xanh | 2 |
| Cá hồi, cầu vồng | 2 |
| Cá mòi, đóng hộp Đại Tây Dương | 2 |
| Cá vược | 2 |
| Cá ngói¶ | 2 |
| Cá kiếm¶ | 2 |
| Cá ngừ, cá ngừ albacore đóng hộp | 3 |
| Cá hồi, mắt đỏ | 3 |
| Cá chép | 4 |
| Cá hồi hun khói (lox) | 4 |
| Cá thu vua¶ | 5 |
| Cá trắng | |
| Cá vược | 3 |
| Pollock, Đại Tây Dương | 4 |
| Cá hồng | 6 |
| Cá bơn và đế | 6 |
| Cá ngừ, đóng hộp nhẹ | 7 |
| Cá mú | số 8 |
| Cá da trơn, hoang dã | số 8 |
| Cá chim lớn | số 8 |
| Cá tuyết chấm đen | 12 |
| Cá tuyết, Đại Tây Dương | 12 |
| Động vật có vỏ | |
| Con trai | 3 |
| Cua vua Alaska | 5 |
| Hàu nguyên miền đông | 6 |
| Sò | 7 |
| Tôm | 7 |
| Tôm hùm miền bắc | 10 |
| Sò | 11 |
| Cua, Màu Xanh | 11 |
* Khẩu phần được làm tròn thành số nguyên khẩu phần.
¶ Chứa nhiều thủy ngân. Phụ nữ mang thai nên tránh ăn những loại cá này, cũng như cá marlin, cá cam, cá mập và cá ngừ mắt to. Tham khảo chủ đề UpToDate về việc tiêu thụ cá khi mang thai.
Bảng 4. Yếu tố di truyền góp phần gây tăng triglycerid máu
| A. HTG nặng (TG >10 mmol/L) |
| Chylomicronaemia đơn gen (trước đây là HLP loại 1 hoặc hội chứng chylomicron gia đình) |
|
|
|
|
|
| Chylomicronaemia đa yếu tố hoặc đa gen (trước đây là HLP loại 5) |
|
|
|
|
|
| B. HTG nhẹ đến trung bình (TG 2,0 đến 9,9 mmol/L) |
| HTG đa yếu tố hoặc đa gen (trước đây là HLP loại 4 hoặc HTG gia đình) |
|
| Rối loạn betalipoprotein máu (trước đây là HLP loại 3 hoặc rối loạn betalipoprotein máu) |
|
|
|
| Tăng lipid máu kết hợp (trước đây là HLP loại 2B hoặc tăng lipid máu kết hợp mang tính chất gia đình) |
|
|
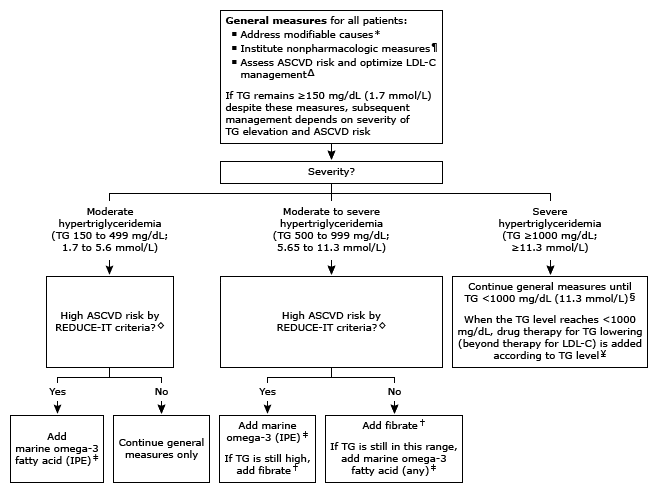
ABI: chỉ số cổ chân-cánh tay; ASCVD: bệnh tim mạch do xơ vữa động mạch; HDL-C: cholesterol lipoprotein mật độ cao; hs-CRP: protein phản ứng C có độ nhạy cao; IPE: etyl icosapent; LDL-C: cholesterol lipoprotein mật độ thấp; TG: mức độ chất béo trung tính trong huyết thanh (hoặc huyết tương) lúc đói.
* Giải quyết các nguyên nhân có thể thay đổi được bao gồm tránh dùng các thuốc gây tăng triglycerid máu và đạt được sự kiểm soát đường huyết tốt cho bệnh nhân đái tháo đường. Tham khảo nội dung UpToDate về nguyên nhân gây tăng triglycerid máu.
¶ Các biện pháp không dùng thuốc bao gồm tập thể dục nhịp điệu thường xuyên, quản lý các yếu tố nguy cơ bệnh xơ vữa động mạch bao gồm tăng huyết áp và giảm cân theo chỉ định. Các khuyến nghị về chế độ ăn uống và rượu cụ thể khác nhau tùy thuộc vào mức độ nghiêm trọng của chứng tăng triglycerid máu. Đối với tình trạng tăng triglycerid máu ở mức độ vừa phải, mục tiêu bao gồm <6% lượng calo từ đường bổ sung, 30 đến 35% lượng calo trong tổng lượng chất béo trong chế độ ăn và 2 ly mỗi ngày đối với nam và 1 ly mỗi ngày đối với nữ. Đối với tình trạng tăng triglycerid máu từ trung bình đến nặng, mục tiêu bao gồm <5% lượng calo từ đường bổ sung, 20 đến 25% lượng calo trong tổng lượng chất béo trong khẩu phần ăn và kiêng rượu. Tham khảo § để biết mục tiêu điều trị tăng triglycerid máu nặng.
Δ Tham khảo nội dung UpToDate về cách tiếp cận đánh giá rủi ro bệnh ASCVD và cách quản lý LDL-C để phòng ngừa bệnh xơ vữa động mạch nguyên phát và thứ phát.
◊ “Nguy cơ mắc bệnh xơ vữa động mạch cao” được xác định ở đây theo tiêu chí trong thử nghiệm REDUCE-IT: bệnh xơ vữa động mạch hoặc đái tháo đường đã xác định cộng với hai trong số các yếu tố nguy cơ bệnh xơ vữa động mạch sau: tuổi ≥50, hút thuốc lá, tăng huyết áp, HDL-C ≤40 mg /dL đối với nam hoặc 50 mg/dL đối với nữ, hs-CRP >3 mg/L (0,3 mg/dL), độ thanh thải creatinine <60 mL/phút, bệnh võng mạc, albumin niệu vi mô hoặc đại thể và ABI <0,9.
§ Trong bối cảnh tăng đường huyết nặng, điều quan trọng là phải loại bỏ đường bổ sung, hạn chế chất béo ở mức 10 đến 15% (tốt nhất là <5%) tổng lượng calo và kiêng rượu.
¥ Đối với bệnh nhân ngoại trú bị tăng triglycerid máu nặng, điều trị bằng thuốc để hạ TG (ngoài liệu pháp điều trị LDL-C) thường được trì hoãn. Với tốc độ giảm TG nhanh chóng có thể đạt được bằng chế độ ăn hạn chế chất béo nghiêm ngặt, với sự theo dõi chặt chẽ, có thể bắt đầu điều trị bằng thuốc điều trị tăng triglycerid máu trong vòng vài ngày. Tuy nhiên, đối với bệnh nhân nội trú bị tăng triglycerid máu nặng và viêm tụy, điều trị ngay lập tức bằng fibrate là một phần của liệu pháp.
‡ Việc lựa chọn axit béo omega-3 biển khác nhau tùy thuộc vào mức độ nguy cơ bệnh ASCVD (như đã xác định ở trên). Đối với những bệnh nhân có nguy cơ mắc bệnh ASCVD cao, chúng tôi ưu tiên IPE cường độ theo toa. Ở những bệnh nhân không có nguy cơ mắc bệnh ASCVD cao, có thể sử dụng bất kỳ loại axit béo omega-3 biển liều cao theo toa nào. Các lựa chọn bao gồm este ethyl của axit béo omega-3 (EPA+DHA) ở dạng gốc hoặc nhãn hiệu hoặc IPE (ethyl ester của EPA). Tham khảo nội dung UpToDate về cách sử dụng và tác dụng phụ.
† Khi lựa chọn liệu pháp fibrate, chúng tôi thường thích fenofibrate hơn gemfibrozil vì nó có ít tương tác thuốc hơn, thường được dung nạp tốt hơn và sự tuân thủ của bệnh nhân tốt hơn do dùng liều một lần mỗi ngày. Tham khảo nội dung UpToDate về cách sử dụng và tác dụng phụ.
BÌNH LUẬN