Can thiệp mạch vành qua da được cách mạng hóa bằng việc phát triển stent mạch vành với thiết kế nhằm ngăn ngừa nhiều biến chứng cấp tính của nong bóng. Mặc dù có những lợi ích đã được chứng minh trong bệnh cảnh cấp tính, stent trần kim loại ban đầu có liên quan đến cơ chế tân sinh nội mạc do chấn thương thành động mạch dẫn đến tái hẹp trong stent ở 20-30% trường hợp. Đây là động lực chính thúc đẩy sự phát triển của stent phủ thuốc với sự phóng thích có kiểm soát các chất chống tăng sinh được giải phóng từ các polyme trên bề mặt stent. Stent phủ thuốc thế hệ thứ nhất giải phóng sirolimus hoặc paclitaxel đã làm giảm 50-70% biến cố tái thông mạch vành đích so với stent trần kim loại trong gần như tất cả các phân nhóm bệnh nhân và các loại tổn thương. Tuy nhiên, những lo ngại về an toàn đã được nêu ra liên quan đến cơ chế chậm lành lớp nội mạc và làm tăng nguy cơ huyết khối rất muộn trong stent. Những lo ngại này đã thúc đẩy việc thay đổi thiết kế stent, dẫn đến việc ra đời một loạt các stent thuốc thế hệ mới sử dụng các chất chống tăng sinh mới, khung stent và polyme được sửa đổi với khả năng tương thích sinh học cao và kết quả lâm sàng được cải thiện.
I. LỊCH SỬ PHÁT TRIỂN STENT MẠCH VÀNH
Thuật ngữ “stent” được đặt ra vào năm 1916 bởi Johannes F. Esser, một bác sĩ phẫu thuật thẩm mỹ người Hà Lan đề cập đến một vật liệu nha khoa trước đây được phát minh bởi nha sĩ người Anh Charles T. Stent. Stent mạch máu đầu tiên được phát triển và tiến hành can thiệp thành công trên chó thí nghiệm vào năm 1968 bởi Charles T. Dotter. Stent mạch vành đầu tiên là kết quả của các cuộc thảo luận giữa Hans Wallsten (cựu kỹ sư ngành giấy), Ake Senning(bác sĩ phẫu thuật tim) và bác sĩ tim mạch can thiệp Andreas Grüntzig ở Zurich, Thụy Sĩ. Stent mạch vành đầu tiên có tên gọi Wallstent (stent tự nở) được phát triển bởi bác sĩ Ulrich Sigwart và được can thiệp lần đầu tiên bởi Jacques Puel (Toulouse, Pháp) vào tháng 3 năm 1986 trên một bệnh nhân nam 63 tuổi bị bóc tách động mạch liên thất trước LAD sau nong bóng (Hình 1).

Hình 1: Ca can thiệp mạch vành đặt stent đầu tiên của Jacques Puel (3/1986)
Tỉ lệ sử dụng stent trần kim loại trần liên tục gia tăng, tuy nhiên tỉ lệ tái hẹp trong stent còn cao đã hạn chế các chỉ định cho việc sử dụng nó. Các nghiên cứu Nghiên cứu sâu hơn đã dẫn đến sự phát triển của sự kết hợp của một nền tảng kim loại, một loại polymer và một loại thuốc được giải phóng từ polymer, cho thấy sự ức chế hiệu quả tăng sinh tế bào cơ trơn, giảm đáng kể tỷ lệ tái hẹp trog stent và cải thiện kết quả lâm sàng lâu dài.
STENT GIANTURCO-ROUBIN
Stent có thể mở rộng bằng bóng có thiết kế cuộn dây được chế tạo từ một sợi thép không gỉ. Stent đã được phê duyệt sử dụng tại Hoa Kỳ vào năm 1993 để điều trị bóc tách mạch vành sau nong bóng. Tương tự như Wallstent, stent Gianturco-Roubin có độ linh hoạt cao nhưng có lực hướng kính (radial strength) kém dẫn đến tăng tỉ lệ tái hẹp cũng như huyết khối trong stent.
PALMAZ-SCHATZ
Vào cuối những năm 1980, Julio C. Palmaz, một bác sĩ X-quang người Argentina – đã thiết kế một stent mạch máu theo một mô hình lấy từ một bản kim loại. Cùng với Richard A. Schatz, một bác sĩ tim mạch đến từ San Antonio (Texas, Hoa Kỳ), ông đã sửa đổi phiên bản ban đầu của nguyên mẫu này để uốn cong stent mạch vành có thể mở rộng bằng bóng. Vào tháng 12 năm 1987, stent Palmaz-Schatz đầu tiên được đặt vào động mạch vành ở Sao Paolo, Brazil. Các stent đã được các bác sĩ tim mạch can thiệp gấp vào một cách thủ công trên bóng nong nên thường dẫn đến tai biến rớt stent.

Hình 2: a) stent Gianturco-Roubin b) stent Palmaz-Schatz
NHỮNG CẢI TIẾN CỦA STENT TRẦN KIM LOẠI VÀ LIỆU PHÁP KHÁNG KẾT TẬP TIỂU CẦU KÉP
Việc sử dụng rộng rãi của can thiệp đặt stent động mạch vành là kết quả của nghiên cứu BElgian NEtherlands STENT (BENESTENT) và nghiên cứu STent REStenosis (STRESS) cho thấy sự vượt trội của stent so với nong bóng ở tiêu chí cần tái thông mạch đích. Kể từ đó, rất nhiều tiến bộ to lớn đã được thực hiện trong việc cải thiện vật liệu và thiết kế stent. Các kết quả được cải thiện với đặt stent động mạch vành theo thời gian cũng liên quan đến việc phát hiện ra rằng liệu pháp kháng tiểu cầu kép (DAPT) (thay vì chống đông bằng đường uống) làm giảm cả tỷ lệ huyết khối trong stent và biến chứng xuất huyết. Những nghiên cứu này cũng cho thấy rằng tiểu cầu có vai trò quan trọng trong sinh bệnh học của huyết khối trong stent.
STENT PHỦ THUỐC
Stent phủ thuốc (DES) với cơ chế phân phối thuốc tại chỗ, phóng thích có kiểm soát các thuốc có khả năng chống tăng sinh tế bào là một bước tiến lớn trong thiết kế stent. Heparin ban đầu được sử dụng làm vật liệu phủ trên stent nhằm giảm nguy cơ huyết khối trong stent sớm. Trong nhồi máu cơ tim cấp tính, sử dụng stent phủ thuốc cũng làm giảm tỷ lệ huyết khối cấp trong stent và nhồi máu cơ tim tái phát.
Stent phủ thuốc Sirolimus (SES) được đặt lần đầu tiên ở người vào năm 2001 và sau đó cơ quan quản lý dược phẩm và thực phẩm Hoa Kỳ (FDA) phê chuẩn giúp giảm có ý nghĩa tỉ lệ tái hẹp trong stent so với stent kim loại trần (BMS). Sau đó stent phủ thuốc paclitaxel trên khung polymer (PES), cũng làm giảm tỉ lệ tái hẹp trong stent và cần tái thông lại mạch đích so với BMS.
II. CẤU TẠO STENT VÀ CÁC Ý NGHĨA TRÊN THỰC HÀNH CAN THIỆP MẠCH VÀNH
Để đạt được thành công khi can thiệp mạch vành về ngắn hạn cũng như lâu dài, thiết kế stent mạch vành cần thỏa mãn 9 tiêu chí sau:
- Được chuyển thành công đến tổn thương đích, đi đến được cả đoạn xa của hệ động mạch vành, kể cả các đoạn mạch vành uốn khúc (tortousity)
- Cung cấp và duy trì tốt giá đỡ sau khi nong bóng và thu hồi lại được hệ thống phân phối stent (delivery system) để giữ tối đa đường kính lòng mạch sau can thiệp và giảm thiểu mảng xơ vữa trồi vào lòng mạch
- Định hình phù hợp với kiến trúc mạch máu, không để lại các gờ hoặc biến dạng giải phẫu khác
- Có độ cản quang trên màn huỳnh quang đủ tốt để stent được nhìn thấy bởi thủ thuật viên trong trường hợp nong bóng sau đặt stent (post-dilatation) hoặc chồng stent (stent-overlapping)
- Giảm thiểu tổn thương mạch máu khi đặt stent, dẫn đến phản ứng phục hồi thành mạch sau chấn thương làm kích thích sự tăng sinh nội mô, hậu quả gây ra tái hẹp trong stent
- Giảm thiểu hiện tượng tắc nghẽn dòng chảy của nhánh bên, hậu quả là nhồi máu cơ tim sau thủ thuật
- Không bị ăn mòn hoặc làm mất tính toàn vẹn cấu trúc
- Nguy cơ gãy stent thấp
- Trong trường hợp stent phủ thuốc, thuốc chống tăng sinh được phân bổ tại mô với liều lượng và thời gian hợp lý ngăn ngừa tăng sinh nội mô mà không có độc tính lên mạch máu. Trong trường hợp stent phủ thuốc có khung kim loại, những mục tiêu này đạt được thông qua sự tổng hòa của chất liệu hợp kim, thiết kế khung stent, polyme tương thích sinh học và thuốc phủ.
ĐẶC ĐIỂM CỦA KHUNG STENT
Các đặc tính của khung stent có thể được định lượng bằng tính linh hoạt (flexibility) và khả năng tiếp cận sang thương (trackability), tính định hình giải phẫu (conformability), khả năng chịu nén chiều ngang (radial strength) và chiều dọc (longitudinal strength), sự chun co lại (recoil) và độ cản quang (radiopacity)
1. Tính linh hoạt (flexibility) và khả năng tiếp cận sang thương (trackability)
Tính linh hoạt là lực cần thiết để uốn cong stent với một bán kính cong cụ thể. Nghĩa là, một stent có độ linh hoạt thấp đòi hỏi lực lớn hơn, trong khi một stent với độ linh hoạt cao đòi hỏi ít lực hơn.
Tính linh hoạt góp phần vào khả năng tiếp cận sang thương định nghĩa là tả sự dễ dàng mà hệ thống stent có thể tiến xa được thông qua giải phẫu mạch vành đến sang thương đích. Điều này được định lượng bằng thực nghiệm trên mô hình. Tính linh hoạt cao giúp tăng khả năng tiếp cận sang thương đích, tạo điều kiện thuận lợi cho việc hoạt động của của hệ thống stent, đặc biệt thông qua các chỗ quanh co và/hoặc giải phẫu phức tạp của động mạch vành.
2. Tính định hình giải phẫu (conformability)
Tính định hình giải phẫu (conformability) mô tả khả năng của stent để thích ứng với độ cong tự nhiên của động mạch được can thiệp. Một stent quá cứng (tính định hình giải phẫu kém) stent sẽ duỗi thẳng các mạch máu xoắn vặn, tuy nhiên có thể để lại các điểm gờ ở các rìa stent, là nguy cơ của huyết khối trong stent.
3. Khả năng chịu nén chiều ngang (radial strength)
Khả năng chịu nén chiều ngang là đại lượng đo lường sức mạnh của khung stent và khả năng duy trì lòng mạch của stent sau can thiệp. Yếu tố này rất quan trọng trong điều trị các sang thương xơ-vôi hóa (fibrocalcified) và sang thương lỗ. Các yếu tố ảnh hưởng đến khả năng chịu nén chiều nagng bao gồm loại hợp kim của khung stent, độ dày mắt cáo stent (struct thickness), cấu tạo hình học của stent. Stent có khả năng chịu nén chiều ngang kém sẽ tăng tỉ lệ mất muộn (late lumen loss)
4. Khả năng chịu nén chiều dọc (longitudinal strength)
Khả năng chịu nén chiều dọc (longitudinal strength) chính là khả năng chống lại sự đè ép hoặc kéo dài stent do lực đẩy hoặc lực kéo. Với một lực có độ lớn theo quy ước, stent với khả năng chịu nén chiều dọc kém sẽ chịu sự rút ngắn và/hoặc kéo dài theo chiều dọc. Trong thực tế khi can thiệp trên bệnh nhân, việc đưa các thiết bị như bóng nong mạch vành , một stent khác hoặc siêu âm nội mạch vành (IVUS) qua một stent đã đặt có thể tác động lực dọc theo trục dọc của stent, đặc biệt là trong các sang thương lỗ hoặc các stent đoạn gần chưa áp sát hoặc không nở trọn sẽ dẫn đến biến dạng stent theo chiều dọc.
Cấu trúc hình học của stent có liên quan mật thiết đến khả năng chịu nén chiều dọc. Các stent có thiết kế càng ít điểm nối (connector) giữa các mắt cáo có khả năng chịu nén chiều dọc càng kém.
5. Sự chun co lại (recoil)
Sự chun co lại mô tả khả năng duy trì đường kính ban đầu của stent sau khi được mở rộng. Sự chun co lại càng ít, càng giảm nguy cơ tái hẹp trong stent, ngăn ngừa hiện tượng stent không áp sát, tối ưu hóa sự phóng thích các thuốc chống tăng sinh tế bào nội mạc.
6. Độ cản quang (radiopacity)
Độ cản quang chính là khả năng hiển thị stent trên màn huỳnh quang, hỗ trợ cho thủ thuật viên xác định vị trí chính xác khi can thiệp. Độ cản quang phụ thuộc vào độ dày và mật độ của kim loại tạo nên khung stent. Do đó, xét trên một vật liệu kim loại cấu tạo nên khung stent, mắt cáo stent mỏng hơn dẫn đến độ cản quang kém hơn so với các stent có mắt cáo dày hơn. Độ cản quang của thép không gỉ 316L có thể được cải thiện bằng cách sử dụng các điểm mốc (marker) mạ hợp kim cản quang. Hiện nay, các hợp kim crôm bạch kim (PtCr) và coban crom (CoCr) đã được sử dụng cho khung stent vì chúng có độ cản quang lớn hơn nhưng sức chịu nén tương tự như thép không gỉ 316L.
7. Ảnh hưởng của bề dày mắt cáo stent
Bề dày mắt cáo stent là một yếu tố quan trọng của khung stent. Bề dày mắt cáo stent càng lớn sẽ tăng cường độ cản quang và khả năng chịu nén bề ngang. Tuy nhiên, mắt cáo dày hơn sẽ giảm khả năng luân chuyển (deliverability) của hệ thống stent đến tổn thương và có thể gây ảnh hưởng dòng chảy nhánh bên sau can thiệp, tăng nguy cơ nhồi máu cơ tim quanh thủ thuật. Đã có các dữ liệu từ nghiên cứu lâm sàng cho thấy mắt cáo stent mỏng hơn có thể giảm tỉ lệ mất muộn và tỉ lệ tái hẹp trong stent, cơ sở của kết quả này có thể đến từ việc giảm chấn thương mạch máu so với mắt cáo dày.
Trong thử nghiệm lâm sàng ISAR-STEREO, stent mắt cáo mỏng 50 μm giảm đáng kể nguy cơ tái hẹp sau 1 năm so với stent có mắt cáo dày 140 μm có thiết kế tương đương ; 15% so với 25,8%; tỉ số nguy cơ tương đối [RR], 0,58; Khoảng tin cậy 95%, 0,39- 0,87; P = 0,003. Tương tự, stent mắt cáo mỏng cũng liên quan với tỷ lệ tái thông mạch đích thấp hơn (8,6% so với 13,8%; RR, 0,62; KTC 95%, 0,39-0,99).
8. Lõi kim loại của khung stent
Mục tiêu giảm độ dày mắt cáo stent trong khi vẫn bảo tồn độ cản quang và khả năng chịu nén đã dẫn đến việc kết hợp các hợp kim mới hơn thay cho thép không gỉ truyền thống 316L. Chúng bao gồm MP35N CoCr (được sử dụng trong stent BMS Driver và stent DES Endeavour và Resolute), L605 CoCr (được sử dụng trong stent BMS Vision và stent DES Xience) và PtCr (được sử dụng trong stent BMS Omega và stent DES Promus Element ). Các hợp kim này đã cho phép giảm đáng kể độ dày mắt cáo, từ khoảng 0,10 đến 0,14 mm đến 0,081 đến 0,090 mm, trong khi duy trì các đặc tính hiệu quả khác của thép không gỉ 316L. Ví dụ, PtCr có mật độ cao hơn so với bằng thép không gỉ 316L hoặc L605 CoCr (9,9 g / cm3, 8,0 g / cm3 và 9,1 g / cm3, tương ứng), do đó cho phép giảm độ dày trong khi duy trì độ cản quang.
9. Cấu trúc ô mắt cáo
Có thể phân làm 2 loại: thiết kế ô mở và đóng
Một thiết kế ô đóng bao gồm các vòng liên tiếp trong đó tất cả các vòng stent được kết nối bởi các cầu nối theo kiểu đỉnh đến đỉnh. Điều này giúp cho các vòng stent được mở rộng đồng đều, giảm thiểu sự thay đổi kích thước ô mắt cáo, có tính định hình tốt và tối ưu hóa việc phân phối thuốc chống tăng sinh, bất kể mức độ xoắn vặn của mạch máu. Nhược điểm của thiết kế ô đóng là độ cứng của nó, do đó hạn chế khả năng di chuyển linh hoạt của stent qua các mạch máu quanh co. Ví dụ về stent ô kín bao gồm stent DES Cypher và stent kim loại trần của nó – Bx Velocity.
Ngược lại, trong một thiết kế ô mở, một phần các vòng stent không được kết nối bằng các cầu nối. Điều này cho phép tăng tính linh hoạt theo chiều dọc, tăng khả năng định hình cấu trúc giải phẫu mạch máu, tăng khả năng tiếp cận lại các nhánh bên sau đặt stent. Điều này có thể dẫn đến khả năng phân phối thuốc chống tăng sinh không đồng nhất tại các điểm không áp sát mạch máu, mặc dù vậy điều này ít quan trọng trong các stent phủ thuốc sử dụng nhóm đồng phân của sirolimus – các thuốc này có khoảng trị liệu rộng cho phép với một liều lượng cao hơn đủ để phân phối đủ trên các tế bào thành mạch. Các stent thế hệ mới hiện nay có sự thay đổi linh hoạt giữa kết cấu mở và đóng cũng như số cầu nối và điểm kết nối giữa các vòng stent.
Hình 3: Thiết kế một số loại stent
10. Các thuốc chống phân bào
Tái hẹp trong stent là kết quả chủ yếu đến từ hiện tượng tân sinh nội mô mạch máu xảy ra tại chỗ do chấn thương động mạch trong quá trình can thiệp mạch vành qua da. Điều này có liên quan đến quá trình kích hoạt, tăng sinh và di chuyển của các tế bào cơ trơn mạch máu, cũng như tăng sản xuất các thành phần chất nền (matrix) ngoại bào. Vì thế, nét cơ bản trong cơ chế hoạt động của stent phủ thuốc nằm ở thuốc chống tăng sinh an toàn giúp ức chế hiệu quả sự tăng sinh nội mô mạch máu. Hai loại chất chống đông máu có đã chứng minh thành công trong việc ngăn ngừa tăng sinh nội mô là paclitaxel và các chất tương tự rapamycin (bao gồm sirolimus, everolimus, zotarolimus và biolimus). Tính kỵ nước (tan trong lipid) có thể giúp một số thuốc phân phối tốt hơn trong nội mô mạch máu.

Hình 3: Thiết kế một số loại stent
10. Các thuốc chống phân bào
Tái hẹp trong stent là kết quả chủ yếu đến từ hiện tượng tân sinh nội mô mạch máu xảy ra tại chỗ do chấn thương động mạch trong quá trình can thiệp mạch vành qua da. Điều này có liên quan đến quá trình kích hoạt, tăng sinh và di chuyển của các tế bào cơ trơn mạch máu, cũng như tăng sản xuất các thành phần chất nền (matrix) ngoại bào. Vì thế, nét cơ bản trong cơ chế hoạt động của stent phủ thuốc nằm ở thuốc chống tăng sinh an toàn giúp ức chế hiệu quả sự tăng sinh nội mô mạch máu. Hai loại chất chống đông máu có đã chứng minh thành công trong việc ngăn ngừa tăng sinh nội mô là paclitaxel và các chất tương tự rapamycin (bao gồm sirolimus, everolimus, zotarolimus và biolimus). Tính kỵ nước (tan trong lipid) có thể giúp một số thuốc phân phối tốt hơn trong nội mô mạch máu.
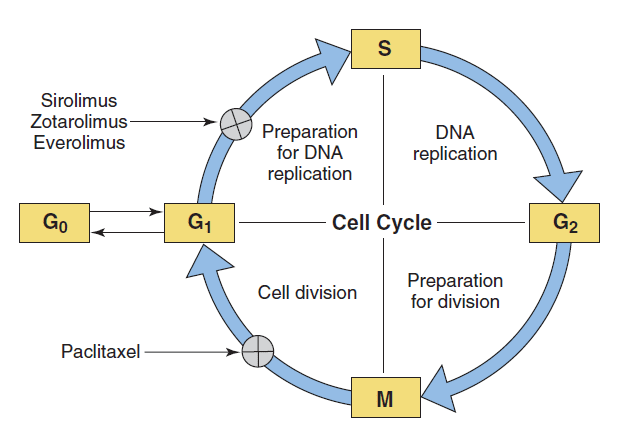
Hình 4: Vị trí tác động của các thuốc chống tăng sinh
11. Lớp polymer phủ
Phân phối thuốc trong stent phủ thuốc có thể đạt được qua ba cơ chế: (1) một lớp phủ polymer vĩnh cửu được tải thuốc chống tăng sinh; (2) lớp phủ polymer có khả năng hấp thụ sinh học, có thể được nội mô hấp thu hoặc giải phóng thuốc theo thời gian thông qua hiện tượng phân giải polymer; và (3) stent không polymer với thuốc liên kết trực tiếp với bề mặt stent hoặc được nhúng trong các lỗ hổng trên thân stent hoặc các hạt nano.
Polyme cho phép cung cấp các chất chống tăng sinh ở liều lượng và thời gian thích hợp để đạt được một hiệu quả chống tái hẹp tốt. Một polymer lý tưởng không gây viêm, không độc hại, không gây ra phản ứng tạo huyết khối và có thể cung cấp thuốc ở một tỷ lệ ổn định và có kiểm soát. Polymer vĩnh cửu sẽ vẫn còn tồn tại vô thời hạn với stent sau can thiệp sau khi thuốc phóng thích hết. Các polymer tổng hợp vĩnh cửu không phân hủy sinh học là cơ chế vận chuyển thuốc phổ biến trong stent phủ thuốc hiện đang được sử dụng, đặc biệt là ở Hoa Kỳ. Một số polymer vĩnh cửu có liên quan đến hiện tượng trì hoãn quá trình chữa lành mạch máu, dẫn tới phục hồi lớp nội mô không hoàn chỉnh, phản ứng quá mẫn có thể góp phần vào tăng nguy cơ huyết khối trong stent muộn và rất muộn so với stent trần kim loại trần. Các stent polymer phân hủy sinh học và stent không polymer giúp khắc phục hạn chế này, tăng tính dung nạp sinh học cho stent phủ thuốc.

Hình 5: So sánh cấu tạo một số loại stent phủ thuốc
TÀI LIỆU THAM KHẢO
- Price, M. J. (2013). Coronary Stenting: A Companion to Topol’s Textbook of Interventional Cardiology E-Book. Elsevier Health Sciences.
- Grossman, W. (2006). Grossman’s cardiac catheterization, angiography, and intervention. Lippincott Williams & Wilkins.
- Topol, E. J., & Teirstein, P. S. (2015). Textbook of Interventional Cardiology E-Book. Elsevier Health Sciences.
- Nguyen, T. N., Colombo, A., Hu, D., Grines, C. L., & Saito, S. (2003). Practical handbook of advanced interventional cardiology. Blackwell Publishing Limited.
- Kern, M. J., Berger, P. B., Block, P. C., & Klein, L. W. (Eds.). (2007). SCAI interventional cardiology board review book. Lippincott Williams & Wilkins.
Câu hỏi lượng giá
1. Tên của stent mạch vành được đặt đầu tiên trên người là gì?
a. XIENCE
b. NOBORI
c. WALLSTENT
d. GIANTUCO-ROBIN
e. TAXUS
2. Stent nào sau đây có bề dày mắt cáo stent nhỏ nhất?
a. TAXUS
b. YUKON PC
c. RESOLUTE
d. PROMUS
e. ORSIRO
3. Khả năng chịu nén theo chiều ngang là gì?
a. Đại lượng đo lường sức mạnh của khung stent và khả năng duy trì lòng mạch của stent sau can thiệp
b. Khả năng hiển thị stent trên màn huỳnh quang
c. Khả năng chống lại sự đè ép hoặc kéo dài stent do lực đẩy hoặc lực kéo
d. Khả năng của stent để thích ứng với độ cong tự nhiên của động mạch được can thiệp
e. Lực cần thiết để uốn cong stent với một bán kính cong cụ thể
4. Stent nào sau đây có khung stent là hợp kim Bạch kim-Crôm (PtCr)?
a. BIOMATRIX
b. COMBO
c. ULTIMASTER
d. SYNERGY
e. DESYNE
5. Stent nào sau đây có lớp polymer tự tiêu?
a. XIENCE
b. RESOLUTE
c. CYPHER
d. COMBO
e. TAXUS