Bệnh Parkinson là một rối loạn thoái hóa chậm tiến triển, được đặc trưng bởi run tĩnh trạng, tăng trương lực cơ, giảm vận động và vận động chậm, và sau cùng ổn định tư thế và/hoặc dáng đi. Chẩn đoán là lâm sàng. Điều trị nhằm mục đích khôi phục chức năng dopaminergic trong não bằng levodopa cộng với carbidopa và/hoặc các thuốc khác (ví dụ, các chất ức chế dopamine, thuốc ức chế monoamine oxidase loại B [MAO-B], amantadine). Đối với thể kháng trị, vô hiệu hóa các triệu chứng ở bệnh nhân không có sa sút trí tuệ, kích thích não sâu hoặc phẫu thuật tổn thương có định vị, levodopa và apomorphine có thể có hiệu quả.
Bệnh Parkinson ảnh hưởng đến:
0,4% số người > 40 tuổi
1% người ≥ 65 tuổi
10% người ≥ 80 tuổi
Tuổi trung bình khi khởi phát khoảng 57 năm.
Parkinson thường mang tính tự phát.
Hội chứng liệt rung parkinson vị thành niên hiếm gặp, bắt đầu trong thời thơ ấu hoặc thanh thiếu niên lên đến 20 tuổi. Sự khởi phát giữa tuổi 21 và 40 tuổi đôi khi được gọi là Parkinson trẻ hay Parkinson khởi phát sớm. Nguyên nhân di truyền có nhiều khả năng trong bệnh Parkinson vị thành niên và khởi phát sớm; những dạng này có thể khác với bệnh Parkinson
Chúng tiến triển chậm hơn.
Chúng rất nhạy cảm với các phương pháp điều trị bằng dopaminergic.
Hầu hết các khuyết tật là kết quả của các triệu chứng không vận động như trầm cảm, lo lắng và đau.
Bệnh parkinson thứ phát là sự rối loạn chức năng của não được đặc trưng bởi sự tắc nghẽn dopaminergic hạch nền tương tự như Parkinson, nhưng do một nguyên nhân khác (ví dụ như thuốc, bệnh mạch não, chấn thương, thay đổi sau bệnh não).
Hội chứng liệt rung parkinson không điển hình đề cập đến một nhóm các bệnh lý thoái hóa thần kinh có một số đặc điểm tương tự như bệnh Parkinson nhưng có một số đặc điểm lâm sàng khác nhau, tiên lượng xấu hơn, đáp ứng hạn chế hoặc không đáp ứng với levodopa, và một bệnh lý khác (ví dụ như các bệnh lý thoái hóa thần kinh như teo đa hệ thống, liệt trên nhân tiến triển, sa sút trí tuệ thể Lewy, và thoái hoá vỏ não hạch đáy).
Sinh lý bệnh của bệnh Parkinson
Synuclein là một protein tế bào thần kinh và tế bào thần kinh đệm có thể kết hợp thành các sợi không hòa tan và hình thành các cơ quan Lewy.
Các dấu hiệu bệnh lý nổi bật của bệnh Parkinson lẻ tẻ hoặc vô căn là
Các thể Lewy chứa đầy synuclein trong hệ thống nhân đen
Tuy nhiên, synuclein có thể tích tụ ở nhiều bộ phận khác của hệ thần kinh, bao gồm các nhân vận động sau của dây thần kinh phế vị, hạt nhân cơ bản của Meynert, vùng dưới đồi, vỏ não, khứu giác, dây thần kinh giao cảm và đường dẫn thần kinh của đường tiêu hoá. Thể Lewy xuất hiện theo trình tự thời gian, và nhiều chuyên gia tin rằng Parkinson là một sự phát triển tương đối muộn trong bệnh cảnh hệ thống synuclein. Các bệnh lý synuclein khác (rối loạn lắng đọng synuclein) bao gồm SSTT thể Lewy và teo đa hệ thống. Parkinson có thể cùng có các đặc điểm với các bệnh lý synuclein khác, như rối loạn thần kinh tự chủ và sa sút trí tuệ.
Parkinson hiếm khi xuất hiện xảy ra mà không có thể Lewy (ví dụ, trong đột biến gen PARK 2).
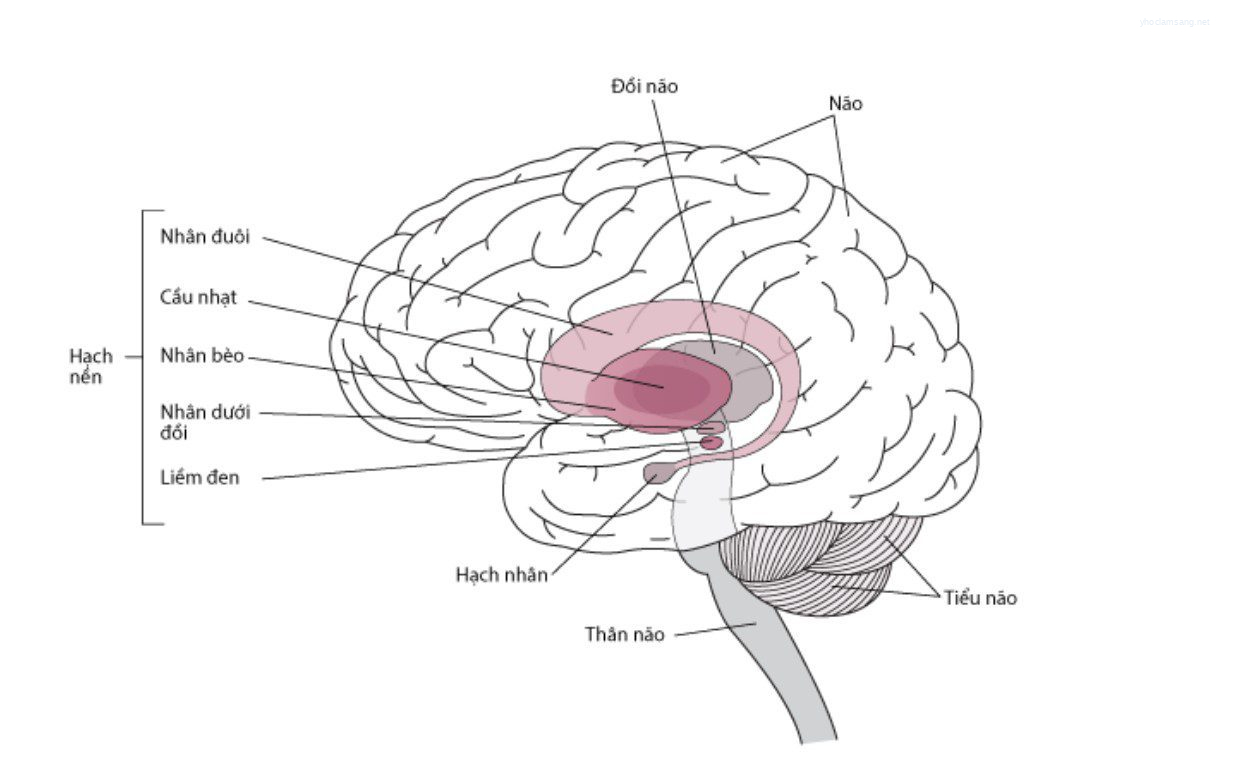
Trong bệnh Parkinson, các neuron sắc tố của liềm đen, nhân cầu, và các nhóm tế bào dopaminergic não khác có sự thoái hóa. Mất các tế bào thần kinh liềm đen gây ra sự suy giảm dopamine ở mặt lưng bèo sẫm (một phần của các hạch nền) và gây ra nhiều biểu hiện vận động trong Parkinson (Xem hình Hạch nền).
Hình 1. Hạch nền
Căn nguyên của bệnh Parkinson
Khuynh hướng di truyền có thể xảy ra, ít nhất trong một số trường hợp Parkinson. Khoảng 10% bệnh nhân có tiền sử gia đình Parkinson. Một số gen bất thường đã được xác định. Di truyền gen trội đối với một số gen và gen lặn với số còn lại. Đột biến lặp lại giàu leucine 2LRRK2; còn được gọi là PARK8) là một gen mã hóa cho protein dardarin. Trên toàn thế giới, nó là đột biến phổ biến nhất trong các trường hợp bệnh Parkinson lẻ tẻ ở bệnh nhân ≥ 50 (khoảng 2%), và nó là đột biến gen trội phổ biến nhất của các dạng di truyền của bệnh.
Trong các dạng di truyền, tuổi khởi phát có xu hướng trẻ hơn, nhưng thường khá nhẹ hơn so với khởi phát muộn, dạng Parkinson có lẽ là không di truyền.
Biểu hiện lâm sàng của bệnh Parkinson
Ở hầu hết bệnh nhân, các triệu chứng của bệnh Parkinson bắt đầu một cách âm thần.
Run tĩnh trạng ở một tay thường là triệu chứng đầu tiên. Triệu chứng run được mô tả như sau:
Chậm và thô
Run đạt cường độ tối đa khi nghỉ ngơi, giảm đi trong quá trình vận động và biến mất trong khi ngủ
Biên độ tăng lên do căng thẳng cảm xúc hoặc mệt mỏi
Run thường xuất hiện ở cổ tay và ngón tay, đôi khi xuất hiện khi ngón tay cái di chuyển ngược hướng ngón trỏ (lăn viên thuốc), như khi cuộn một viên thuốc trong tay hoặc xử lý một vật nhỏ.
Thông thường, tay hoặc chân bị ảnh hưởng đầu tiên, thường là bất đối xứng. Hàm và lưỡi cũng có thể bị ảnh hưởng, nhưng tiếng nói không bị ảnh hưởng. Tuy nhiên, giọng nói có thể trở nên giảm âm, đặc trưng đơn điệu, đôi khi nói lắp. Run có thể trở nên ít nổi bật hơn khi độ cứng tiến triển. Trong các dạng bệnh Parkinson chủ yếu là chậm động-đơ cứng, run khi nghỉ ngơi khó thấy hoặc không có.
Tăng trương lực cơ tiến triển độc lập với triệu chứng run ở nhiều bệnh nhân. Khi bác sĩ lâm sàng di chuyển một khớp cứng, xảy ra hiện tượng giật theo bán chu kỳ do cường độ của độ cứng thay đổi, gây ra hiệu ứng giống như bánh cóc (độ cứng bánh răng).
Giảm vận động và vận động chậm mang tính điển hình trong bệnh Parkinson. Vận động lặp đi lặp lại dẫn đến giảm biên độ tiến triển kéo dài hoặc kéo dài (giảm vận động) và vận động trở nên khó khăn.
Tăng trương lực cơ và giảm vận động có thể góp phần làm đau cơ và gây cảm giác mệt mỏi. Khuôn mặt bệnh nhân đông cứng dưới dạng “mặt nạ” (hypomimic), miệng mở và giảm nháy mắt. Tình trạng tăng tiết nước bọt có thể góp phần gây tàn tật.
Giảm vận động và kiểm soát kém ngọn chi gây ra triệu chứng viết chữ nhỏ và làm cho sinh hoạt hàng ngày càng lúc càng khó khăn.
Mất ổn định tư thế có thể phát triển muộn hơn trong bệnh Parkinson; Nếu xuất hiện khi khởi phát bệnh, nên nghi ngờ chẩn đoán thay thế. Bệnh nhân gặp khó khăn trong việc khởi đầu các động tác đi bộ, xoay vòng và dừng lại. Họ bước đi theo kiểu lê bước, các bước chân ngắn, tay giữ ở tư thế uốn cong lên eo, trong mỗi bước tiến, bệnh nhân không vung cánh tay, hoặc vung rất ít. Các bước có thể vô tình trở nên nhanh hơn, nhưng chiều dài các bước ngắn lại; sự thay đổi bất thường về dáng đi này thường là tiền triệu của hiện tượng đóng băng dáng đi (khi, không có cảnh báo, đi bộ và các động tác tự nguyện khác có thể đột ngột dừng lại). Bệnh nhân có xu hướng nghiêng về phía trước, hoặc sau do mất trọng tâm cơ thể, nguyên nhân do mất phản xạ tư thế. Tư thế bệnh nhân trở nên cúi gù.
Sa sút trí tuệ tiến triển ở khoảng một phần ba bệnh nhân, thường Bệnh Parkinson là trong giai đoạn muộn. Các yếu tố dự báo tiến triển sớm của bệnh là suy giảm khả năng cảm nhận không gian (ví dụ như lái xe bị lạc) và giảm khả năng nói trôi chảy.
Rối loạn giấc ngủ là triệu chứng phổ biến. Mất ngủ có thể là do tiểu đêm, hoặc do không có khả năng quay trở lại giường. Việc thiếu ngủ có thể gây trầm cảm và suy giảm nhận thức, và làm tăng quá mức cảm giác buồn ngủ ban ngày. Rối loạn hành vi giấc ngủ nhanh REM có thể xuất hiệnn; trong chứng rối loạn này, phát âm và các cử động chân tay không kiểm soát được, có thể bạo lực xảy ra trong giấc ngủ REM vì tình trạng tê liệt thường xảy ra trong giấc ngủ REM không có. Rối loạn hành vi giấc ngủ REM thường đi kèm với các dấu hiệu thoái hóa thần kinh ban đầu, chủ yếu xảy ra ở những bệnh nhân mắc bệnh bạch cầu đồng nhân alpha, có thể báo trước và/hoặc làm tăng nguy cơ bị bệnh Parkinson, teo nhiều hệ thống hoặc sa sút trí tuệ có thể Lewy.
Các triệu chứng thần kinh không liên quan đến bệnh Parkinson thường tiến triển bởi bệnh lý synuclein xuất hiện ở các khu vực khác của hệ thần kinh trung ương, ngoại biên và thần kinh tự chủ.
Sau đây là các ví dụ:
Thoái hóa thần kinh ở gần như toàn bộ thần kinh giao cảm chi phối tim, góp phần gây hạ huyết áp tư thế đứng
Rối loạn vận động thực quản, góp phần gây triệu chứng khó nuốt và tăng nguy cơ viêm phổi hít
Rối loạn vận động trực tràng, góp phần gây táo bón
Tiểu gấp và/hoặc ngắt quãng, có thể dẫn đến đái dầm (thường gặp)
Mất khứu giác (thường gặp)
Ở một số bệnh nhân, các triệu chứng này xuất hiện trước các triệu chứng vận động của Parkinson và thường xấu đi theo thời gian.
Viêm da tiết bã cũng là tình trạng rất phổ biến.
Chẩn đoán bệnh Parkinson
Chủ yếu đánh giá dựa vào lâm sàng, dựa trên các triệu chứng vận động
Chẩn đoán bệnh Parkinson chủ yếu dựa vào lâm sàng. Nghi ngờ Parkinson ở những bệnh nhân có run cơ một bên khi nghỉ, giảm vận động, hoặc tăng trương lực cơ. Trong quá trình làm test ngón tay chỉ mũi, triệu chứng run sẽ biến mất (hoặc giảm đi) tại chi đang được khám.
Trong quá trình khám thần kinh, bệnh nhân không thể thực hiện các động tác luân phiên hoặc kế tiếp nhanh. Cảm giác và cơ lực thường là bình thường. Phản xạ bình thường, nhưng bệnh nhân có thể gặp khó khăn do run hoặc tăng trương lực cơ.
Biểu hiện chậm và giảm vận động trong Parkinson phải được phân biệt với tình trạng giảm vận động và co cứng do tổn thương dải vỏ tủy. Không như Parkinson, tổn thương dải vỏ tủy gây ra
Liệt ưu thế ở ngọn chi.
Tăng phản xạ
Đáp ứng duỗi ngón chân (dấu hiệu Babinski)
Tăng trương lực cơ tương ứng với tần số và mức độ kéo giãn đặt lên cơ đó, cho đến khi kháng trở đột ngột biến mất (hiện tượng dao gấp)
Chẩn đoán Parkinson được hỗ trợ bởi sự hiện diện của các triệu chứng khác như nháy mắt không thường xuyên, khuôn mặt kém biểu cảm, và bất thường dáng đi. Sự mất ổn định tư thế cũng có mặt, nhưng nếu nó xảy ra sớm trong bệnh, bác sĩ lâm sàng nên xem xét các chẩn đoán khác.
Ở những bệnh nhân lớn tuổi, phải loại trừ các nguyên nhân khác có thể gây giảm cử động tự phát hoặc dáng đi bước ngắn, chẳng hạn như trầm cảm nặng, suy giáp hoặc sử dụng thuốc chống loạn thần hoặc một số loại thuốc chống nôn trước khi chẩn đoán bệnh Parkinson.
Để giúp phân biệt bệnh Parkinson với hội chứng liệt rung Parkinson thứ phát hoặc không điển hình, các bác sĩ lâm sàng thường khảo sát đáp ứng với levodopa. Một phản ứng lớn, liên tục hỗ trợ mạnh mẽ bệnh Parkinson. Đáp ứng nhẹ hoặc không đáp ứng với levodopa với liều ít nhất 1200 mg/ngày gợi ý một dạng hội chứng liệt rung Parkinson khác. Các nguyên nhân gây bệnh Parkinson thứ phát hoặc không điển hình có thể được xác định thông qua
Tiền sử bao gồm cả nghề nghiệp, ma túy, và gia đình
Đánh giá các khiếm khuyết thần kinh đặc trưng của các bệnh lý khác ngoài Parkinson
Chỉ định các phương tiện chẩn đoán hình ảnh thần kinh khi bệnh nhân có các đặc điểm lâm sàng không điển hình (ví dụ: ngã sớm, suy giảm nhận thức sớm, vong hành ý niệm vận động [không có khả năng bắt chước cử chỉ bằng tay], tăng phản xạ)
Điều trị bệnh Parkinson
Carbidopa/levodopa (điều trị chính)
Amantadine, ức chế MAO loại B (MAO-B), hoặc thuốc ức chế cholinergic ở một vài bệnh nhân
Các chất chủ vận dopamin
Catechol O-metyltransferase (COMT), luôn được sử dụng với levodopa, đặc biệt khi kém đáp ứng với levodopa.
Phẫu thuật nếu thuốc không kiểm soát đầy đủ các triệu chứng, hoặc không dung nạp với các tác dụng phụ.
Tập luyện và các biện pháp thích nghi
Nhiều loại thuốc uống thường được sử dụng để làm giảm các triệu chứng của bệnh Parkinson (xem bảng Một số Thuốc Antiparkinsonian Đường uống Thường được Sử dụng).
Levodopa là phương pháp điều trị hiệu quả nhất. Tuy nhiên, khi bệnh Parkinson trở nên nặng hơn, đôi khi tiến triển sớm ngay sau chẩn đoán, đáp ứng với levodopa có thể trở nên mờ nhạt dần, tạo ra các dao động trong triệu chứng vận động và rối loạn vận động (xem bên dưới). Để giảm thời gian dùng levodopa và từ đó giảm thiểu những ảnh hưởng này, bác sĩ lâm sàng có thể xem xét điều trị cho bệnh nhân trẻ tuổi có khiếm khuyết nhẹ với những thuốc đầu:
Chất ức chế MAO-B (selegiline, rasagiline)
Các chất chủ vận dopamine (ví dụ pramipexole, ropinirole, rotigotine)
Amantadine (đây cũng là lựa chọn tốt nhất khi cố giảm liều tối đa)
Tuy nhiên, nếu những thuốc này không kiểm soát được các triệu chứng, bác sĩ lâm sàng nên bắt đầu dùng levodopa ngay vì nó có thể cải thiện chất lượng cuộc sống. Các bằng chứng cho thấy levodopa không có hiệu quả do tiến triển bệnh chứ không phải bệnh tiến triển do tích lũy levodopa như các quan niệm trước đây, vì vậy việc sử dụng levodopa sớm không đẩy nhanh tiến trình vô hiệu hóa tác dụng của thuốc.
Liều thường giảm ở người lớn tuổi. Nên tránh các thuốc gây ra hoặc làm trầm trọng thêm triệu chứng, đặc biệt là thuốc an thần.
Levodopa
Levodopa, tiền chất của dopamine, vượt qua được hàng rào máu-não vào các hạch nền, nơi nó được decarboxylated hóa để hình thành dopamine. Dùng chung với carbidopa ức chế decarboxylase ngoại vi ngăn không cho levodopa bị khử carboxyl thành dopamine bên ngoài não (ngoại vi), do đó làm giảm liều levodopa cần thiết để tạo ra nồng độ điều trị trong não và giảm thiểu tác dụng phụ do dopamine trong tuần hoàn ngoại vi.
Levodopa có hiệu quả nhất trong việc giảm thiểu vận động chậm và độ cứng nhắc và thường làm giảm đáng kể tình trạng run.
Các tác dụng phụ ngắn hạn thường gặp của levodopa là:
Buồn nôn
Nôn
Mê sảng
Tác dụng phụ lâu dài bao gồm:
Các bệnh lý tâm thần (ví dụ, mê sảng, hoang tưởng, ảo giác thị giác, triệu chứng punding [các hành vi khuôn mẫu, phức tạp, lặp lại])
Rối loạn chức năng vận động (ví dụ như rối loạn vận động, dao động vận động)
Ảo giác và hoang tưởng xảy ra thường xuyên nhất ở người cao tuổi và ở những bệnh nhân suy giảm nhận thức hoặc sa sút trí tuệ.
Liều gây rối loạn vận động có xu hướng giảm khi bệnh tiến triển. Theo thời gian, liều cần thiết cho lợi ích điều trị càng tiến gần đến liều gây rối loạn vận động.
Liều dùng carbidopa/levodopa tăng lên mỗi 4-7 ngày theo dung nạp của bệnh nhân, cho đến khi đạt được lợi ích tối đa, hoặc cho đến khi các tác dụng bất lợi tiến triển. Nguy cơ các phản ứng phụ có thể được giảm thiểu bằng cách bắt đầu với liều thấp, như liều nửa viên kết hợp 25/100 mg carbidopa/levodopa/lần 3 hoặc 4 lần mỗi ngày (12,5/50 mg/lần 3 hoặc 4 lần mỗi ngày), và tăng liều chậm đến khoảng 25/100 mg viên nén đến 4 lần mỗi ngày. Dựa vào sự dung nạp và đáp ứng của bệnh nhân, bác sĩ lâm sàng có thể tăng liều mỗi tuần lên đến 2 hoặc 3 viên, 4 lần/ngày. Trong những trường hợp ít phổ biến hơn, liều levodopa có thể tăng lên đến 3 viên 5 lần mỗi ngày. Hầu hết các bệnh nhân Parkinson cần sử dụng tổng liều levodopa 400-1200 mg/ngày levodopa chia ra mỗi 2 đến 5 giờ, nhưng rất hiếm bệnh nhân suy giảm hấp thu cần liều tổng có thể lên đến 3000 mg/ngày.
Tốt hơn là không nên dùng levodopa cùng với thức ăn vì protein có thể làm giảm sự hấp thu của levodopa. 4 đến 5 liều levodopa mỗi ngày được khuyến cáo để giảm tác dụng thay đổi nồng độ levodopa trên các hạch nền khác nhau có thể gây ra các dao động vận động và rối loạn vận động.
Nếu tác dụng không mong muốn ở ngoại vi của levodopa (ví dụ như buồn nôn, nôn, chóng mặt tư thế) chiếm ưu thế, tăng liều carbidopa có thể có tác dụng. Liều carbidopa lên đến 150 mg là an toàn và không làm giảm hiệu quả của levodopa.
Domperidone có thể được sử dụng để điều trị các tác dụng phụ của levodopa (và các thuốc chống parkinson khác). Nó chặn các thụ thể dopamine ngoại vi và không vượt qua hàng rào máu-não để ảnh hưởng đến não. Bằng cách giảm sự khử carboxyl của levodopa thành dopamine, domperidone làm giảm tác dụng phụ ngoại biên của levodopa, do đó làm giảm buồn nôn, nôn và hạ huyết áp tư thế đứng. Liều lượng khuyến cáo là
Giải phóng tức thì: 10 mg uống 3 lần mỗi ngày, tăng lên đến 20 mg 3 lần mỗi ngày
Phóng thích kéo dài: 30 đến 60 mg một lần vào buổi sáng (liều này có thể đủ để kiểm soát tác dụng phụ ngoại vi của levodopa)
Domperidone không thường xuyên có sẵn ở Mỹ.
Dạng uống carbidopa/levodopa hòa tan phóng thích nhanh có thể sử dụng mà không cần uống nước; đây là dạng thuốc rất hữu ích cho những bệnh nhân khó nuốt. Liều tương tự như đối với carbidopa/levodopa phóng thích tức thì không thể phân giải.
Hiện cũng có cả các dạng chế phẩm carbidopa/levodopa dạng phóng thích kiểm soát; tuy nhiên, nó thường được sử dụng chỉ để điều trị các triệu chứng về đêm, bởi nếu uống cùng bữa ăn, thuốc có thể bị hấp thu thất thường, tồn tại dạ dày lâu hơn các dạng phóng thích nhanh.
Các hình thức sinh con mới của levodopa đã có sẵn hoặc đang được phát triển, nhưng chưa có hình thức nào vượt trội hơn carbidopa/levodopa 25/100 mg.
Đôi khi, levodopa phải được sử dụng để duy trì chức năng vận động, dù bệnh nhân có ảo giác hoặc sảng do levodopa. Trong những trường hợp như vậy, ảo giác và mê sảng có thể được điều trị bằng thuốc.
Điều trị loạn thần bằng quetiapine đường uống hoặc clozapine; những loại thuốc này, không giống như các thuốc an thần khác (ví dụ risperidone, olanzapine, tất cả các chứng tâm thần điển hình), không làm trầm trọng thêm các triệu chứng của bệnh Parkinson. Quetiapine có thể bắt đầu ở 25 mg vào ban đêm và tăng dần theo liều 25 mg mỗi 1 đến 3 ngày, lên đến 400 mg vào ban đêm, hoặc 200mg x 2 lần mỗi ngày. Mặc dù clozapine có hiệu quả nhất, nhưng việc sử dụng clozapine rất hạn chế vì nguy cơ giảm bạch cầu đa nhân trung tính (ước tính xảy ra ở 1% bệnh nhân). Khi dùng clozapine, liều khởi đầu là 12,5 đến 50 mg/ngày, tăng lên từ 12,5 – 25 mg/lần x 2 lần mỗi ngày. Xét nghiệm công thức máu hàng tuần trong 6 tháng đầu, mỗi 2 tuần trong 6 tháng sau, và sau đó là mỗi 4 tuần. Tuy nhiên, tần số làm xét nghiệm có thể khác nhau tùy thuộc vào số lượng bạch cầu. Bằng chứng gần đây cho thấy rằng pimavanserin có hiệu quả đối với các triệu chứng bệnh tâm thần và không làm trầm trọng thêm các triệu chứng parkinson; cũng như việc theo dõi thuốc dường như không cần thiết. Trong khi chưa xác nhận được hiệu quả và sự an toàn, pimavanserin có thể trở thành thuốc được lựa chọn để điều trị loạn thần ở bệnh nhân Parkinson.
Sau khi điều trị từ 2 đến 5 năm, hầu hết bệnh nhân gặp giảm đáp ứng với levodopa, và kiểm soát triệu chứng có thể dao động bất thường giữa hiệu quả và không hiệu quả (biến động) bởi đáp ứng với levodopa bắt đầu mờ nhạt dần. Triệu chứng có thể xảy ra trước liều dự tính kế tiếp (hiện tượng mất hiệu quả). Hiện tượng rối loạn vận động và mất tác dụng thuốc xảy ra do sự tiến triển của bệnh và sự kết hợp các đặc tính dược động học của levodopa, (đặc biệt là thời gian bán hủy ngắn vì nó là thuốc uống) và tiến triển bệnh.
Trong giai đoạn sớm của bệnh Parkinson, có đủ các tế bào thần kinh sống sót để đệm bất kỳ sự quá bão hòa của các thụ thể dopaminergic trong substantia nigra. Kết quả là, rối loạn vận động ít có khả năng xảy ra, và hiệu quả điều trị của levodopa kéo dài hơn do sự tái hấp thu của levodopa quá mức và tái sử dụng nó. Khi các tế bào thần kinh dopaminergic bị cạn kiệt hơn nữa, mỗi liều levodopa bão hòa ngày càng nhiều thụ thể dopamine, dẫn đến rối loạn vận động và dao động vận động vì việc phân phối levodopa đến liềm đen phụ thuộc vào thời gian bán hủy trong huyết tương của levodopa (1,5 đến 2 giờ).
Tuy nhiên, rối loạn vận động chủ yếu do tiến triển của bệnh và không liên quan trực tiếp đến việc tiếp xúc tích lũy với levodopa, như đã tin trước đây. Tiến triển của bệnh liên quan đến việc sử dụng levodopa đường uống dễ dàng, làm nhạy cảm và thay đổi các thụ thể glutamatergic, đặc biệt là các thụ thể NMDA (N-methyl-d-aspartate). Cuối cùng, thời gian cải thiện sau mỗi liều rút ngắn, và rối loạn vận động do thuốc gây ra dẫn đến sự thay đổi từ rối loạn vận động thành rối loạn vận động. Thông thường, những thay đổi như vậy được kiểm soát bằng cách giữ liều levodopa càng thấp càng tốt, sử dụng các khoảng liều càng ngắn càng tốt, từ 1 đến 2 giờ, tuy nhiên điều này khó thực hiện. Các phương pháp thay thế nhằm làm giảm thời gian nghỉ (bất động) bao gồm sử dụng chất chủ vận dopamine, cũng như các chất ức chế COMT và/hoặc MAO; amantadine có thể giúp kiểm soát tình trạng rối loạn vận động.
Dạng bào chế levodopa/carbidopa gel đường ruột (có sẵn ở Châu Âu) có thể được bơm trực tiếp vào ruột non qua sonde mở thông. Dạng bào chế này đang được nghiên cứu điều trị cho những bệnh nhân có tình trạng dao động vận động và/hoặc rối loạn vận động nặng, không đáp ứng với thuốc và những người không đủ tiêu chuẩn để thực hiện kích thích não sâu. Dạng bào chế này dường như làm giảm đáng kể thời gian nghỉ và giúp gia tăng chất lượng cuộc sống.
Amantadine
Amantadine thường được sử dụng để:
Cải thiện các rối loạn vận động thứ phát sau levodopa
Giảm triệu chứng run
Amantadine rất hữu ích khi dùng đơn trị liệu hội chứng liệt rung parkinson giai đoạn sớm, và sau đó có thể được sử dụng để làm tăng tác dụng của levodopa. Nó có thể làm tăng hoạt tính dopaminergic, các hiệu ứng kháng cholinergic, hoặc cả hai. Amantadine cũng là một chất đối kháng thụ thể NMDA và do đó có thể giúp làm chậm sự tiến triển của Parkinson và rối loạn vận động. Nếu dùng đơn trị liệu, amantadine thường mất tác dụng sau vài tháng.
Các chất chủ vận dopamin
Những thuốc này kích hoạt trực tiếp thụ thể dopamine trong hạch nền. Chúng bao gồm
Pramipexole (uống 0,75 đến 4,5 mg/ngày [tổng liều hàng ngày])
Ropinirol (uống 3 đến 6 mg/ngày đến 24 mg/ngày [tổng liều hàng ngày])
Rotigotine (tiêm qua da từ 2 đến 8 mg [tổng liều hàng ngày])
Apomorphine (tiêm từ 2 đến 30 mg [tổng liều hàng ngày])
Apomorphine được sử dụng để điều trị vận động chậm ngắt quãng cấp tính; liều lượng là 2 đến 30 mg tiêm dưới da khi cần, bắt đầu từ 2 mg 1 lần/ngày, sau đó tăng dần lên đến tối đa 6 mg, 5 lần/ngày).
Bromocriptine vẫn có thể được sử dụng ở một số quốc gia, nhưng ở Bắc Mỹ, nó chủ yếu chỉ để điều trị u tuyến yên bởi làm tăng nguy cơ xơ hóa van tim và xơ hóa phế nang.
Pergolide, một chất chủ vận dopamine có nguồn gốc từ ergot, đã được đưa ra khỏi thị trường vì nó làm tăng nguy cơ xơ hóa van tim.
Các chất chủ vận dopamine đường uống có thể được sử dụng đơn trị, nhưng hiếm khi duy trì hiệu quả quá một vài năm. Sử dụng các thuốc này sớm trong điều trị, với liều nhỏ levodopa, có thể hữu ích ở những bệnh nhân có nguy cơ cao rối loạn vận động và các tác dụng phụ (như ở bệnh nhân < 60 tuổi). Tuy nhiên, các thuốc chủ vận dopamine có thể có ích ở tất cả các giai đoạn của bệnh, bao gồm cả điều trị bổ trợ ở giai đoạn sau. Các tác dụng không mong muốn có thể hạn chế việc sử dụng các chất chủ vận dopamine đường uống. Ở 1-2% bệnh nhân, các thuốc này có thể gây nghiện bài bạc, nghiện mua sắm, gia tăng nhu cầu tình dục, hoặc ăn quá nhiều, do đó cần giảm liều hoặc dừng thuốc, và nếu có thể, tránh sử dụng nhóm thuốc này.
Pramipexole và ropinirole, cho uống, có thể được sử dụng thay thế hoặc với levodopa trong bệnh Parkinson sớm hoặc, nếu cần thiết và không chống chỉ định, có thể được thêm vào điều trị trong bệnh tiến triển. Các loại thuốc này có thời gian bán hủy từ 6 đến 12 giờ và có thể được dùng dưới dạng các chế phẩm ngay lập tức 3 lần mỗi ngày. Chúng cũng có thể được dùng dưới dạng các chế phẩm phóng thích kéo dài một lần/ngày, giúp giảm thiểu tối đa các đỉnh và đáy. Buồn ngủ ban ngày là một tác dụng phụ thường gặp.
Rotigotine, bôi hoặc dán qua da một lần/ngày, kích thích dopaminergic liên tục hơn các loại thuốc qua các đường khác. Liều khởi đầu ở liều 2 mg một lần/ngày và thường tăng lên 6 mg một lần/ngày. Ở các vùng khác ngoài Hoa Kỳ, có thể khuyến cáo dùng liều cao hơn (8 mg).
Apomorphine là một chất chủ vận dopamine đường tiêm, được sử dụng với vai trò cứu hộ, khi những hiện tượng mất tác dụng thuốc xảy ra thường xuyên và ở mức độ nặng. Khởi phát tác dụng rất nhanh (5 đến 10 phút), nhưng khoảng thời gian ngắn (60 đến 90 phút). Apomorphine 2 đến 6 mg tiêm dưới da có thể được dùng đến 5 lần một ngày nếu cần. Test thử nghiệm 2 mg trước tiên để đánh giá hạ huyết áp tư thế đứng. Đo huyết áp ở vị trí nằm và đứng trước khi dùng thuốc và 20, 40, và 60 phút sau đó. Các tác dụng không mong muốn khác tương tự như các thuốc chủ vận dopamine khác. Phòng ngừa triệu chứng buồn nôn bằng cách bắt đầu trimethobenzamide đường uống 300 mg 3 lần mỗi ngày vào 3 ngày trước khi bắt đầu dùng apomorphine và tiếp tục dùng trimethobenzamide trong vòng 2 tháng đầu điều trị.
Apomorphine tiêm dưới da hiện đã có tại một số quốc gia; nó có thể được sử dụng thay thế levodopa bơm trực tiếp qua đường ruột ở bệnh nhân parkinson tiên triển và những người không đủ tiêu chuẩn phẫu thuật chức năng.
Các chất ức chế MAO-B chọn lọc
Những chất ức chế có chọn lọc MAO-B bao gồm selegiline và rasagiline.
Selegiline ức chế một trong hai enzyme chính phá vỡ dopamine trong não, qua đó kéo dài tác dụng của mỗi liều levodopa. Ở một số bệnh nhân có hiện tượng mất tác dụng mức độ nhẹ, selegiline giúp kéo dài hiệu quả của levodopa. Sử dụng dưới dạng đơn trị liệu khởi đầu, selegiline kiểm soát các triệu chứng nhẹ; do đó, có thể trì hoãn việc sử dụng levodopa lên đến 1 năm. Liều 5 mg uống 2 lần mỗi ngày không gây tăng huyết áp, do các chất chuyển hóa giống amphetamine đôi khi được kích hoạt khi bệnh nhân đang dùng chất ức chế thụ thể MAO không chọn lọc, hấp thụ thêm tyramine trong thực phẩm (ở một số pho mát). Mặc dù hầu như không có tác dụng phụ, selegiline có thể có rối loạn vận động do levodopa, các tác dụng phụ trên tâm thần và buồn nôn, do đó cần giảm liều levodopa. Selegiline cũng tồn tại trong dạng bào chế được thiết kế để hấp thụ qua niêm mạc miệng (zydis-selegiline).
Rasagiline ức chế các enzyme giống như selegiline. Nó có hiệu quả và được dung nạp tốt trong giai đoạn sớm và muộn; sử dụng rasagiline uống 1mg uống một lần mỗi ngày cũng tương tự như selegiline. Không giống như selegiline, thuốc không có các chất chuyển hóa chất amphetamine, do đó về mặt lý thuyết, nguy cơ tăng huyết áp khi bệnh nhân dùng tyramine thấp hơn với rasagiline.
Thuốc kháng cholinergic
Thuốc kháng cholinergic có thể được sử dụng đơn trị liệu trong giai đoạn sớm của Parkinson và sau đó bổ trợ cho levodopa. Chúng có hiệu quả nhất trong điều trị run. Liều thuốc tăng rất chậm. Tác dụng phụ có thể bao gồm suy giảm nhận thức và khô miệng, đặc biệt gây phiền hà cho người lớn tuổi và có thể là vấn đề chủ yếu đối với việc sử dụng các thuốc này. Do đó, thuốc kháng cholinergic thường chỉ được sử dụng ở những bệnh nhân trẻ có parkinson ưu thế run, hoặc với một số loại loạn trương lực cơ. Trong một số hiếm các trường hợp, chúng được sử dụng điều trị bổ trợ ở bệnh nhân cao tuổi không có suy giảm nhận thức hoặc rối loạn tâm thần.
Một số nghiên cứu sử dụng mô hình chuột cho thấy việc sử dụng các thuốc kháng cholinergic nên được hạn chế bởi vì các thuốc này làm tăng bệnh lý tau và sự thoái hóa thần kinh; mức độ tăng tương quan với tác động kháng cholinergic của thuốc (1, 2).
Các thuốc kháng cholinergic thường được sử dụng bao gồm
Benztropine: 0,5 mg vào ban đêm lên đến 1 mg 2 lần mỗi ngày đến 2 mg 3 lần mỗi ngày
Trihexyphenidyl: 1 mg 3 lần mỗi ngày lên đến 2 đến 5 mg 3 lần mỗi ngày
Thuốc kháng histamine có tác dụng kháng cholinergic có thể điều trị run hiệu quả (ví dụ, diphenhydramine 25 đến 50 mg 2 đến 4 lần mỗi ngày, hoặc phenadrine 50 mg uống 1 đến 4 lần mỗi ngày) đôi khi hữu ích để điều trị chứng run.
Thuốc chống trầm cảm kháng cholinergic (ví dụ, amitriptyline 10 đến 150 mg đường uống trước khi đi ngủ) có thể hỗ trợ cho levodopa trong bệnh trầm cảm.
Chất ức chế Catechol O-metyltransferase (COMT)
Các thuốc này (ví dụ entacapone, tolcapone) ức chế sự phân hủy levodopa và dopamine và do đó hỗ trợ cho levodopa. Chúng được sử dụng phổ biến ở những bệnh nhân dùng levodopa trong thời gian dài khi đáp ứng với levodopa đang kém đi vào cuối khoảng thời gian dùng thuốc (được gọi là hiệu ứng lu mờ)
Entacapone có thể được sử dụng kết hợp với levodopa và carbidopa. Đối với mỗi liều levodopa, sử dụng thêm 200 mg entacapone, tối đa 200 mg 8 lần mỗi ngày.
Tolcapone là một chất ức chế COMT mạnh hơn bởi vì nó có thể vượt qua hàng rào máu-não; tuy nhiên, nó ít phổ biến hơn vì đã có báo cáo về độc tính trên gan của loại thuốc này. Đây là một lựa chọn thích hợp nếu entacapone không kiểm soát được các triệu chứng. Liều cho tolcapone tăng dần từ 100 lên đến 200 mg/lần 3 lần mỗi ngày. Men gan phải được theo dõi định kỳ. Nên ngừng Tolcapone nếu nồng độ alanine aminotransferase (ALT) hoặc aspartate aminotransferase (AST) tăng lên gấp đôi giới hạn trên của mức bình thường hoặc cao hơn hoặc nếu các triệu chứng và dấu hiệu cho thấy gan bị tổn thương.
Opicapone là một chất ức chế COMT thế hệ thứ 3 mới (gần đây đã được phê duyệt ở Mỹ) có vẻ hiệu quả và an toàn ở bệnh nhân Parkinson. Không giống như tolcapone và giống như entacapone, opicapone không cần theo dõi bằng các xét nghiệm định kỳ hoặc uống nhiều liều. Liều khuyến cáo là 50 mg khi đi ngủ.
BẢNG 1. Một số loại thuốc uống điều trị Parkinson thông thường
|
Thuốc uống |
Liều khởi đầu |
Liều hàng ngày trung bình và liều tối đa |
Tác dụng không mong muốn chính |
|---|---|---|---|
|
Tiền thân dopamine |
|||
|
Carbidopa/levodopa 10/100, 25/100 hoặc 25/250 mg (phóng thích nhanh hoặc hòa tan) |
1/2-1 viên 25/100 mg 3 hoặc 4 lần mỗi ngày |
1-3 viên nén 25/100 mg 4 lần mỗi ngày |
Trung ương: Buồn ngủ, lú lẫn, tụt huyết áp, loạn thần, ác mộng, rối loạn vận động
Ngoại vi: Buồn nôn, chán ăn, đau bụng, táo bón, đánh trống ngực
Ngưng thuốc đột ngột: Hội chứng ác tính do thuốc an thần |
|
Carbidopa/levodopa 25/100 hoặc 50/200 mg (kiểm soát phóng thích; chỉ nên dùng cho các triệu chứng vào ban đêm [không phải ban ngày]) |
1 viên 25/100 mg trước khi đi ngủ |
2 viên nén 50/200 mg trước khi đi ngủ |
|
|
Thuốc kháng vi-rút |
|||
|
Amantadine |
100 mg một lần mỗi ngày |
100-200 mg 2 lần mỗi ngày |
Lẫn lộn, bí tiểu, phù chân, tăng nhãn áp, viêm mạch mạng xanh tím
Trong một số hiếm các trường hợp, khi ngưng hoặc giảm liều: Hội chứng ác tính do thuốc an thần |
|
Các chất chủ vận dopamin |
|||
|
Pramipexole |
0,125 mg 3 lần mỗi ngày |
0,5-1 mg 3 lần mỗi ngày
Liều tối đa: 4,5 mg/ngày
Công thức giải phóng kéo dài: Có thể dùng một hoặc hai lần mỗi ngày |
Buồn nôn, nôn, choáng váng (do hạ huyết áp tư thế đứng), ảo giác, rối loạn kiểm soát xung động (cờ bạc, mua bán, ăn uống quá độ, sưu tầm)
Chỉ với miếng dán rotigotine, đỏ, ngứa và sưng tấy ở chân và tại vị trí dán thuốc |
|
Ropinirol |
0,25 mg 3 lần mỗi ngày |
3-4 mg 3 lần mỗi ngày
Liều tối đa: 24 mg/ngày
Công thức giải phóng kéo dài: Có thể được sử dụng một lần mỗi ngày |
|
|
Rotigotine |
2 mg/ngày (miếng dán) |
4, 6 hoặc 8 mg/ngày trong một miếng dán hàng ngày |
|
|
Thuốc kháng cholinergic* |
|||
|
Benztropine |
0,5 mg vào ban đêm |
1 mg uống 2 lần mỗi ngày – 2mg 3 lần mỗi ngày |
Khô miệng, tiết khó, táo bón, nhìn mờ
Đặc biệt ở người lớn tuổi: Lẫn lộn, sảng, giảm khả năng điều tiết thân nhiệt do giảm tiết mồ hôi |
|
Trihexyphenidyl |
1 mg 3 lần mỗi ngày |
2-5 mg 3 lần mỗi ngày |
|
|
Thuốc ức chế monoaminase oxidase loại B (MAO-B) |
|||
|
Rasagiline |
0,5 mg một lần/ngày |
1 mg một lần mỗi ngày |
Buồn nôn, mất ngủ, ngủ gà, phù |
|
Selegiline† |
5 mg x 1 lần/ngày |
5 mg 2 lần/ngày, dùng vào bữa sáng và bữa trưa |
Có thể tăng triệu chứng buồn nôn, mất ngủ, lẫn lộn và rối loạn vận động khi dùng levodopa |
|
Chất ức chế Catechol O-metyltransferase (COMT) |
|||
|
Entacapone‡ |
200 mg với mỗi liều levodopa |
200 mg với mỗi liều levodopa
Liều tối đa: 200 mg 8 lần mỗi ngày |
Do tăng sinh khả dụng của levodopa: Rối loạn vận động, buồn nôn, lú lẫn, ảo giác
Không liên quan đến levodopa: Đau lưng, tiêu chảy, thay đổi màu nước tiểu
Dùng cùng Tolcapone gây nguy cơ nhiễm độc gan (hiếm gặp) |
|
Opicapone |
50 mg trước khi đi ngủ |
50 mg trước khi đi ngủ |
|
|
Tolcapone |
100 mg đường uống 3 lần mỗi ngày |
100-200 mg 3 lần mỗi ngày |
|
|
* Không nên dùng thuốc kháng cholinergic ở người cao tuổi. Vì các thuốc này có tác dụng phụ và vì những phát hiện gần đây cho thấy các thuốc này có thể làm tăng bệnh lý tau và thoái hóa thần kinh, nên sử dụng chúng một cách hạn chế. |
|||
|
† Selegiline cũng có trong dạng bào chế được thiết kế để hấp thụ qua niêm mạc miệng. |
|||
|
‡ Entacapone cũng có trong chế phẩm viên thuốc kết hợp ba loại (carbidopa, levodopa, và entacapone). |
|||
Phẫu thuật
Nếu thuốc không hiệu quả và/hoặc có các phản ứng phụ quá nặng nề, cân nhắc kích thích não sâu và phẫu thuật vùng tổn thương.
Kích thích não sâu của nhân dưới đồi hoặc globin pallidus thường được khuyến cáo cho những bệnh nhân có rối loạn vận động hoặc dao động vận động đáng kể do levodopa; thủ thuật này có thể điều chỉnh hoạt động quá mức trong hạch nền và do đó làm giảm các triệu chứng của bệnh Parkinson ở bệnh nhân Parkinson. Đối với bệnh nhân chỉ có triệu chứng run, đôi khi khuyến cáo kích thích nhân bụng trung gian của đồi thị; tuy nhiên, vì hầu hết bệnh nhân cũng có các triệu chứng khác kèm theo, kích thích nhân dưới đồi, làm giảm run cũng như các triệu chứng khác nên thường được ưu tiên hơn. Khi vấn đề chính là kiểm soát rối loạn vận động không đầy đủ hoặc khi bệnh nhân có nguy cơ suy giảm nhận thức, thì nhân bèo là một mục tiêu tốt.
Phẫu thuật cắt tổn thương nhằm mục đích ngăn chặn sự hoạt động quá mức đường dẫn truyền từ nhân cầu nhạt trong, phẫu thuật cắt đồi thị đôi khi được thực hiện để kiểm soát triệu chứng run ở những bệnh nhân Pakinson. Tuy nhiên, phẫu thuật gây tổn thương không thể đảo ngược và không thể điều chỉnh theo thời gian; phẫu thuật gây tổn thương hai bên không được khuyến cáo bởi vì nó có thể gây ra các phản ứng phụ nghiêm trọng như khó nuốt và rối loạn vận ngôn. Chống chỉ định phẫu thuật nhân dưới đồi vì nó gây múa vung nặng.
Lựa chọn bệnh nhân là yếu tố quan trọng nhất để phẫu thuật thành công trong bệnh Parkinson. Phẫu thuật thường được xem xét khi thuốc điều trị rối loạn vận động và/hoặc biến động không hiệu quả hoặc hạn chế nghiêm trọng. Điều trị bằng thuốc có thể không đầy đủ vì thuốc có tác dụng phụ ngăn ngừa tăng liều levodopa, làm giảm triệu chứng.
Các tiêu chí lựa chọn khác bao gồm
Bệnh Parkinson từ 5 đến 15 năm
Tuổi của bệnh nhân < 70 tuổi
Không có sự suy giảm nhận thức đáng kể, không có rối loạn cảm xúc, và, tùy thuộc vào tuổi thọ, không có bệnh giai đoạn cuối (ví dụ như ung thư, suy thận mạn, suy gan, bệnh lý tim mạch, tăng huyết áp không kiểm soát được)
Bệnh nhân bị suy giảm nhận thức, sa sút trí tuệ, rối loạn tâm thần không phù hợp với chỉ định phẫu thuật, bởi phẫu thuật thần kinh có thể làm suy giảm nhận thức và rối loạn tâm thần trầm trọng hơn, nặng hơn bất cứ lợi ích cải thiện chức năng vận động nào.
Siêu âm hội tụ cường độ cao (HIFU)
Siêu âm tập trung cường độ cao theo dẫn hướng MR có thể được sử dụng để kiểm soát run nặng ở những bệnh nhân Parkinson. Với thủ thuật này, nhân trung gian của đồi thị có thể được cắt bỏ với nguy cơ xuất huyết và nhiễm trùng tối thiểu, có thể xảy ra khi phẫu thuật thần kinh xâm lấn được sử dụng.
Các nghiên cứu đang được thực hiện để xác định tính an toàn và hiệu quả của siêu âm tập trung cường độ cao theo dẫn hướng MR nhằm mục đích điều trị run, cứng, bất thường và các dấu hiệu khác của bệnh Parkinson bằng cách nhắm vào nhân dưới đồi và nhân bèo (3).
Các biện pháp vật lý
Mục tiêu là tối đa hóa hoạt động. Bệnh nhân nên tăng cường hoạt động hàng ngày ở mức độ tối đa có thể. Nếu không, vật lý trị liệu hoặc hoạt động trị liệu với các bài tập thể lực thường xuyên có thể giúp tăng cường thể lực của bệnh nhân. Các bác sĩ chuyên khoa phục hồi chức năng có thể hướng dẫn các chiến lược thích ứng phù cho bệnh nhân tại nhà (ví dụ, lắp các thanh nắm để giảm nguy cơ ngã).
Để ngăn ngừa hoặc giảm táo bón (có thể do bệnh, do thuốc điều trị parkinson, và/hoặc không hoạt động), bệnh nhân nên ăn chế độ ăn nhiều chất xơ, tập luyện khi có thể, và uống đủ lượng chất lỏng. Thực phẩm bổ sung (như psyllium) và chất nhuận tràng kích thích (ví dụ, bisacodyl 10 đến 20 mg uống một lần mỗi ngày) có thể có hiệu quả.
Người chăm sóc và các vấn đề cuối đời
Vì bệnh Parkinson tiến triển nên bệnh nhân cuối cùng cần được giúp đỡ để sinh hoạt bình thường hàng ngày. Những người chăm sóc nên được hướng tới các nguồn có thể giúp họ tìm hiểu những ảnh hưởng về thể chất và tâm lý của Parkinson và về cách giúp đỡ bệnh nhân hoạt động tốt nhất có thể. Sự chăm sóc như vậy gây khá nhiều mệt mỏi và căng thẳng, người chăm sóc nên được khuyến khích liên hệ với các nhóm hỗ trợ để được hỗ trợ về mặt xã hội và tâm lý.
Cuối cùng, hầu hết bệnh nhân parkinson đều trở nên tàn tật nghiêm trọng và phải bất động. Bệnh nhân mất khả năng ăn uống, ngay cả khi có sự trợ giúp. Vì bệnh nhân ngày càng khó nuốt, nên nguy cơ tử vong do viêm phổi hít cao. Đối với một số bệnh nhân, chăm sóc tốt nhất nên thực hiện tại nhà dưỡng lão.
Trước khi những người bị Parkinson mất khả năng hoạt động, họ nên lập di chúc y khoa, chỉ ra những loại chăm sóc y tế họ muốn ở cuối đời.
TÓM TẮT
Bệnh Parkinson là một bệnh lý synuclein và do đó có thể chồng lấp với các bệnh synuclein khác (ví dụ, sa sút trí tuệ thể Lewy, teo đa hệ thống).
Nghi ngờ Parkinson khi có các triệu chứng đặc trưng: run tĩnh trạng, tăng trương lực cơ kiểu Parkinson, chậm và giảm vận động, mất ổn định về tư thế và dáng đi.
Phân biệt Parkinson với các bệnh lý gây ra các triệu chứng tương tự dựa chủ yếu vào khám lâm sàng và khai thác tiền sử, đáp ứng với levodopa; đôi khi chẩn đoán hình ảnh thần kinh rất hữu ích.
Thông thường, sử dụng levodopa/carbidopa (điều trị chính), nhưng các thuốc khác (amantadin, thuốc chủ vận dopamine, thuốc ức chế MAO-B, chất ức chế COMT) cũng có thể được sử dụng trước và/hoặc với levodopa/carbidopa.
Cân nhắc các biện pháp phẫu thuật, chẳng hạn như kích thích não sâu, nếu bệnh nhân có các biểu hiện kháng trị với điều trị tối ưu và không suy giảm nhận thức hoặc rối loạn tâm thần.
Tài liệu tham khảo
1. Yoshiyama Y, Kojima A, Itoh K, Uchiyama T, Arai K: Anticholinergics boost the pathological process of neurodegeneration with increased inflammation in a tauopathy mouse model. Neurobiol Dis 2012 45 (1):329–36, 2012. doi: 10.1016/j.nbd.2011.08.017
2. Yoshiyama Y, Kojima A, Itoh K, et al: Does anticholinergic activity affect neuropathology? Implication of neuroinflammation in Alzheimer’s disease. Neurodegener Dis 15 (3):140-148, 2015. doi: 10.1159/000381484
3. Moosa S, Martínez-Fernández R, Elias WJ, et al: The role of high-intensity focused ultrasound as a symptomatic treatment for Parkinson’s disease. Mov Disord 34 (9):1243–1251, 2019. doi: 10.1002/mds.27779 xuất bản điện tử ngày 10 tháng 7 năm 2019.