ThS.BS LƯU QUANG MINH
TS.BS ĐỖ VĂN CHIẾN
Viện Tim mạch – Bệnh viện trung ương Quân đội 108
1. Giới thiệu chung
Khái niệm về bệnh cơ tim được Brigden giới thiệuvào năm 1957, để chỉ ra những bệnh lý cơ timkhông do căn nguyên mạch vành[2]. Thuật ngữ này bao gồm một nhóm các bệnh lý cơ tim có liên quan đến rối loạn quá trình tái tạo và hình thái tế bàocơ tim:bệnh cơ tim phì đại, bệnh cơ tim giãn nở, bệnh cơ tim hạn chế, loạn sản thất phải, và bệnhcơ tim Takotsubo. Bệnh cơ tim không chỉ nói về bệnh của tâm thất mà bao gồm cả tâm nhĩ do có sinh lý bệnh tương tự nhau. Nagle và cộng sự (1972) là người đầu tiên đưa ra ý tưởng về bệnh cơ tim tâm nhĩ để mô tả một hội chứng gia đình tác độngđến hệ thống dẫn truyền trong nhĩ và nhĩ thất, với biểu hiện làngoại tâm thu trên thất, block nhĩ thất và liệt nhĩ [6]. Sau đó Doug Zipes (1997) mô tả nguồn gốc rối loạn nhịp do sự kích thích các tĩnh mạch phổi trong một lá thư gửi ban biên tập tạp chí khoa học Circulation và là người đầu tiên đề xuất đưa rung nhĩ vào nhóm bệnh cơ tim tâm nhĩ [7]. Tác giả Kottkamp (2012) gây ra tranh cãi khi nhận định rằngxơ hóatâm nhĩ là cơ sở sinh lý bệnh của gần như mọi hình tháirung nhĩ [4].
Tâm nhĩ đóng vai trò quan trọng trong chức năng tim mạch. Bên cạnh những ảnh hưởng của nó với sự đổ đầy tâm thất, nó còn đóng vai trò là bể chứa thể tích tuần hoàn, tế bào chủ nhịp và các bộ phận quan trọng của hệ thống dẫn truyền tim (ví dụ nút xoang, nút AV) và tiết ra các peptide Natri lợi niệu như peptide Natri lợi niệu nhĩ (ANP)và peptide Natri lợi niệu não (BNP) điều hòa cân bằng thể tích dịch. Cơ timtâmnhĩ bị ảnh hưởng bởi những yếu tố dotim và không do tim và ở một số khía cạnh, cơ tim tâm nhĩ nhạy cảm hơn so với tâm thất. Hai tâm nhĩ luôn dễ kích hoạt, bên cạnh ba đường dẫn truyền chuyên biệt, thông qua các tế bào cơ tim hoạt động, do đó bất kỳ thay đổi kiến trúc hoặc cấu trúc nào trong cơ tim tâm nhĩ đều có thể gây ranhữngrối loạn điện sinh lý đáng kể. Ngoài ra, các tế bào tâm nhĩ (cả tế bào cơ tim và các yếu tố không phải tế bào cơ tim như nguyên bào sợi, tế bào nội mô và tế bào thần kinh) thường phản ứng nhanh và rõ ràng với các kích thích bệnh lý và dễ bị ảnh hưởng bởi một loạt các tác độngdi truyền. Những đáp ứng này bao gồm phì đại tâm nhĩ và rối loạn chức năng co bóp, bệnh kênh ion và vận chuyển trên bề mặt tế bào, tăng sinh nguyên bào sợi tâm nhĩ, tăng sinh các thụ thể thần kinh và tăng đông. Vì vậy, bệnh cơ tim tâm nhĩ có ảnh hưởng mạnh mẽ đến hoạt động của tim, xuất hiện các rối loạn nhịp và tăng nguy cơ đột quỵ.
2. Định nghĩa bệnh cơ tim tâm nhĩ:
Theo định nghĩa đồng thuận của liên ủy ban (EHRAS) bao gồm Hội nhịp học Châu Âu (EHRA), Hội nhịp học (HRS), Hội nhịp học Châu Á Thái Bình Dương (APHRS), Hội nhịp học và điện sinh lý Châu Nam Mỹ (SOLAECE) thì bất kỳ sự thay đổi phức tạp về cấu trúc, kiến trúc, co bóp hoặc điện sinh lý ảnh hưởng đến tâm nhĩ có khả năng tạo ra các biểu hiện lâm sàng được định nghĩa là bệnh cơ tim tâm nhĩ.
Đồng thuận EHRAS đã phát triển một hệ thống phân loại cho bệnh cơ tim tâm nhĩ dựa trên đặc điểm mô bệnh học, bao gồm 4 nhóm: (I) bệnh lý chính ở tế bào cơ tim tâm nhĩ; (II) thay đổi chính do quá trình xơ sợi hóa; (III) kết hợp bệnh lý tế bào cơ tim với quá trình xơ sợi hóa; (IV) thâm nhiễm tiên phát không do sợi collagen (có hoặc không có thay đổi bệnh lý tế bào cơ tim) [3]. Tổn thương mô bệnh học tâm nhĩ theo EHRAS có thể thay đổi theo thời gian và có thể khác nhau ở các vị trí tâm nhĩ khác nhau. Khác với các phân loại khác (như NYHA, CCS, v.v.), đây là phân loại kiểu mô tả, nghĩa là không có sự tiến triển về mức độ từ EHRAS lớp I đến EHRAS IV (Bảng 1).
Hình 1. Phân loại mô học và bệnh học của bệnh cơ tim tâm nhĩ – EHRAS. Phân loại EHRAS có thể thay đổi theo thời gian phụ thuộc nguyên nhân gây bệnh và có thể khác nhau ở các vị trí khác nhau của tâm nhĩ. Đáng lưu ý, bản chất của phân loại này đơn thuần là mô tả. EHRAS I-IV không mô tả tiến triển bệnh từ EHRAS I sang EHRAS IV.
Hình 2. Mô bệnh học của EHRAS I-IV (A, B, C lấy từ sinh thiết cơ tim, D lấy từ tử thiết)
(A) EHRAS Class I: bệnh lý chính ở tế bào cơ tim chủ yếu là phì đại và hủy bào; xơ sợi hóa không rõ ràng bằng các bệnh lý tế bào.
(B) EHRAS Class II: bệnh lý của tế bào cơ tim không đáng kể so với quá trình xơ hóa đặc biệt xơ hóa ở khoảng kẽ chiếm rõ rang hơn so với bệnh lý tế bào.
(C) EHRAS Class III: kết hợp giữa bệnh lý tế bào cơ tim và lắng đọng sợi collagen.
(D) EHRAS Class IV: viêm cơ tim do bạch cầu đa nhân trung tính.
3. Yếu tố nguy cơ và ý tưởng phân loại lâm sàng bệnh cơ tim tâm nhĩ
Hệ thống phân loại EHRAS chứa đựng nhiều hạn chế trong ứng dụng lâm sàng. Điều đầu tiên, đây là phân loại giải phẫu bệnh, nên về mặt kỹ thuật cần sinh thiết cơ tim tại tâm nhĩ (vốn là kỹ thuật khó thực hiện) cho phép đánh giá cụ thể ở từng bệnh nhân. Hơn nữa, người ta thấy rằng có sự chồng lấn khi xem xét phân loại EHRAS trong mối liên quan với các nguyên nhân và yếu tố nguy cơ của bệnh cơ tim tâm nhĩ.
Đồng thuận EHRAS đã đưa ra 13 nguyên nhân và yếu tố nguy cơ ảnh hưởng đến cấu trúc tâm nhĩ. Bảng dưới đây cho thấy có nhiều yếu tố nguy cơ của bệnh cơ tim tâm nhĩ. Hầu hết bệnh nhân có thể gặp nhiều đặc điểm tổn thương giải phẫu bệnh giống nhau, trừ tổn thương tích lũy amyloid chỉ gặp trong EHRAS IV. Có 6/13 nguy cơ gặp ở ít nhất 3 nhóm EHRAS. Rõ ràng nếu chỉ dựa vào đặc điểm lâm sàng thì khó có thể phân loại được bệnh cơ tim tâm nhĩ mà không có hình ảnh mô bệnh học. Tuy nhiên với hệ thống phân loại EHRAS ngay cả khi bệnh nhân được xác định tổn thương mô bệnh học, người ta vẫn chưa biết được ứng dụng rõ ràng của nó cho những việc cần làm tiếp theo.
| Phân loại EHRAS
YTNC |
I | II | III | IV |
| Rung nhĩ đơn độc | x | x | ||
| Bệnh tâm nhĩ do amyloid | x | |||
| Loạn dưỡng cơ tiến triển | x | x | x | x |
| Suy tim xung huyết | x | x | x | |
| Ngưng thở khi ngủ | x | x | ||
| Rung nhĩ do tái cấu trúc | x | x | ||
| Do thuốc | x | x | x | x |
| Viêm cơ tim | x | x | ||
| Tuổi già | x | |||
| THA | x | x | x | |
| Béo phì | x | x | ||
| Đái tháo đường | x | x | x | |
| Bệnh van tim | x | x | x | x |
Bảng 2. Yếu tố nguy cơ của bệnh cơ tim tâm nhĩ
Hình 4 minh họacác yếu tố có thể được sử dụng để xây dựngmột hệ thống phân loại lâm sàng phù hợp vớibệnh cơ tim tâm nhĩ. Các yếu tố căn nguyên(etiological factors)cần được xem xét, vì chúng có thể có ý nghĩa chẩn đoán, tiên lượng và điều trị rõ ràng. Ví dụ, đột biến MYL4 gây ra bệnh cơ tim đặc hiệu nhĩ tiến triển với nguy cơ đột quỵ và nguy cơ phải cấy máytạo nhịp cao. Các yếu tố nguy cơ tim mạch (risk factors) cần được ghi nhận và quản lý, vì làm giảm nguy cơ tái phát rung nhĩ. Độc tính của thuốc và các bất thường về nội tiết cần được ghinhận để áp dụng liệu pháp điều trị cụ thể(ví dụ: ngừng thuốc liên quan và điều chỉnhcácrối loạn nội tiết). Các rối loạn xâm nhiễm như amyloidosis cũng có ý nghĩa tiên lượng và điều trị cụ thể.
Hình 4. Các thành phần tiềm năng của hệ thống phân loại lâm sàng bệnh cơ tim tâm nhĩ
Một hướng thứ hai để xây dựng hệ thống phân loại lâm sàng liên quan đến các đặc tính tiên lượng chính. Các chỉ số chức năng nhĩ trái, từ kích thước đến các tham số chức năng phức tạp khác, phản ánh sự thay đổi cấu trúc và chức năng nhĩ trái trong bệnh cơ tim và tiên đoán nguy cơ loạn nhịp. Các chỉ số đánh giá rối loạn điện học tâm nhĩ không xâm lấn như khoảng PR và các thông số điện tâm đồ trong của rung nhĩ, có giá trị tiên đoán tái phát rung nhĩ. Xơ hóa tâm nhĩ, một yếu tố sinh lý bệnh quan trọng của rung nhĩ, có thể được định lượng bằng phương pháp không xâm lấn thông qua hình ảnh cộng hưởng từ có tiêm gadolinium có liên quan chặt chẽ với các kết cục quan trọng (VD như nguy cơ tái phát rung nhĩ và đột quỵ). Người ta thấy có nhiều bằng chứng cho thấy bệnh cơ tim tâm nhĩ là một yếu tố nguy cơ của đột quỵ não, độc lập với rung nhĩ – vốn là yếu tố nguy cơ rõ rệt nhất của đột quỵ. Bên cạnh đó, một yếu tố quan trọng của nguy cơ đột quỵ liên quan đến bệnh cơ tim tâm nhĩ là hiện tượng hoạt hóa hệ thống đông máu. Một loạt các dấu ấn sinh học trong máu có khả năng chỉ ra sự thay đổi của hệ thống đông máu, và các dấu ấn này có liên quan đến nguy cơ đột quỵ ở bệnh nhân rung nhĩ.
Sự phát triển của một hệ thống phân loại lâm sàng có ý nghĩa sẽ đòi hỏi nhiều chuyên gia tư vấn, đồng thuận và thử nghiệm thêm trong tương lai. Tuy nhiên, chúng tôi đề xuất rằng các yếu tố được minh họa trong hình 4 (ECFEM [nguyên nhân/ đông máu/ xơ hóa/ điện học/ chỉ số cơ học]) có thể sử dụng như một hệ thống phân loại lâm sàng cho bệnh cơ tim tâm nhĩ.
3. Một số phương pháp hình ảnh đánh giá bệnh cơ tim tâm nhĩ
Siêu âm tim
Siêu âm tim là phương thức chẩn đoán hình ảnh được lựa chọn để sàng lọc và theo dõi định kỳ bệnh nhân mắc các bệnh liên quan đến hình thái và chức năng nhĩ trái. Để đánh giá kích thước tâm nhĩ, phương pháp phổ biến nhất nhất là đo đường kính nhĩ trái ở mặt phẳng trục dài cạnh ức trái chế độ M-mode hoặc tăng tương phản muộn. Tuy nhiên, ở bệnh nhân có hiện tượng tái cấu trúc tâm nhĩ, phép đo này thường không cung cấp hình ảnh chính xác về kích thước nhĩ trái. Cách đo thể tích nhĩ trái là một chỉ số tiên lượng tốt hơn. Thể tích nhĩ trái đo bằng siêu âm tim 2D thường nhỏ hơn so kết quả từ chụp cắt lớp vi tính hoặc chụp cộng hưởng từ tim. Sự ra đời của siêu âm 3D đã cải thiện độ chính xác của các phép đo thể tích và cho thấy mối tương quan tốt với chụp cắt lớp vi tính và chụp cộng hưởng từ tim.
Nhiều nghiên cứu đã cho thấy chức năng nhĩ trái có thể được đánh giá bằng khả năng đổ đầy nhĩ trái muộn thì tâm trương qua biên độ sóng A van hai lá (Doppler xung). Vận tốc dòng phụt ngược tâm nhĩ – tĩnh mạch phổi cũng đáng kể khi có sự giảm chức năng tâm trương thất trái và áp lực đổ đầy tăng lên kết hợp với sự co thắt tâm nhĩ. Các nghiên cứu cũng đã chứng minh rằng hình ảnh mô Doppler có thể được sử dụng như một dấu hiệu chính xác để đánh giá chức năng tâm nhĩ.
Siêu âm đánh dấu mô cơ tim 2D được chứng minh là phương pháp có độ nhạy cao hơn để phát hiện tái cấu trúc chức năng sớm trước những biến đổi giải phẫu của tim. Hai thông số biến dạng (S) và tốc độ biến dạng (SR) được dùng để đánh giá tái cấu trúc và xơ hóa nhĩ trái. Rối loạn chức năng nhĩ trái với những thay đổi về S và SR đã được quan sát thấy ở những bệnh nhân mắc bệnh amyloidosis khi các phương pháp siêu âm khác cho kết quả bình thường.
Cắt lớp vi tính
Chụp cắt lớp vi tính tim (Cardiac computed tomography – CCT) có thể đánh giá chính xác thể tích tâm nhĩ, tương đương với kết quả cộng hưởng từ tim (Cardiac magnetic resonance imaging – CMR). Thể tích nhĩ trái trước khi triệt đốt qua đường ống thông và sự bất đối xứng hình dạng nhĩ trái dự đoán khả năng thất bại sau thủ thuật. CCT cũng có thể được sử dụng để sàng lọc huyết khối trước khi triệt đốt rung nhĩ. Dữ liệu gộp lấy từ 19 nghiên cứu và 2955 bệnh nhân cho thấy độ nhạy và độ đặc hiệu của CCT lần lượt là 96% và 92%, và giá trị tiên đoán dương là 41% và giá trị tiên đoán âm tính là 99%. Độ chính xác chẩn đoán tăng lên 99%, với độ đặc hiệu 100%, khi thực hiện kĩ thuật chụp ngấm thuốc thì muộn. CCT cũng có thể cung cấp thông tin chính xác về giải phẫu các tĩnh mạch phổi, kết quả cũng tương quan tốt với CMR.
Cộng hưởng từ
Những năm gần đây, CMR đã được sử dụng lâm sàng và nghiên cứu như một tiêu chuẩn vàng để đánh giá thể tích, cấu trúc và chức năng buồng tim. CMR có tiêm chất tương phản gadolinium đã được sử dụng để đánh giá xơ hóa tâm nhĩ, mặc dù phương pháp này đang được ứng dụng ở giai đoạn khá sớm và chưa được áp dụng rộng rãi. Ngoài ra hình ảnh CMR thì ngấm thuốc muộn trên phim T1 cũng được dùng để định lượng mức độ xơ hóa kẽ lan tỏa. Cả hai kỹ thuật này tương quan với điện áp lưỡng cực đo được trong quá trình lập bản đồ điện học xâm lấn. Tuy nhiên, các kỹ thuật này cần phải được thực hiện các chuyên gia hình ảnh học. Đồng thời, mặc dù CMR được sử dụng rộng rãi để đánh giá hình ảnh tâm thất, kỹ thuật này lại ít được dùng để đánh giá hình ảnh tâm nhĩ – vốn có thành mỏng hơn – vì những thách thức kỹ thuật trong việc đạt được độ phân giải hình ảnh.
4. Tác động lâm sàng của bệnh cơ tim tâm nhĩ
Câu hỏi đầu tiên được đặt ra là liệu bệnh cơ tim tâm nhĩ có phải là nguy cơ đột quỵ độc lập khác với rung nhĩ hay không? Như đã biết, các yếu tố dự báo chính về nguy cơ đột quỵ ở hai thang điểm CHADS2 và CHA2DS2-VASc được sử dụng để xác định xem bệnh nhân rung nhĩ nên dùng thuốc chống đông như thế nào. Điểm thú vị là tất cả các yếu tố này cũng có thể gây ra bệnh cơ tim tâm nhĩ như đã nói ở phần 2. Do đó, các quyết định lâm sàng khi sử dụng thuốc chống đông đường uống (OAC) ở bệnh nhân rung nhĩ không chỉ phụ thuộc các đặc tính của rung nhĩ, mà còn dựa trên các điều kiện đồng thời liên quan đến bệnh cơ tim tâm nhĩ. Điều này cho thấy có khả năng bệnh cơ tim tâm nhĩ là một yếu tố dự báo độc lập đột quỵ ở bệnh nhân rung nhĩ và hiểu rõ hơn về mối quan hệ này có thể giúp dự đoán và ngăn ngừa đột quỵ liên quan đến rung nhĩ.
Bằng chứng thứ hai cho vấn đề này xuất phát từ những dữ liệu liên quan đến thời gian tương đối của các cơn rung nhĩ và đột quỵ. Với quan điểm cũ, các cơn rung nhĩ tạo ra các cục máu đông trong tiểu nhĩ trái, tiến triển biến dạng và thuyên tắc mạch máu não (đặc biệt là khi tâm nhĩ phục hồi về nhịp xoang). Tuy nhiên, các nghiên cứu theo dõi liên tục nhịp nhĩ ở những bệnh nhân rung nhĩ cơn dấy lên nghi ngờ về lý thuyết này. Nghiên cứu ASSERT cho thấy các cơn rung nhĩ được phát hiện trong vòng 30 ngày trước khi đột quỵ chỉ xảy ra ở 8% bệnh nhân và 16% bệnh nhân đột quỵ có cơn rung nhĩ đầu tiên sau biến cố này [1]. Sự thiếu tương quan giữa các cơn rung nhĩ và biến cố đột quỵ cũng được ghi nhận bởi các tác giả trong nghiên cứu IMPACT [5]. Một lời giải thích khả dĩ cho điều này là các yếu tố bổ sung liên quan đến bệnh cơ tim tâm nhĩ, chẳng hạn như hiện tượng giảm co bóp tâm nhĩ và tổn thương chức năng nội mô tâm nhĩ là những yếu tố chính gây ra đột quỵ bất chấp sự xuất hiện của rung nhĩ.
Hình 5. Tiên lượng nguy cơ đột quỵ với sự kết hợp hai thang điểm CHADS2 và CHA2DS2-VASc ở bệnh cơ tim tâm nhĩ
Một căn cứ nữa giải thích mối liên quan giữa bệnh cơ tim tâm nhĩ và đột quỵ đến từ việc tồn tạimột số điều kiện tác độngkhông tương xứng đến tâm nhĩ. Bệnhcơ timamyloidosis có liên quan đến việc tăng nguy cơ biến cố huyết khối, bao gồm cả đột quỵ. Điềunày thường xảy ra mặc dù bệnh nhân có nhịp xoang và không có bằng chứng rung nhĩ,và có liên quan đến các bất thường hợp co bópnhĩ nặng. Đột biến gen chuỗi nhẹ myosin MYL4 gây ra bệnh cơ tim đặc hiệu tâm nhĩ với những bất thường co bóp tâm nhĩ cũng liên quan vớinguy cơ đột quỵ.
Do đó, một loạt các bằng chứng cho thấy bệnh cơ timtâmnhĩ có thể là một yếu tố độc lập của đột quỵ. Thậm chí, khả năng cực đoan nhất là rung nhĩ khôngphải thủ phạm gây ra đột quỵ, mà là bệnh cơ tim tâm nhĩ liên quan đến rung nhĩ mới là nguyên nhân gây ra đột quỵ.
Quá trình phát triển tự nhiên của rung nhĩ là một trở ngại lớn đối với việc kiểm soát nhịp hiệu quả, tăng đề kháng trị liệu và nguy cơ tái phát rung nhĩ sau khi triệt đốt hoặc chuyển nhịp. Có nhiều bằng chứng ủng hộ ý kiến cho rằng bệnh cơ tim tâm nhĩ là yếu tố quan trọng góp phần vào tiến triển của rung nhĩ. Kích thước nhĩ trái, một chỉ số đơn giản đại diện cho hiện tượng tái cấu trúc, là chỉ số cảnh báo đầu tiên về nguy cơ tái phát rung nhĩ sau khi sốc điện chuyển nhịp, hiện vẫn là yếu tố tiên lượng được chấp nhận rộng rãi. Kết quả triệt đốt rung nhĩ qua đường ống thông và tỷ lệ tái phát dài hạn có liên quan đáng kể đến số lượng tái tạo bởi hiện tượng xơ hóa tâm nhĩ. Ngoài ra còn nhiều chỉ số khác về tái cấu trúc và chức năng tâm nhĩ có khả năng dự đoán tiến triển và tái phát rung nhĩ sau triệt đốt.
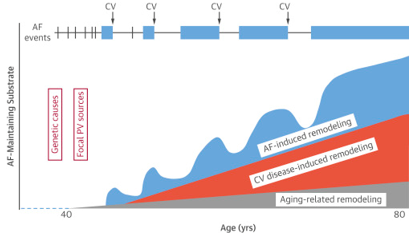
Hình 6 cung cấp một mô hình về các yếu tố chi phối các biến cố rung nhĩ. Rung nhĩ thường bắt đầu bằng những cơn kịch phát ngắn từ các ổ phát nhịp lạc chỗ mà chủ yếu ở các tĩnh mạch phổi. Yếu tố di truyền đóng một vai trò đặc biệt quan trọng trong rung nhĩ khởi phát sớm. Với sự tiến triển của bệnh, rung nhĩ trở nên dai dẳng và việc chuyển nhịp (cardioversion-CV) lúc này là rất cần thiết. Từ lâu, người ta đã biết rằng “rung nhĩ gây nên rung nhĩ”, và thời gian rung nhĩ là một yếu tố quan trọng quyết định sự tiến triển của bệnh. Trong các lần rung nhĩ, hiện tượng tái cấu trúc luôn xảy ra với cả hai yếu tố bao gồm điện học (đảo ngược nhanh) và cấu trúc (đặc biệt là xơ hóa – đảo ngược chậm). Theo thời gian, 2 thành phần này bắt đầu có ảnh hưởng: 1) tái cấu trúc gây ra bởi các bệnh tim mạch hoặc các yếu tố nguy cơ; và 2) tái cấu trúc do lão hóa. Cấu trúc tâm nhĩ thay đổi chủ yếu trong cả hai hiện tượng tái cấu trúc bệnh lý và lão hóa. Những thay đổi này dẫn đến các đợt rung ngày càng kéo dài và cuối cùng, thường dẫn đến rối loạn nhịp bền bỉ. Do đó, bệnh cơ tim tâm nhĩ là yếu tố chính quyết định tiến triển của rung nhĩ.
Hình 6. Sơ đồ phát triển tự nhiên của rung nhĩ
5. Bệnh cơ tim tâm nhĩ trong lâm sàng điều trị
Dựa trên những bằng chứng về sự tồn tại của bệnh cơ tim tâm nhĩ, người ta có thể mong đợi các chỉ số của bệnh này có ý nghĩa trong điều trị.
Đầu tiên là áp dụng trong phòng ngừa đột quỵ. Nếu bệnh cơ tim tâm nhĩ là một yếu tố nguy cơ đột quỵ đáng kể, không phụ thuộc vào rung nhĩ, thì liệu những người không có tiền sử rung nhĩ nhưng có nguy cơ bị huyết khối tâm nhĩ có thể được chỉ định và bảo vệ bởi thuốc OAC không? Như ta đã biết, thang điểm CHA2DS2-VASc cũng được dùng để dự đoán nguy cơ huyết khối trong trường hợp bệnh nhân suy tim không có rung nhĩ. Tương tự, điểm CHA2DS2-VASc tương quan với nguy cơ hình thành huyết khối nhĩ trái ở bệnh nhân hẹp van hai lá do thấp và không có tiền sử rung nhĩ. Từ đó các tác giả đề xuất khả năng sử dụng các yếu tố nguy cơ bệnh lý tim mạch trên để đưa ra chỉ định dùng thuốc OAC ở bệnh nhân có nguy cơ đột quỵ có nhịp xoang, mặc dù cần được nghiên cứu sâu hơn trong tương lai. Hai là, những bệnh nhân có rung nhĩ nếu không có đặc điểm của bệnh cơ tim tâm nhĩ, có thể không cần thiết dùng các thuốc chống đông bởi trên thực tế, hầu hết những bệnh nhân như vậy ít có nguy cơ hình thành huyết khối. Chỉ định dùng chống đông hợp lý như vậy có thể tránh cho họ nguy cơ chảy máu không cần thiết. Ba là, nhiều dữ liệu quan sát cho thấy nguy cơ đột quỵ giảm đáng kể sau khi triệt đốt rung nhĩ thành công và có thể ngừng dùng thuốc OAC một cách an toàn ở nhiều bệnh nhân thông qua việc đánh giá các chỉ số của bệnh cơ tim tâm nhĩ. Cuối cùng, các chỉ số bệnh cơ tim tâm nhĩ có thể cung cấp thông tin sử dụng OAC cụ thể hơn. Người ta nhận thấy rằng những bệnh nhân có van cơ học và hẹp van hai lá nặng không được bảo vệ đầy đủ bởi các thuốc OAC tác động trực tiếp và cần điều trị bằng thuốc kháng vitamin K. Như vậy liệu có tồn tại những đối tượng bệnh nhân khác cần dùng thuốc kháng vitamin K để ngăn ngừa huyết khối không?
Nhóm vấn đề thứ hai liên quan đến liệu pháp nhịp. Thông qua đặc tính bệnh cơ tim tâm nhĩ, các tác giả có thể tiên lượng được khả năng tái phát ngắn hạn và dài hạn sau khi triệt đốt rung nhĩ. Các đặc tính cơ học, điện học và xơ hóa tâm nhĩ đều có giá trị tiên lượng rung nhĩ tái phát sau triệt đốt. Từ đó họ có thể sử dụng để dự đoán bệnh nhân rung nhĩ mà việc triệt đốt sẽ vô ích, giúp họ tránh được rủi ro và sự bất tiện của các thủ thuật không cần thiết. Đồng thời, các đặc tính của bệnh cơ tim tâm nhĩ có thể được sử dụng lựa chọn bệnh nhân tối ưu cho việc triệt đốt rung nhĩ. Các yếu tố nguy cơ tim mạch, chẳng hạn như béo phì và ngưng thở khi ngủ tắc nghẽn, đã được chứng minh là gây ra bệnh cơ tim tâm nhĩ động vật thực nghiệm. Điều chỉnh các yếu tố nguy cơ này có thể ngăn ngừa rung nhĩ tái phát, góp phần cải thiện kết quả triệt đốt rung nhĩ, và có thể hiệu quả tương đương với việc triệt đốt lại lần hai. Đặc điểm bệnh cơ tim tâm nhĩ cũng có thể cung cấp bằng chứng cho việc lựa chọn loại thuốc chống loạn nhịp nào là phù hợp và loại nào là vô ích. Cuối cùng, việc tái phát dài hạn rung nhĩ sau triệt đốt cũng có thể do tiến triển của bệnh cơ tim tâm nhĩ, và các đặc điểm của cơ tim tại thời điểm triệt đốt có thể cung cấp hướng dẫn điều trị phụ trợ cho việc duy trì nhịp xoang sau triệt đốt.
Các đặc tính của bệnh cơ tim tâm nhĩ cũng có thể hữu ích cho việc hướng dẫn kiểm soát tần số tim. Hiểu rõ bệnh cơ tim tâm nhĩ có thể cung cấp bức tranh cụ thể hơn trong việc đưa ra tần số cụ thể và dự báo khả năng thất bại ở bệnh nhân điều trị bằng liệu pháp kiểm soát nhịp tim.
KẾT LUẬN
Bệnh cơ tim tâm nhĩ, cho đến gần đây, vẫn còn là một khái niệm chưa rõ ràng mặc dù đã được định nghĩa và mô tả chi tiết trong đồng thuận EHRAS, tuy nhiên nó vẫn có một giá trị lâm sàng nhất định. Nhiều nguyên nhân gây ra sự thay đổi bệnh lý cơ tim và được phản ánh mô học bởi phân loại EHRAS. Quá trình tổn thương cơ tim cũng gây ra những thay đổi về cơ học, điện học, xơ hóa và rối loạn đông máu góp phần vào tiến triển của rung nhĩ và nguy cơ đột quỵ. Cần thêm nhiều nghiên cứu sâu hơn để xác nhận giá trị và áp dụng phân loại EHRAS trong việc hướng dẫn chẩn đoán và điều trị lâm sàng.
TÀI LIỆU THAM KHẢO
1. Brambatti, M., et al. (2014), “Temporal relationship between subclinical atrial fibrillation and embolic events”, Circulation. 129(21), pp. 2094-9.
2. Brigden, W. (1957), “Uncommon myocardial diseases; the non-coronary cardiomyopathies”, Lancet. 273(7007), pp. 1179-84.
3. Goette, A., et al. (2016), “EHRA/HRS/APHRS/SOLAECE expert consensus on Atrial cardiomyopathies: Definition, characterisation, and clinical implication”, J Arrhythm. 32(4), pp. 247-78.
4. Kottkamp, H. (2012), “Fibrotic atrial cardiomyopathy: a specific disease/syndrome supplying substrates for atrial fibrillation, atrial tachycardia, sinus node disease, AV node disease, and thromboembolic complications”, J Cardiovasc Electrophysiol. 23(7), pp. 797-9.
5. Martin, D. T., et al. (2015), “Randomized trial of atrial arrhythmia monitoring to guide anticoagulation in patients with implanted defibrillator and cardiac resynchronization devices”, Eur Heart J. 36(26), pp. 1660-8.
6. Nagle, R. E., Smith, B., and Williams, D. O. (1972), “Familial atrial cardiomyopathy with heart block”, Br Heart J. 34(2), p. 205.
7. Zipes, D. P. (1997), “Atrial fibrillation. A tachycardia-induced atrial cardiomyopathy”, Circulation. 95(3), pp. 562-4.





BÌNH LUẬN