Cơ chế sinh lý và cách tiếp cận chẩn đoán rối loạn toan-kiềm (Physiologic mechanisms and diagnostic approach to acid–base disorders)
Tác giả: John G. Toffaletti PhD and Craig R. Rackley MD. Sách “Blood Gases and Critical Care Testing”, Third Edition. Chapter 2, 23-52. Copyright © 2022 Elsevier Inc. All rights reserved.
Dịch và biên tập: Ths.Bs. Lê Đình Sáng
Toan chuyển hóa
Toan chuyển hóa được định nghĩa là một quá trình lâm sàng dẫn đến giảm pH máu (nhiễm toan máu) và giảm nồng độ HCO3. Nó do tích tụ các hợp chất axit và/hoặc mất base, thường là bicarbonat. Sự di chuyển của các chất điện giải cũng có thể đóng vai trò trong cân bằng toan-kiềm, đôi khi biểu hiện bằng sự tăng khoảng trống anion.
Các cơ chế sinh lý của toan chuyển hóa¹⁻³:
- Trong tiêu chảy, dịch tiết tuyến tụy vào ruột non có hàm lượng natri tương đối cao so với chloride, với nồng độ bicarbonat tương đối cao hơn. Mất các dịch đường tiêu hóa như vậy thường dẫn đến toan chuyển hóa.
- Trong nhiễm toan ống thận, nếu bài tiết natri và kali vào nước tiểu vượt quá bài tiết chloride, anion đi kèm natri/kali thường là bicarbonat. Điều này có thể dẫn đến giảm bicarbonat huyết thanh và toan chuyển hóa.
- Tăng clo máu thường chỉ ra toan chuyển hóa. Tăng clo do hấp thu từ đường tiêu hóa hoặc truyền tĩnh mạch có thể gây tăng clo máu. Đây là một lĩnh vực phức tạp về mặt sinh lý, nhưng có một số nguyên tắc:
- Nếu nồng độ Cl tăng và nồng độ Na⁺ không đổi, một anion khác ngoài Cl phải giảm. Anion này thường là bicarbonat.
- Tăng clo máu có thể xảy ra khi mất các muối natri không chứa clo từ đường tiêu hóa hoặc từ nước tiểu.
- Tăng clo máu sẽ phát triển khi bổ sung các dịch chứa muối clorua như natri, kali, canxi hoặc ammonium.
- Tăng hoặc giảm kali cũng có thể ảnh hưởng đến nồng độ natri, từ đó ảnh hưởng đến nồng độ clorua.
Tăng khoảng trống anion có thể liên quan đến toan chuyển hóa. Các quá trình sau thường đi kèm với tăng khoảng trống anion:
- Sản xuất lactate và axit từ quá trình chuyển hóa yếm khí. Nếu không có đủ oxy cho các mô (thiếu oxy), điều kiện tế bào bắt đầu thuận lợi cho quá trình chuyển hóa yếm khí với sự chuyển đổi pyruvate thành lactate. Mặc dù các bác sĩ lâm sàng thường nghĩ rằng quá trình này tạo ra axit lactic, nhưng thực tế là lactate được tạo ra⁴. Axit (H⁺) đến từ sự phân hủy lượng lớn ATP mà không có tái tổng hợp.
- Sản xuất quá mức axit từ nhiễm toan ceton. Loại nhiễm toan ceton phổ biến nhất là nhiễm toan ceton do đái tháo đường, xảy ra khi glucose không thể vào tế bào để sản xuất đủ ATP. Trong tình trạng glucose tế bào thấp (glucose huyết thanh thường khá cao trong trường hợp nhiễm toan ceton do đái tháo đường), các axit béo sẽ bị oxy hóa để tạo ra axit ceton cho năng lượng. Nhiễm toan ceton cũng có thể thấy trong tình trạng đói kém khi nồng độ glucose trong huyết tương thấp, và ở những bệnh nhân suy dinh dưỡng và bị nghiện rượu mạn tính.
- Uống các axit ngoại sinh hoặc các chất tạo axit: salicylate, ethanol, ethylene glycol, methanol, v.v.
- Bài tiết axit qua thận không đủ. Trong suy thận, tùy thuộc vào suy giảm cầu thận hay ống thận, có thể xảy ra tích tụ H⁺ và/hoặc mất HCO3⁻. Vì nhiễm toan thận thường có khởi phát chậm, thông thường tăng thông khí sẽ bù trừ hô hấp để ngăn ngừa nhiễm toan máu trong giai đoạn đầu.
Sử dụng khoảng trống anion trong toan chuyển hóa. Khoảng trống anion (AG), đặc biệt khi tăng, có thể hữu ích trong chẩn đoán loại toan chuyển hóa và chỉ ra khả năng rối loạn toan-kiềm hỗn hợp⁵, như được thể hiện trong Bảng 2.1.
Như đã mô tả trước đó, AG là sự chênh lệch giữa các cation thường được đo (Na⁺ và đôi khi K⁺) và các anion thường được đo (Cl⁻ và HCO3⁻). Khoảng tham chiếu ước tính cho AG là 8-16 mmol/L (8-16 mEq/L) khi AG = Na – (Cl + CO2) và 12-20 mmol/L (12-20 mEq/L) khi AG = (Na + K) – (Cl + CO2).
BẢNG 2.1 Thay đổi khoảng trống anion trong các rối loạn toan-kiềm khác nhau.
| Rối loạn | Giảm | Tăng | Ảnh hưởng đến AG |
|---|---|---|---|
| Tiêu chảy | HCO3⁻ | Cl⁻ | Ít |
| Nhiễm toan ống thận | HCO3⁻ | Cl⁻ | Ít |
| Nhiễm toan lactic | HCO3⁻ | Lactate | Tăng |
| Nhiễm toan ceton | HCO3⁻ | Axit ceton | Tăng |
| Rối loạn hỗn hợp: nhiễm toan ceton với kiềm chuyển hóa | HCO3⁻ | Axit ceton và HCO3⁻ | Tăng (với ít thay đổi trong tổng CO2) |
Albumin huyết thanh là một yếu tố quan trọng ảnh hưởng đến tính toán khoảng trống anion. Vì albumin trong máu chiếm một tỷ lệ lớn các anion “không đo được”, sự giảm hoặc tăng (ít phổ biến hơn) nồng độ albumin sẽ làm giảm hoặc tăng tương ứng khoảng trống anion. Với mỗi g/L giảm nồng độ albumin, AG giảm khoảng 0,25 mmol/L⁵’⁶. Nếu phòng xét nghiệm báo cáo albumin theo g/dL thì mỗi g/dL giảm nồng độ albumin sẽ làm AG giảm khoảng 2,5 mmol/L. Điều này có thể che giấu một AG tăng do tăng lactate trong toan chuyển hóa. Nếu hạ albumin máu được ghi nhận, điều này phổ biến ở bệnh nhân nặng, AG có thể được “hiệu chỉnh” bằng công thức (2.1) để giải thích AG tốt hơn. Độ nhạy của khoảng trống anion tăng trong phát hiện tăng lactate máu dường như được cải thiện bằng cách hiệu chỉnh AG theo nồng độ albumin⁵.
AG hiệu chỉnh = AG đo được + 0,23 × (45 – Albumin đo được tính bằng g/L) (2.1)
Trong Bảng 2.1, AG đo được (thực tế là tính toán) trên một mẫu giả định với lactate tăng 5,0 mmol/L và albumin bình thường 45 g/L tăng lên 18 mmol/L, như dự kiến. Tuy nhiên, trên một mẫu có cùng mức lactate tăng 5,0 mmol/L nhưng albumin giảm 25 g/L, AG đo được rõ ràng bình thường ở 12 mmol/L. Hiệu chỉnh AG trong mẫu sau này cho AG hiệu chỉnh là 18 mmol/L. Bảng 2.2 cũng cho thấy một mẫu giả định với albumin tăng 70 g/L và lactate bình thường có AG tăng giả tạo 18 mmol/L. Hiệu chỉnh AG cho albumin tăng cho AG bình thường là 12 mmol/L. Một mối quan tâm tiềm ẩn là hiệu chỉnh này đòi hỏi sử dụng albumin “bình thường” trong tính toán, chẳng hạn như giá trị trung bình của khoảng tham chiếu. Có lẽ tốt hơn là sử dụng albumin và AG cơ bản của bệnh nhân làm tham chiếu nếu có.
BẢNG 2.2 Ảnh hưởng của nồng độ albumin lên khoảng trống anion.
| Xét nghiệm hóa sinh | Albumin bình thường – Lactate tăng | Albumin thấp – Lactate tăng | Albumin tăng – Lactate bình thường |
|---|---|---|---|
| Na (mmol/L) | 140 | 138 | 140 |
| K (mmol/L) | 4,0 | 4,0 | 4,0 |
| Cl (mmol/L) | 104 | 108 | 98 |
| HCO3 (mmol/L) | 18 | 18 | 24 |
| Albumin (g/L) | 45 | 25 | 70 |
| Lactate (mmol/L) | 5,0 | 5,0 | 2,0 |
| AG đo được | 18 | 12 | 18 |
| AG hiệu chỉnh | 18 | 18 | 12 |
Theo dõi kết quả AG trong phòng xét nghiệm cũng là một kỹ thuật kiểm soát chất lượng phổ biến để phát hiện sự trôi dạt trong kết quả điện giải. Lưu ý rằng điều này được phát hiện bởi một loạt các khoảng trống anion bất thường, không phải bởi một kết quả đơn lẻ. Đây có thể là lý do tại sao một báo cáo cho rằng nguyên nhân phổ biến nhất của khoảng trống anion thấp là lỗi phòng xét nghiệm trong đo điện giải⁷.
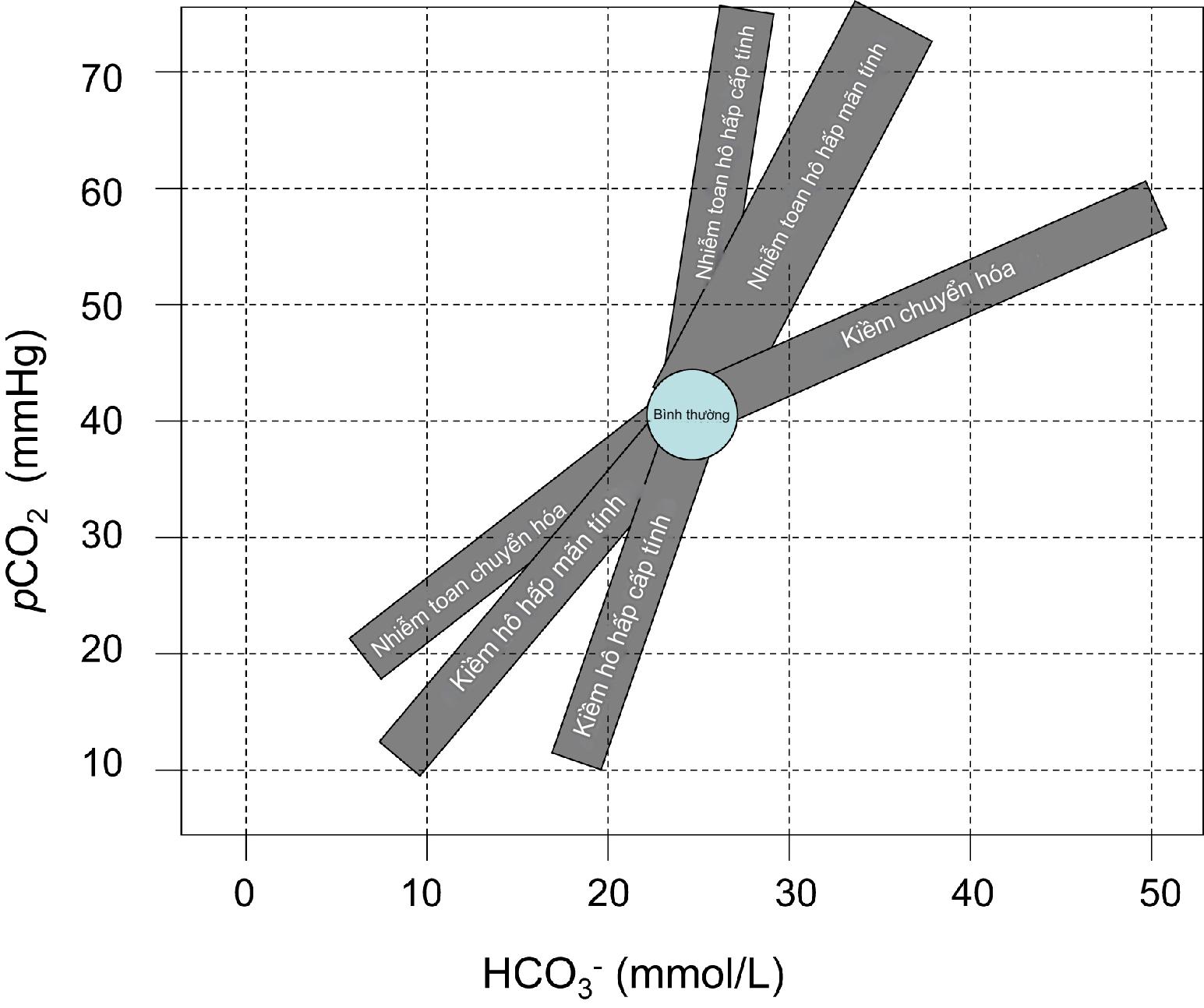
Bù trừ dự kiến trong toan chuyển hóa⁸’⁹ (Bảng 2.3 và Hình 2.1).
Trong giai đoạn đầu của toan chuyển hóa (nhiễm toan máu với bicarbonat huyết tương thấp), cả pH và HCO3⁻ đều giảm trong khi pCO2 vẫn bình thường. Sự bù trừ hô hấp dự kiến là tăng thông khí, sẽ bắt đầu làm giảm pCO2 máu trong vòng 30 phút, có tác dụng đáng kể sau 2 giờ và đạt tác dụng tối đa trong 12-24 giờ⁹. Một quy tắc chung là bù trừ hô hấp làm giảm pCO2 1,2 mmHg cho mỗi 1,0 mmol/L giảm HCO3⁻ dưới 24 mmol/L¹⁰. Ví dụ, ở một bệnh nhân phát triển toan chuyển hóa và có pCO2 ban đầu là 40 mmHg và HCO3⁻ ban đầu là 24 mmol/L, nếu HCO3⁻ giảm 8 mmol/L từ 24 xuống 16 mmol/L, pCO2 sau khi bù trừ nên khoảng 30 mmHg (40 – 1,2 × 8).
Phương trình cho mối quan hệ này là:
pCO2 bù trừ = pCO2 ban đầu – 1,2 × (HCO3⁻ ban đầu – HCO3⁻ bù trừ)
pCO2 = 40 – 1,2 × [24 – HCO3⁻] = 40 – 10 = 30 mmHg (2.2)
Do đó, nếu pCO2 cao hơn 3 mmHg so với giá trị tính toán này, bệnh nhân có thể không có khả năng bù trừ đầy đủ thông qua tăng thông khí và do đó có thể cũng có toan hô hấp tiềm ẩn. Nếu pCO2 thấp hơn 3 mmHg so với giá trị tính toán này, có thể có kiềm hô hấp tiềm ẩn. Cả hai tình huống này đều chỉ ra rằng một rối loạn hỗn hợp đang hiện diện (toan chuyển hóa kèm toan hô hấp hoặc kiềm hô hấp).
Cảnh báo: Những tính toán cho bù trừ dự kiến này nên được sử dụng như hướng dẫn trong chẩn đoán và không nên được diễn giải quá mức như một chẩn đoán tuyệt đối.
BẢNG 2.3 pH, HCO3⁻ và pCO2 trong các rối loạn nguyên phát, bù trừ và rối loạn hỗn hợp.
| Rối loạn nguyên phát | pH | HCO3⁻ | pCO2 | Tình trạng |
|---|---|---|---|---|
| Toan chuyển hóa | Giảm | Giảm | Bình thường | Giai đoạn sớm của toan chuyển hóa (<2 giờ) |
| Giảm đến bình thường | Giảm | Giảm | Bù trừ hô hấp dự kiến (6 giờ) | |
| Giảm | Giảm | Bình thường đến Giảm | Không có khả năng bù trừ | |
| Giảm++ | Giảm | Tăng | Toan chuyển hóa và toan hô hấp hỗn hợp | |
| Kiềm chuyển hóa | Tăng | Tăng | Bình thường | Giai đoạn sớm của kiềm chuyển hóa (<2 giờ) |
| Tăng đến bình thường | Tăng | Tăng | Bù trừ hô hấp dự kiến (6 giờ) | |
| Tăng | Tăng | Bình thường đến Tăng | Không có khả năng bù trừ | |
| Tăng++ | Tăng | Giảm | Kiềm chuyển hóa và kiềm hô hấp hỗn hợp | |
| Toan hô hấp | Giảm | Bình thường | Tăng | Giai đoạn ban đầu của toan hô hấp |
| Giảm đến bình thường | Tăng | Tăng | Bù trừ chuyển hóa dự kiến (24 giờ) | |
| Giảm | Bình thường đến tăng | Tăng | Không có khả năng bù trừ | |
| Giảm++ | Giảm | Tăng | Toan hô hấp và toan chuyển hóa hỗn hợp | |
| Kiềm hô hấp | Tăng | Bình thường | Giảm | Giai đoạn ban đầu của kiềm hô hấp |
| Tăng đến bình thường | Giảm | Giảm | Bù trừ chuyển hóa dự kiến (24 giờ) | |
| Tăng | Bình thường đến Giảm | Giảm | Không có khả năng bù trừ | |
| Tăng++ | Tăng | Giảm | Kiềm hô hấp và kiềm chuyển hóa hỗn hợp |
++, đáng kể; Giảm, giảm; Tăng, tăng; Toan chuyển hóa, toan chuyển hóa; Kiềm chuyển hóa, kiềm chuyển hóa; Chuyển hóa, chuyển hóa; Bình thường, bình thường; Toan hô hấp, toan hô hấp; Kiềm hô hấp, kiềm hô hấp; Hô hấp, hô hấp.
HÌNH 2.1 Mối quan hệ dự kiến giữa HCO3⁻ và pCO2 trong quá trình bù trừ đối với toan và kiềm chuyển hóa nguyên phát, và đối với các giai đoạn cấp tính và mạn tính của toan và kiềm hô hấp. Các vùng được hiển thị dựa trên các đồ thị của Phương trình (2.2-2.4, 2.6, 2.8, 2.9).
Điều trị. Điều trị tối ưu cho toan chuyển hóa là điều chỉnh nguyên nhân cơ bản, chẳng hạn như sử dụng insulin cho nhiễm toan ceton do đái tháo đường, cải thiện cung cấp oxy bằng cách tăng hàm lượng oxy trong máu và/hoặc cải thiện cung lượng tim. Mất dịch và điện giải nên được bù lại nếu thích hợp, lọc máu cho suy thận hoặc để loại bỏ một số nguyên nhân ngoại sinh gây toan chuyển hóa và có thể sử dụng bicarbonat. Tuy nhiên, việc sử dụng bicarbonat có thể gây hại và thường không được khuyến cáo ngoài trường hợp mất ổn định huyết động do toan chuyển hóa nghiêm trọng¹¹.
Kiềm chuyển hóa
Kiềm chuyển hóa là một rối loạn toan-kiềm đặc trưng bởi sự tăng nồng độ bicarbonat trên 26 mmol/L và tăng pH. Nhiều tình trạng bệnh lý có thể gây ra kiềm chuyển hóa bao gồm mất quá mức ion hydro qua thận hoặc giữ lại bicarbonat, dịch chuyển nội bào của ion hydro, mất ion hydro qua đường tiêu hóa, và mất thể tích dịch do sử dụng thuốc lợi tiểu mà không mất tương ứng bicarbonat, được gọi là “kiềm co thắt”¹², thường liên quan đến suy giảm chức năng thận vì thận khỏe mạnh có thể bài tiết lượng lớn HCO3⁻ khi nó dư thừa¹³.
Cơ chế của kiềm chuyển hóa:
- Tăng nồng độ mineralocorticoid. Thận sử dụng một cơ chế trao đổi trong đó natri được tái hấp thu và hydro được bài tiết. Vì aldosterone làm tăng giữ lại natri, các tình trạng làm tăng aldosterone, như cường aldosterone nguyên phát (hội chứng Conn) và thuốc lợi tiểu, có thể dẫn đến tăng natri máu và tăng mất ion hydro trong nước tiểu¹². Vì cortisol và các steroid khác như corticosterone có một số hoạt tính mineralocorticoid, thừa cortisol, như trong hội chứng Cushing, có thể dẫn đến bài tiết cả K⁺ và H⁺ ở ống thận xa với kiềm chuyển hóa và hạ kali máu tiếp theo.
- Mất axit qua đường tiêu hóa do nôn. Dịch dạ dày có tính axit cao, với pH khoảng 1,5-3,5. Do đó, việc mất axit dạ dày gây ra kiềm chuyển hóa với nồng độ bicarbonat tăng trong máu.
- Hạ clo máu. Thiếu hụt Cl⁻ trong máu tăng cường tái hấp thu HCO3⁻ ở ống thận. Khi các cation như Na⁺ và K⁺ được tái hấp thu, một anion phải đi theo. Vì ít Cl⁻ có sẵn, nhiều HCO3⁻ hơn được tái hấp thu.
- Hạ kali máu. Hạ kali máu kích thích tái hấp thu HCO3⁻ ở ống lượn xa. Trong tình trạng thừa mineralocorticoid nguyên phát, aldosterone làm tăng tái hấp thu Na ở ống và thúc đẩy mất K và H. Những chuyển động này dẫn đến kiềm ngoại bào với hạ clo máu, hạ kali máu và tăng thể tích ECF.
- Sử dụng quá mức HCO3⁻. Mặc dù thường không cần thiết để điều trị toan chuyển hóa, đôi khi có thể sử dụng truyền dung dịch natri bicarbonat. Nếu quá mức, việc sử dụng HCO3⁻ có thể dẫn đến kiềm, đặc biệt nếu chức năng thận bị suy giảm.
- Kiềm co thắt. Điều này xảy ra khi một lượng lớn dịch có tương đối nhiều natri hơn bicarbonat bị mất khỏi cơ thể khiến nồng độ bicarbonat huyết tương tăng lên. Điều này có thể xảy ra với thuốc lợi tiểu, tiêu chảy, xơ nang và các tình trạng khác¹².
- Hạ albumin máu. Theo khái niệm chênh lệch ion mạnh¹³, sự giảm albumin huyết tương (là axit yếu chủ yếu trong huyết tương) gây ra giảm nồng độ axit yếu dẫn đến kiềm chuyển hóa.
Bù trừ dự kiến trong kiềm chuyển hóa (Bảng 2.3 và Hình 2.1). Bởi vì thận hoạt động bình thường có thể bài tiết lượng lớn bicarbonat, một lượng bicarbonat vừa phải có thể được bài tiết dễ dàng để điều chỉnh kiềm chuyển hóa. Tuy nhiên, nếu bài tiết bicarbonat qua thận bị cản trở, bicarbonat có thể tăng trong máu dẫn đến tăng pH máu. Những thay đổi về pH máu được cảm nhận bởi cả các thụ thể hóa học ngoại vi và não, sao cho kiềm chuyển hóa liên tục gây ra giảm thông khí và tăng pCO2 máu để bù trừ cho bicarbonat tăng. Tuy nhiên, mặc dù giảm thông khí gần như luôn xảy ra khi có kiềm chuyển hóa, các yếu tố khác như đau, chẳng hạn do chọc động mạch, hoặc giảm oxy máu có thể kích thích tăng thông khí và vượt qua kích thích giảm thông khí của kiềm chuyển hóa¹⁴’¹⁵.
Bởi vì chúng có thể bù trừ một phần cho nhau, sự kết hợp của các kích thích giảm thông khí do kiềm máu và tăng thông khí do giảm oxy máu có thể gây ra cả thách thức chẩn đoán và điều trị. Những bệnh nhân có tăng CO2 máu do kiềm chuyển hóa và giảm oxy máu do các nguyên nhân khác, có thể bị bỏ sót kiềm chuyển hóa. Trong những trường hợp như vậy, việc cung cấp oxy nên làm giảm kích thích tăng thông khí do giảm oxy máu và cho thấy sự giảm thông khí như một đáp ứng bù trừ với kiềm chuyển hóa¹⁵.
Mặc dù trước đây người ta tin rằng sự bù trừ hô hấp tối đa bằng cách giảm thông khí không quá 55-60 mmHg, sự bù trừ có thể làm tăng pCO2 động mạch lên trên 80 mmHg trong một số trường hợp¹⁴’¹⁵.
Trong giai đoạn ban đầu của kiềm chuyển hóa, cả pH và HCO3⁻ đều tăng và pCO2 vẫn bình thường. Trong vòng 2 giờ, sự bù trừ bằng cách giảm thông khí nên được thấy rõ, với sự bù trừ tối đa xảy ra sau 12-24 giờ, làm tăng pCO2 máu để phù hợp với HCO3⁻ tăng cao và khôi phục tỷ lệ HCO3⁻/pCO2 về mức bình thường. Nói chung, sự bù trừ hô hấp làm tăng pCO2 0,7 mmHg cho mỗi 1,0 mmol/L tăng HCO3⁻. Ví dụ, ở một bệnh nhân phát triển kiềm chuyển hóa, sau 24 giờ, nếu HCO3⁻ tăng từ 24 lên 32 mmol/L (8 mmol/L trên mức bình thường 24 mmol/L), pCO2 nên khoảng 46 mmHg (40 + 0,7 × 8)¹⁵. Phương trình cho điều này như sau:
pCO2 bù trừ = pCO2 ban đầu + 0,7 × (HCO3⁻ bù trừ – HCO3⁻ ban đầu)
pCO2 = 40 + 0,7 × (HCO3⁻ – 24) = 40 + 0,7 × 8 = 46 (2.3)
Nếu pCO2 thực tế chệch khỏi pCO2 dự kiến này hơn 4 mmHg, bệnh nhân có thể có một rối loạn hỗn hợp do toan hô hấp tiềm ẩn (nếu cao hơn 4 mmHg) hoặc kiềm hô hấp (nếu thấp hơn 4 mmHg).
Cảnh báo: Những tính toán cho bù trừ dự kiến này nên được sử dụng như hướng dẫn trong chẩn đoán và không nên được diễn giải quá mức như một chẩn đoán tuyệt đối.
Điều trị. Điều trị tối ưu cho kiềm chuyển hóa là điều chỉnh rối loạn cơ bản và bất kỳ yếu tố nào kéo dài rối loạn. Trong một số trường hợp, chỉ cần bù nước đơn giản sẽ dần dần điều chỉnh kiềm chuyển hóa nếu chức năng thận bình thường. Vì thiếu hụt Cl⁻ thường hiện diện, Cl⁻ có thể được thay thế bằng cách sử dụng dung dịch NaCl hoặc KCl khi thích hợp, cần xem xét đến chức năng thận. Hiếm khi, HCl pha loãng có thể được sử dụng đường tĩnh mạch nếu cần thiết, và Brandis chỉ ra rằng việc điều chỉnh kiềm chuyển hóa sẽ gây ra sự dịch chuyển sang phải của đường cong phân ly oxy, làm tăng giải phóng oxy ngoại vi¹⁶’¹⁷. Ở những bệnh nhân bị phù toàn thân hoặc suy tim sung huyết vẫn ở trong tình trạng phù và tiếp tục cần lợi tiểu, có thể sử dụng acetazolamide, một chất ức chế carbonic anhydrase. Acetazolamide chủ yếu ức chế sự tái hấp thu natri bicarbonat ở ống lượn gần của thận, từ đó làm tăng bài tiết bicarbonat qua nước tiểu.
Toan hô hấp
pCO2 động mạch là sự cân bằng giữa sản xuất tế bào và loại bỏ bởi thông khí phế nang. Toan hô hấp thường do thông khí không đủ dẫn đến thừa CO2 trong máu và giảm đồng thời pH máu xuống dưới 7,35. Toan hô hấp cấp tính thường liên quan đến giảm thông khí, nhưng cũng có thể do tăng sản xuất CO2 của cơ thể, hoặc thừa CO2 trong khí hít vào¹⁸. Thông thường, các trung tâm hô hấp ở cầu não và hành não kiểm soát thông khí phế nang bằng các thụ thể hóa học nhạy cảm với những thay đổi về pCO2, pO2 và pH, sao cho bất kỳ sự tăng sản xuất CO2 nào cũng nhanh chóng kích thích tăng thông khí, duy trì pCO2 động mạch ở mức bình thường¹⁹. Nếu pCO2 động mạch tăng, thường liên quan đến vấn đề về thông khí.
Cơ chế của toan hô hấp cấp tính và mạn tính:
- Suy thông khí do ức chế CNS gây ra bởi chấn thương não, thuốc như opioid hoặc thuốc gây mê, hoặc suy yếu cơ hô hấp như thấy trong các rối loạn thần kinh cơ, chẳng hạn như nhược cơ, xơ cứng cột bên teo cơ, hoặc loạn dưỡng cơ.
- Suy giảm trao đổi khí ở phổi do tỷ lệ khoảng chết cao [(tổng thông khí – thông khí phế nang)/tổng thông khí]. Điều này có thể thấy trong một số bệnh phổi liên quan đến phá hủy khoảng phế nang hoặc giảm lưu lượng máu đến một phân đoạn của phổi. Trong những tình huống này, thông khí phế nang hiệu quả chiếm một tỷ lệ nhỏ hơn của tổng thông khí phút.
- Giảm đáp ứng phản xạ mạn tính với thiếu oxy và tăng CO2 máu thấy trong COPD, bệnh phổi hạn chế mạn tính và hội chứng giảm thông khí do béo phì¹⁹.
- Tắc nghẽn đường thở cấp tính do hít phải dị vật hoặc tắc nghẽn ống nội khí quản.
- Suy tuần hoàn, gây ra cung cấp máu không đủ đến phổi.
- Tăng chuyển hóa hoặc sản xuất CO2 ở bệnh nhân thở máy không tự thở. Nếu sản xuất CO2 tăng trong khi thông khí vẫn không đổi, pCO2 trong máu sẽ tăng²⁰.
Bù trừ dự kiến trong toan hô hấp⁸’²⁰ (Bảng 2.3 và Hình 2.1). Để bù trừ lượng CO2 và axit dư thừa trong máu, thận bắt đầu bài tiết nhiều ion hydro và ammonium hơn và tái hấp thu nhiều bicarbonat hơn. Trong giai đoạn cấp tính, đệm huyết tương của CO2 tăng cao làm tăng HCO3⁻ nhẹ, khoảng 1 mmol/L cho mỗi 10 mmHg tăng pCO2. Trong vài giờ tiếp theo, thận tăng tái hấp thu HCO3⁻, làm tăng HCO3⁻ huyết thanh khoảng 2 mmol/L. Thận cũng có thể tăng giữ lại bicarbonat bằng cách bài tiết nước tiểu có nồng độ clorua (và ion ammonium) cao so với natri, điều này sẽ làm giảm mất bicarbonat. Khi quá trình này tiếp tục vào giai đoạn mạn tính (sau 24 giờ), sự bù trừ của thận xảy ra dần dần trong vài ngày để tăng HCO3⁻, đạt đến mức ổn định sau 2-5 ngày. Ngay cả sau vài ngày, sự bù trừ thường không đưa pH hoàn toàn trở lại bình thường⁸. Vì sự bù trừ xảy ra trong hai giai đoạn, có hai thuật toán dự đoán mức HCO3⁻ trong máu dự kiến²¹.
Toan hô hấp cấp tính: Đối với mỗi 10 mmHg tăng pCO2 động mạch trên 40 mmHg, HCO3⁻ nên tăng khoảng 1 mmol/L và pH nên giảm khoảng 0,07-0,08. Ví dụ, trong giai đoạn này, nếu pCO2 tăng từ 40 lên 50 mmHg, HCO3⁻ nên tăng khoảng 1 mmol/L (tức là 25 mmol/L) và pH nên giảm 0,08. Ví dụ, pH giảm từ 7,40 xuống khoảng 7,32.
HCO3⁻ bù trừ = HCO3⁻ ban đầu + 0,1 × (pCO2 bù trừ – pCO2 ban đầu) (2.4)
Thay đổi pH = -0,008 × (40 – pCO2) = -0,008 × 10 = -0,08 (2.5)
Toan hô hấp mạn tính: Đáp ứng HCO3⁻ tối đa xảy ra sau khoảng 3 ngày, với HCO3⁻ tăng 3-4 mmol/L cho mỗi 10 mmHg tăng pCO2 động mạch. Ví dụ, nếu pCO2 đã tăng từ mức cơ bản của bệnh nhân là 40 mmHg lên trạng thái ổn định 60 mmHg trong vài ngày, HCO3⁻ nên đã tăng khoảng 6-8 mmol/L. Trong ví dụ của chúng ta, nếu HCO3⁻ bình thường của bệnh nhân là 24 mmol/L, nó nên khoảng 30-32 mmol/L sau 3 ngày bù trừ chuyển hóa. Do đó, đối với sự tăng pCO2 từ 40 lên 60 mmHg, bicarbonat dự kiến trong quá trình bù trừ có thể được tính bằng
HCO3⁻ bù trừ = HCO3⁻ ban đầu + 0,35 × (pCO2 bù trừ – pCO2 ban đầu) (2.6)
hoặc:
HCO3⁻ = 24 + 0,35 × (60 – 40) = 31 mmol/L
Thay đổi pH dự kiến có thể được tính bằng
Thay đổi pH = -0,003 × (40 – pCO2) = -0,06 (2.7)
Lưu ý rằng những tính toán này phụ thuộc vào thời gian. Nếu biết, giá trị ban đầu hoặc cơ bản của bệnh nhân được ưu tiên, nhưng nếu không biết, chúng ta có thể giả định rằng bệnh nhân bắt đầu với pH rất bình thường (7,40), pCO2 (40 mmHg) và HCO3⁻ (24 mmol/L).
Cảnh báo: Những tính toán cho bù trừ dự kiến này nên được sử dụng như hướng dẫn trong chẩn đoán và không nên được diễn giải quá mức như một chẩn đoán tuyệt đối.
Điều trị toan hô hấp. Nên điều chỉnh từ từ pCO2 máu tăng để tránh kiềm hóa đột ngột dịch não tủy có thể dẫn đến co giật. Mặc dù thông khí với áp lực dương có thể cần thiết, liệu pháp dược lý ít xâm lấn nhắm vào nguyên nhân cơ bản của toan hô hấp như thuốc giãn phế quản hoặc thuốc ức chế opioid như naloxone có thể đủ¹⁹. Hiếm khi sử dụng bicarbonat, vì HCO3⁻ đi qua hàng rào máu não chậm, có thể làm tăng pH máu mà không ảnh hưởng đến pH CNS²².
Kiềm hô hấp
Có lẽ đáng ngạc nhiên, kiềm hô hấp đã được trích dẫn là rối loạn toan-kiềm phổ biến nhất¹². Kiềm hô hấp có thể do bất kỳ tình trạng nào dẫn đến tăng thông khí và liên quan đến sự giảm pCO2 máu xuống dưới 35 mmHg và pH máu tăng cao. Từ thông khí phút bình thường 5-8 L/phút, kiềm hô hấp (tăng thông khí) là kết quả của việc tăng thông khí phút, trong đó CO2 bị mất nhanh hơn so với sản xuất, dẫn đến tăng pH và giảm pCO2. Thông thường, các trung tâm hô hấp ở cầu não và hành não kiểm soát thông khí, với nhiều yếu tố gây ra tăng thông khí.
Kiềm hô hấp có thể là một quá trình cấp tính hoặc mạn tính. Trong khi tăng thông khí có thể thay đổi mức pCO2 rất nhanh, sự bù trừ chuyển hóa bằng cách tăng mất HCO3⁻ và tăng giữ lại ion H⁺ là một quá trình chậm hơn nhiều và mất vài giờ đến vài ngày để bù trừ sự mất cân bằng pH. Do đó, mức HCO3⁻ phần lớn bình thường trong tăng thông khí cấp tính vì bài tiết qua thận chưa có đủ thời gian để làm giảm mức HCO3⁻. Khi tăng thông khí chuyển sang giai đoạn mạn tính, mức HCO3⁻ sẽ giảm.
Cơ chế của kiềm hô hấp¹²’²³:
- Tăng thông khí do CNS gây ra bởi chấn thương đầu, đột quỵ, đau, lo âu, nhiễm trùng huyết, sợ hãi, căng thẳng, thuốc và thuốc men.
- Tăng thông khí do giảm oxy máu, như gây ra bởi thuyên tắc phổi, viêm phổi, tràn khí màng phổi và đợt cấp của bệnh phổi mạn tính.
- Thông khí phút quá mức với máy thở áp lực dương.
Bù trừ dự kiến trong kiềm hô hấp⁹’²³’²⁴ (Bảng 2.3 và Hình 2.1). Đáp ứng chuyển hóa dự kiến đối với pCO2 máu giảm trong kiềm hô hấp là thận giảm tái hấp thu bicarbonat ở ống lượn gần, làm giảm HCO3⁻ huyết tương và giảm pH huyết tương. Vì sự bù trừ chuyển hóa tương đối chậm, nó phụ thuộc vào thời gian và xảy ra trong hai giai đoạn. Do đó, bù trừ dự kiến có hai thuật toán để dự đoán mức HCO3⁻ trong máu dự kiến:
Kiềm hô hấp cấp tính (<24 giờ): Đối với mỗi 10 mmHg giảm pCO2 động mạch dưới 40 mmHg, pH nên tăng khoảng 0,08, và HCO3⁻ nên giảm ~2 mmol/L. Ví dụ, trong giai đoạn này, nếu pCO2 giảm từ 40 xuống 30 mmHg, sự giảm 10 mmHg này nên liên quan đến sự tăng pH 0,08 (pH ~7,48) và giảm bicarbonat 2 mmol/L, từ 24 xuống ~22 mmol/L. Phương trình cho điều này là:
HCO3⁻ bù trừ = HCO3⁻ ban đầu – 0,2 × (pCO2 ban đầu – pCO2 bù trừ) (2.8)
Kiềm hô hấp mạn tính (2-5 ngày): Đối với mỗi 10 mmHg giảm pCO2, pH nên tăng khoảng 0,03 và HCO3⁻ nên giảm khoảng 5 mmol/L. Ví dụ, nếu pCO2 giảm từ 40 xuống 30 mmHg sau 2 ngày tăng thông khí, pH nên tăng 0,03 (pH ~7,43) và HCO3⁻ nên giảm khoảng 5, từ 24 xuống 19 mmol/L.
HCO3⁻ bù trừ = HCO3⁻ ban đầu – 0,5 × (pCO2 ban đầu – pCO2 bù trừ) (2.9)
- Lưu ý: Giới hạn dưới cho sự bù trừ chuyển hóa trong tăng thông khí là HCO3⁻ huyết tương ~12 mmol/L (~12 mEq/L). Nếu HCO3⁻ huyết tương <12 mmol/L (<12 mEq/L), một toan chuyển hóa tiềm ẩn có thể hiện diện.
Cảnh báo: Những tính toán cho bù trừ dự kiến này nên được sử dụng như hướng dẫn trong chẩn đoán và không nên được diễn giải quá mức như một chẩn đoán tuyệt đối.
Điều trị kiềm hô hấp. Điều trị nhằm mục đích điều chỉnh hoặc giảm nhẹ tình trạng cơ bản, chẳng hạn như thuốc cho lo âu hoặc đau, kháng sinh cho nhiễm trùng huyết, hoặc thuốc chống đông máu cho thuyên tắc phổi¹². Phải điều chỉnh tình trạng giảm oxy máu bằng cách cung cấp oxy bổ sung. Tăng thông khí do lo âu có thể được điều trị bằng cách trấn an hoặc đôi khi bằng cách thở lại không khí đã thở ra (có hàm lượng CO2 cao hơn) ở những người khỏe mạnh²³.
Phát hiện rối loạn toan-kiềm hỗn hợp
Rối loạn toan-kiềm hỗn hợp xảy ra khi nhiều rối loạn toan-kiềm nguyên phát xảy ra cùng một lúc. Những rối loạn này phổ biến trong quần thể bệnh viện, đặc biệt là ở khoa cấp cứu và đơn vị chăm sóc tích cực. Mặc dù các phương trình và Hình 2.1 và 2.2 có thể hỗ trợ trong chẩn đoán, nhưng những mối quan hệ này có thể không hoàn toàn đúng ở những bệnh nhân có rối loạn toan-kiềm phức tạp và mãn tính thay đổi trong quá trình bệnh. Không có gì thay thế được việc xem xét cẩn thận tiền sử của bệnh nhân và đánh giá lâm sàng.
Hình 2.2. Biểu đồ để giải thích tình trạng toan-kiềm. Trục Y là nồng độ bicarbonate trong huyết tương tính bằng mmol/L. Trục X dưới là pH; trục X trên là nồng độ ion H+ tính bằng nmol/L. Các đường cong biểu thị các giá trị pCO2 không đổi tính bằng mmHg. Các đường cong thể hiện pCO2 không đổi.
Tầm quan trọng của việc xác định rối loạn toan-kiềm hỗn hợp nằm ở ý nghĩa chẩn đoán và điều trị của chúng. Ví dụ, sự phát triển của kiềm chuyển hóa nguyên phát ở một bệnh nhân bị bệnh tắc nghẽn đường thở mãn tính đang được điều trị bằng thuốc lợi tiểu nên cảnh báo bác sĩ lâm sàng về khả năng thiếu hụt kali, và một bệnh nhân có kiềm hô hấp và toan chuyển hóa hỗn hợp nên được đánh giá về khả năng ngộ độc salicylate⁹’²⁵’²⁶.
Bù trừ dự kiến có xảy ra không?
Một khái niệm đơn giản cần nhớ trong rối loạn toan-kiềm nguyên phát là nếu bù trừ dự kiến không xảy ra, nên nghi ngờ một rối loạn hỗn hợp. Ví dụ, trong toan chuyển hóa nguyên phát, phổi được kỳ vọng sẽ bù trừ lượng axit chuyển hóa dư thừa này bằng cách tăng thông khí (một quá trình kiềm hô hấp) để loại bỏ axit hô hấp CO2 và đưa pH trở lại gần bình thường. Nếu điều này không xảy ra như dự kiến, người đó được coi là có toan hô hấp tiềm ẩn⁹’²⁴⁻²⁶.
Toan chuyển hóa: Đáp ứng hô hấp để bù trừ toan chuyển hóa là tăng thông khí, làm bình thường hóa pH bằng cách giảm pCO2 để cân bằng với sự thiếu hụt HCO3⁻. Sự tăng thông khí bù trừ này bắt đầu trong vòng 30 phút và nên đạt mức tối đa sau 12-24 giờ. Đáp ứng này bằng cách tăng thông khí nên làm giảm pCO2 máu 1,2 mmHg cho mỗi 1 mmol/L giảm HCO3⁻ máu. Như đã được suy ra trước đó¹⁰, pCO2 dự kiến (mmHg) trong thời gian này nên nằm trong khoảng 3 mmHg của
pCO2 bù trừ = pCO2 ban đầu – 1,2 × (HCO3⁻ ban đầu – HCO3⁻ bù trừ) (2.10)
Kiềm chuyển hóa: Đáp ứng bù trừ đối với kiềm chuyển hóa là giảm thông khí, làm tăng pCO2. Như đã mô tả trước đó¹⁵, trong thời gian bù trừ này, pCO2 dự kiến (mmHg) nên nằm trong khoảng 3 mmHg của
pCO2 bù trừ = pCO2 ban đầu + 0,7 × (HCO3⁻ bù trừ – HCO3⁻ ban đầu) (2.11)
Hình 2.1 cho thấy các vùng dự kiến của pCO2 so với HCO3⁻ cho cả toan chuyển hóa và kiềm chuyển hóa. Tuy nhiên, như đã đề cập trước đó, bù trừ dự kiến được tính toán bằng một phương trình chỉ nên được sử dụng như một hướng dẫn và không phải là một chẩn đoán tuyệt đối. Điều này đặc biệt đúng nếu một bệnh nhân đã có nhiều rối loạn toan-kiềm (hỗn hợp) xảy ra trong một khoảng thời gian.
Toan hô hấp hoặc kiềm hô hấp: Nếu một bệnh nhân có toan hô hấp đơn thuần, nồng độ HCO3⁻ bù trừ dự kiến có thể được dự đoán bằng Phương trình (2.4) hoặc (2.5) cho toan hô hấp cấp tính và bằng Phương trình (2.6) hoặc (2.7) cho toan hô hấp mạn tính. Nếu một bệnh nhân có kiềm hô hấp đơn thuần, nồng độ HCO3⁻ bù trừ dự kiến có thể được dự đoán bằng Phương trình (2.8) cho những thay đổi cấp tính và bằng Phương trình (2.9) cho những thay đổi mạn tính. Ngoài ra, các quy tắc đơn giản dự đoán những thay đổi pH dự kiến so với sự thay đổi pCO2 trong các giai đoạn cấp tính và mạn tính. Trong giai đoạn cấp tính của các rối loạn hô hấp, đối với mỗi 10 mmHg tăng hoặc giảm pCO2, pH nên thay đổi 0,08. Khi điều này tiến triển sang giai đoạn mạn tính (1-2 ngày), đối với mỗi 10 mmHg tăng hoặc giảm pCO2, pH chỉ nên thay đổi 0,03²⁴’²⁵. Bảng 2.4 minh họa mối quan hệ giữa pCO2, pH và HCO3⁻ cho những thay đổi hô hấp cấp tính và mạn tính:
BẢNG 2.4 Những thay đổi dự kiến đối với pCO2, pH và HCO3⁻ trong các tình trạng hô hấp cấp tính và mạn tính.
| pCO2 (mmHg) | Thay đổi dự kiến trong tình trạng hô hấp cấp tính | Thay đổi dự kiến trong tình trạng hô hấp mạn tính |
|---|---|---|
| pH | HCO3⁻ (mmol/L) | pH |
| 70 | 7,16 | 27 |
| 60 | 7,24 | 26 |
| 50 | 7,32 | 25 |
| 40 | 7,40 | 24 |
| 30 | 7,48 | 22 |
| 20 | 7,56 | 20 |
Hình 2.1 là biểu đồ đồ thị của các phương trình để dự đoán cách bicarbonat dự kiến sẽ thay đổi trong các rối loạn hô hấp nguyên phát cấp tính và mạn tính và cách pCO2 dự kiến sẽ thay đổi trong các rối loạn chuyển hóa nguyên phát với sự bù trừ. Nếu dữ liệu khí máu rõ ràng không phản ánh những mối quan hệ theo thời gian này, nó gợi ý rằng một rối loạn bổ sung đang hiện diện và bệnh nhân có một rối loạn hỗn hợp. Tuy nhiên, những mối quan hệ này chỉ là hướng dẫn và có thể không đúng đối với các rối loạn toan-kiềm phức tạp.
Delta gap và tỷ lệ delta⁵’⁹’²⁷⁻²⁹. “Delta gap” là sự chênh lệch giữa sự tăng AG và sự giảm HCO3⁻. Nó có thể giúp xác định xem toan chuyển hóa khoảng trống anion cao có được giải thích hoàn toàn bởi sự giảm HCO3⁻ hay không, hoặc có thể có một rối loạn toan-kiềm hỗn hợp. Nếu delta gap gần bằng không, có khả năng là một toan chuyển hóa đơn thuần hoặc “thuần túy” đang hiện diện. Nếu delta gap rõ ràng dương, nó gợi ý rằng có nhiều HCO3⁻ trong máu (tức là ít HCO3⁻ bị mất) hơn dự kiến từ AG tăng nên một kiềm chuyển hóa bổ sung có thể hiện diện. Nếu delta gap rõ ràng âm, nó gợi ý ít HCO3⁻ hiện diện (nhiều HCO3⁻ bị mất) hơn dự kiến từ AG tăng, nên một toan chuyển hóa không khoảng trống anion bổ sung có thể hiện diện.
Delta Gap = (AG – 12) – (24 – HCO3⁻) (2.12)
“Tỷ lệ delta” dựa trên cùng một khái niệm để giải thích một AG tăng, ngoại trừ việc nó sử dụng tỷ lệ của sự tăng AG (Na – Cl – HCO3⁻) từ một giá trị trung bình bình thường là 12, so với sự giảm HCO3⁻ từ một giá trị bình thường là 24. Một phương trình cho tỷ lệ delta như sau:
Tỷ lệ Delta = (AG – 12) / (24 – HCO3⁻) (2.13)
[Lưu ý rằng giá trị HCO3⁻ là 24 làm cho tỷ lệ delta không xác định vì mẫu số bằng không] Trong một toan chuyển hóa điển hình, sự tăng AG từ 12 mmol/L và sự giảm HCO3⁻ từ 24 mmol/L nên gần bằng nhau, vì vậy “tỷ lệ delta” sẽ xấp xỉ 1. Nếu tỷ lệ delta đáng kể lớn hơn 1, nó gợi ý rằng có nhiều HCO3⁻ trong máu hơn dự kiến từ AG tăng, nên một kiềm chuyển hóa bổ sung có thể hiện diện. Nếu tỷ lệ delta đáng kể nhỏ hơn 1, nó có nghĩa là ít HCO3⁻ hiện diện hơn dự kiến từ AG tăng, vì vậy điều này gợi ý một toan chuyển hóa không khoảng trống anion bổ sung đang hiện diện. Ví dụ về các tỷ lệ delta và delta gap khác nhau được minh họa trong Bảng 2.5, và các phạm vi giải thích được hiển thị trong Bảng 2.6.
BẢNG 2.5 Ví dụ về các tỷ lệ delta và delta gap khác nhau.
| Na+ | Cl- | HCO3- | AG | Delta Gap | Tỷ lệ Delta | Giải thích |
|---|---|---|---|---|---|---|
| 140 | 105 | 25 | 10 | -1 | – | Bình thường |
| 140 | 105 | 15 | 20 | 0 | 1,0 | Toan chuyển hóa AG cao đơn thuần |
| 140 | 115 | 15 | 10 | -10 | 0 | Toan chuyển hóa AG bình thường đơn thuần |
| 140 | 95 | 15 | 30 | 10 | 2,0 | Toan chuyển hóa AG cao + kiềm chuyển hóa |
| 140 | 110 | 15 | 15 | -5 | 0,5 | Toan chuyển hóa AG cao + toan chuyển hóa AG bình thường |
BẢNG 2.6 Phạm vi giải thích cho delta gap và tỷ lệ delta.
| Delta Gap | Tỷ lệ Delta | Giải thích |
|---|---|---|
| -2 đến +2 | 0,8-1,2 | Toan chuyển hóa AG cao đơn thuần |
+6 | >2 | Toan chuyển hóa AG cao + kiềm chuyển hóa
<-6 | <0,8 | Toan chuyển hóa AG cao + toan chuyển hóa AG bình thường
Lưu ý: AG = khoảng trống anion, tính bằng [Na+] – ([Cl-] + [HCO3-])
Dưới đây là một số phát hiện gợi ý mạnh mẽ về rối loạn toan-kiềm hỗn hợp:
- Nếu pH nằm trong giới hạn bình thường và cả HCO3⁻ và pCO2 đều bất thường.
- HCO3⁻ và pCO2 bất thường theo hướng ngược nhau, ví dụ như HCO3⁻ tăng với pCO2 giảm. Đáp ứng bù trừ luôn phải cùng hướng với sự thay đổi do rối loạn nguyên phát gây ra.
- Các rối loạn toan-kiềm đơn thuần không bù trừ quá mức. Nghĩa là, bù trừ sẽ không làm cho tình trạng nhiễm toan trở thành nhiễm kiềm. Thực tế, cơ chế bù trừ thường dừng lại ngay trước khi pH trở về bình thường⁹.
Cách tiếp cận chẩn đoán rối loạn toan-kiềm
Khoảng tham chiếu
Khoảng tham chiếu cho cả máu động mạch và tĩnh mạch được hiển thị trong Bảng 1.1 cho các thông số khí máu và toan-kiềm thông thường³⁰’³¹.
Cách tiếp cận từng bước để đánh giá tình trạng toan-kiềm
Lý tưởng nhất, việc đánh giá các rối loạn toan-kiềm, bao gồm cả rối loạn toan-kiềm hỗn hợp, sẽ bao gồm thông tin đồng thời về tiền sử lâm sàng của bệnh nhân, khám thực thể, kết quả điện giải và kết quả khí máu. Với các máy phân tích khí máu hiện đại, kết quả khí máu thường có sẵn cùng với kết quả điện giải, chất chuyển hóa và hemoglobin.
Hình 2.2 hữu ích như một hướng dẫn để đánh giá kết quả pH, pCO2 và HCO3⁻ của bệnh nhân về khả năng rối loạn toan-kiềm. Bảng kết quả khí máu (pH, pCO2, pO2, HCO3, Na, K, lactate v.v.) có thể được đánh giá theo một số bước như sau:
(1) Đánh giá tiền sử lâm sàng và tình trạng hiện tại của bệnh nhân để dự đoán các tình trạng liên quan đến rối loạn toan-kiềm (xem Bảng 2.7).
(2) Đánh giá pH.
(3) Đánh giá tình trạng thông khí (pCO2) và chuyển hóa (HCO3⁻) để hiểu rõ liệu rối loạn toan-kiềm có đơn thuần hay có thể là một rối loạn hỗn hợp.
(4) a. Đánh giá dữ liệu xét nghiệm và lâm sàng về khả năng rối loạn hỗn hợp và xem bù trừ có phù hợp không.
b. Các thông số như điện giải, lactate, AG, hoặc delta gap/tỷ lệ có chỉ ra rằng một rối loạn toan-kiềm khác đang hiện diện không?
c. Biểu hiện lâm sàng của bệnh nhân có phù hợp với kết quả khí máu không?
Việc đánh giá tình trạng oxy phần lớn độc lập với việc giải thích toan-kiềm, và nó được thảo luận trong Chương 4.
Bước 1. Đánh giá tiền sử lâm sàng và tình trạng của bệnh nhân để dự đoán các rối loạn toan-kiềm có thể xảy ra
Có nhiều tình trạng lâm sàng liên quan đến rối loạn toan-kiềm, như được liệt kê trong Bảng 2.7. Một đánh giá lâm sàng sáng suốt, cả trong đánh giá ban đầu và trong quá trình diễn biến lâm sàng, là một phần vô giá trong việc đánh giá bệnh nhân về rối loạn toan-kiềm.
BẢNG 2.7 Ví dụ về rối loạn toan-kiềm dự kiến liên quan đến các tình trạng lâm sàng khác nhau.
| Tình trạng lâm sàng | Rối loạn toan-kiềm dự kiến |
|---|---|
| Ngừng tim | Toan chuyển hóa |
| Ngừng thở | Toan hô hấp |
| Tăng thông khí (nhiều nguyên nhân) | Kiềm hô hấp |
| Tắc nghẽn ống nội khí quản | Toan hô hấp |
| Nôn | Kiềm chuyển hóa |
| Tiêu chảy | Toan chuyển hóa |
| Tình trạng sốc (tưới máu không đủ) | Toan chuyển hóa |
| Phù phổi cấp | Kiềm hô hấp (giảm oxy máu dẫn đến tăng thông khí) |
| Phù phổi nặng | Toan hô hấp |
| Điều trị bằng thuốc lợi tiểu | Kiềm chuyển hóa |
| Ngộ độc thuốc | Toan hô hấp (ngừng thở) |
| Điều trị bằng bicarbonat | Kiềm chuyển hóa |
| Tưới máu kém | Toan chuyển hóa |
Bước 2. Đánh giá pH
pH bất thường cho thấy tình trạng nhiễm toan hoặc nhiễm kiềm đã xảy ra và mức độ của rối loạn toan-kiềm, và nó có thể gợi ý rằng đã xảy ra bù trừ. Tuy nhiên, chỉ riêng pH không cho biết liệu có rối loạn hỗn hợp hay không. Xem xét các ví dụ sau:
- pH 7,20 xác nhận rằng một nhiễm toan nặng đang hiện diện và bù trừ đang ở giai đoạn đầu hoặc không hiệu quả trong việc kiểm soát nhiễm toan. Cần điều tra thêm để xác định nguồn gốc chuyển hóa hoặc hô hấp của nhiễm toan và liệu có nhiều hơn một quá trình nhiễm toan hiện diện hay không.
- pH 7,48 cho thấy một nhiễm kiềm nhẹ. Cần thêm thông tin để xác định nguyên nhân của nhiễm kiềm và liệu nhiễm kiềm đang ở giai đoạn đầu (và có thể trở nên tồi tệ hơn), đã được bù trừ gần như hoàn toàn, hoặc là một phần của rối loạn hỗn hợp.
pH bình thường có thể cho thấy rằng bệnh nhân không có rối loạn toan-kiềm. Tuy nhiên, bệnh nhân có thể có hỗn hợp các biến cố nhiễm toan và nhiễm kiềm (nguyên phát hoặc bù trừ) đã bù trừ lẫn nhau. Ngoài tiền sử của bệnh nhân, phải xem xét HCO3⁻ và pCO2, như trong các ví dụ sau:
- pH 7,45 với HCO3⁻ và pCO2 tăng gợi ý rằng một kiềm chuyển hóa nguyên phát đã được bù trừ bởi đáp ứng toan hô hấp. Tương tự, pH 7,45 với HCO3⁻ và pCO2 giảm gợi ý rằng một kiềm hô hấp nguyên phát đã được bù trừ bởi đáp ứng toan chuyển hóa.
- pH 7,40 với cả HCO3⁻ và pCO2 đều bất thường cho thấy rằng một nhiễm toan và nhiễm kiềm hỗn hợp đang hiện diện đã vô tình bù trừ lẫn nhau để cho một pH bình thường.
Bước 3. Đánh giá tình trạng thông khí và chuyển hóa
Cách tiếp cận đơn giản nhất để đánh giá pCO2 và HCO3⁻ là xem xét từng thông số riêng biệt như chỉ ra nhiễm toan, nhiễm kiềm, hoặc tình trạng bình thường, sau đó đánh giá chúng cùng với pH để xác định xem rối loạn nguyên phát là hô hấp hay chuyển hóa và liệu có rối loạn hỗn hợp hoặc bù trừ hay không.
pCO2 giảm chỉ ra một quá trình kiềm hô hấp, có thể là nguyên phát hoặc bù trừ. pCO2 tăng chỉ ra một quá trình toan hô hấp, hoặc nguyên phát hoặc bù trừ (Bảng 2.8).
BẢNG 2.8 Đánh giá tình trạng thông khí bằng pCO2 động mạch.
| pCO2 | Tình trạng thông khí |
|---|---|
| Giảm | Quá trình kiềm hô hấp (tăng thông khí) đang hiện diện |
| Bình thường | Tình trạng thông khí bình thường? (Có rối loạn hỗn hợp hiện diện không?) |
| Tăng | Quá trình toan hô hấp (giảm thông khí) đang hiện diện |
HCO3⁻ giảm chỉ ra toan chuyển hóa, hoặc nguyên phát hoặc bù trừ. HCO3⁻ tăng chỉ ra kiềm chuyển hóa, hoặc nguyên phát hoặc bù trừ (Bảng 2.9).
BẢNG 2.9 Đánh giá tình trạng chuyển hóa bằng bicarbonat huyết tương (HCO3⁻).
| Bicarbonat (tổng CO2) | Tình trạng chuyển hóa |
|---|---|
| Giảm | Một quá trình toan chuyển hóa đang hiện diện (hoặc nguyên phát, bù trừ, hoặc hỗn hợp) |
| Bình thường | Không có rối loạn toan-kiềm chuyển hóa? (rối loạn hỗn hợp cũng có thể) |
| Tăng | Một quá trình kiềm chuyển hóa đang hiện diện (hoặc nguyên phát, bù trừ, hoặc hỗn hợp) |
Lưu ý: Các thuật ngữ “kiềm hô hấp”, “toan chuyển hóa”, v.v., chỉ các quá trình bệnh lý và không phải là bù trừ. Tuy nhiên, tôi tin rằng nó đơn giản hóa việc giải thích khi tạm thời coi bất kỳ pCO2 giảm nào (ví dụ) như một quá trình kiềm hô hấp. Liệu đó là một bất thường nguyên phát hay bù trừ phù hợp sẽ trở nên rõ ràng khi xem xét các yếu tố khác.
Nếu pCO2 hoặc HCO3⁻ vẫn bình thường khi cái kia đã bất thường trong một khoảng thời gian đủ dài, thì một rối loạn hỗn hợp có thể hiện diện. Nghĩa là, thiếu một đáp ứng bù trừ thích hợp gợi ý rằng một rối loạn bổ sung đang hiện diện.
Ví dụ 1. Kết quả pCO2 25 mmHg cho thấy một quá trình kiềm hô hấp đang hiện diện. Liệu đó là một bất thường nguyên phát hay bù trừ phù hợp phụ thuộc vào HCO3⁻ và pH liên quan đến pCO2 này và thời gian của kết quả. Nếu HCO3⁻ là 14 mmol/L (14 mEq/L) với pH hơi toan khoảng 7,32 chẳng hạn, thì pCO2 25 mmHg có lẽ chỉ ra sự tăng thông khí bù trừ (một quá trình kiềm hô hấp) cho một toan chuyển hóa nguyên phát.
Ví dụ 2. Đối với pCO2 tương tự 25 mmHg, nếu HCO3⁻ bình thường ở 23 mmol/L (23 mEq/L) và pH kiềm ở khoảng 7,53, pCO2 giảm gợi ý một kiềm hô hấp cấp tính nguyên phát. Nếu HCO3⁻ là 16 mmol/L (16 mEq/L), điều đó gợi ý một kiềm hô hấp mạn tính. Thời gian của tăng thông khí cũng nên được đánh giá để xác định liệu đó là tăng thông khí cấp tính hay mạn tính. Nếu cấp tính, HCO3⁻ 23 mmol/L gợi ý rằng đáp ứng bù trừ chuyển hóa để loại bỏ HCO3⁻ đang tiến triển chậm như dự kiến. Nếu tăng thông khí là mạn tính, thì HCO3⁻ 23 mmol/L cao hơn dự kiến, gợi ý rằng, vì thận không thể bù trừ đầy đủ bằng cách loại bỏ HCO3⁻, một kiềm chuyển hóa cũng có thể hiện diện.
Bước 4. Đánh giá dữ liệu xét nghiệm và lâm sàng về khả năng rối loạn hỗn hợp
Bước 4 có ba thành phần.
Bước 4a. Bù trừ có phù hợp với rối loạn nguyên phát không?
Để đánh giá xem bù trừ dự kiến có đang xảy ra cho rối loạn toan-kiềm nguyên phát hay không, hãy tham khảo các mô tả “Bù trừ dự kiến” trong các phần về rối loạn toan-kiềm khác nhau được mô tả trong chương này và phần “Phát hiện rối loạn toan-kiềm hỗn hợp.”
Hình 2.1 là một biểu đồ được lấy từ các phương trình được liệt kê ở đây và được báo cáo ở nơi khác¹’³² nên hỗ trợ trong việc hiểu và giải thích các thay đổi trong kết quả toan-kiềm xảy ra trong các rối loạn khác nhau. Mặc dù cả Hình 2.1 và 2.2 đều hữu ích, chẩn đoán thực tế tình trạng của bệnh nhân phải luôn bao gồm đánh giá lâm sàng về tiền sử và các phát hiện khám thực thể của bệnh nhân tại thời điểm nhận được kết quả. Hình 2.1 và 2.2 hữu ích trong các rối loạn đơn giản hoặc hỗn hợp kép xảy ra đồng thời, nhưng các hình này trở nên kém đáng tin cậy hơn khi một hoặc nhiều rối loạn mới phát triển bổ sung vào một rối loạn hiện có.
Bước 4b. Các kết quả xét nghiệm khác có gợi ý một rối loạn toan-kiềm bổ sung đang hiện diện không?
Một số xét nghiệm thông thường có thể giúp xác định liệu có rối loạn toan-kiềm bổ sung hay không²⁵’²⁶’³³.
Kali. Hạ kali máu gợi ý một kiềm chuyển hóa có thể hiện diện.
pH. pH bình thường kết hợp với kết quả bất thường cho cả HCO3⁻ và pCO2 cần xem xét một rối loạn toan-kiềm hỗn hợp.
Clorua. Tăng clo máu có thể do nhiều nguyên nhân như được mô tả trong phần toan chuyển hóa, chẳng hạn như nhiễm toan ống thận trong đó HCO3⁻ bị mất trong nước tiểu, hoặc từ toan chuyển hóa nguyên phát hoặc từ bù trừ toan chuyển hóa cho kiềm hô hấp. Hạ clo máu thúc đẩy giữ lại HCO3⁻ ở thận, dẫn đến kiềm chuyển hóa. Bù trừ cho toan hô hấp mạn tính làm tăng giữ lại HCO3⁻ ở thận với mất Cl.
Khoảng trống anion (AG), tính từ các phép đo Na, (K), Cl và HCO3⁻. AG tăng [(Na) – (Cl + HCO3⁻)] >20 mmol/L (>20 mEq/L) chỉ ra toan chuyển hóa. AG cũng hữu ích trong việc phân biệt các nguyên nhân của toan chuyển hóa, như được hiển thị trong Bảng 2.1⁵’³⁴.
- AG tăng xảy ra trong nhiễm toan urê máu, nhiễm toan ceton, nhiễm toan lactic và uống một số thuốc hoặc chất độc nhất định (ví dụ: ethylene glycol hoặc salicylate).
- AG bình thường xảy ra trong nhiễm toan ống thận và tiêu chảy, trong số các tình trạng khác.
Mặc dù thường rất hữu ích, AG được tính toán từ ba hoặc bốn phép đo và chịu sự biến đổi từ các phép đo này. Hơn nữa, hiện nay khuyến cáo hiệu chỉnh cho nồng độ albumin bất thường, như đã lưu ý trong Chương 1 và Bảng 2.2. Một số báo cáo đã phát hiện rằng khoảng một nửa số bệnh nhân có lactate máu rõ ràng tăng cao không có AG tăng⁵’³⁵.
Delta gap hoặc tỷ lệ delta. Delta gap và tỷ lệ delta được thảo luận trước đó trong phần “Phát hiện rối loạn toan-kiềm hỗn hợp.” Nếu delta gap rõ ràng dương hoặc nếu tỷ lệ delta xấp xỉ hai hoặc lớn hơn, nó gợi ý rằng có nhiều HCO3⁻ trong máu (tức là ít HCO3⁻ bị mất) hơn dự kiến từ AG tăng, do đó một kiềm chuyển hóa bổ sung có thể hiện diện. Nếu delta gap rõ ràng âm hoặc nếu tỷ lệ delta xấp xỉ 0,4-0,8, nó gợi ý ít HCO3⁻ hiện diện (nhiều HCO3⁻ bị mất) hơn dự kiến từ AG tăng, do đó một toan chuyển hóa không khoảng trống anion bổ sung có thể hiện diện²⁸’²⁹.
Lactate. Lactate máu tăng là một chỉ báo nhạy cảm của toan chuyển hóa do nhiều rối loạn oxy hóa liên quan đến thông khí, trao đổi khí phế nang, vận chuyển tuần hoàn, hấp thu tế bào, và/hoặc rối loạn chức năng ty thể.
Creatinine. Creatinine tăng chỉ ra suy thận và có thể toan chuyển hóa do urê máu.
Bước 4c. Bệnh nhân có các tình trạng khác liên quan đến rối loạn toan-kiềm không?
Như đã lưu ý trong Bước 1, đánh giá tình trạng toan-kiềm phải bao gồm các phát hiện từ tiền sử và khám thực thể của bệnh nhân. Nhiều tình trạng thường liên quan đến rối loạn toan-kiềm, với một số tình trạng phổ biến được liệt kê trong Bảng 2.7. Đặc biệt nếu kết quả khí máu không giải thích dễ dàng rối loạn “nguyên phát” của bệnh nhân, điều này nên cảnh báo bác sĩ lâm sàng về khả năng có rối loạn toan-kiềm hỗn hợp. Các tình trạng toan-kiềm hỗn hợp khá phổ biến, với một số bệnh nhân có hai hoặc ba rối loạn toan-kiềm độc lập⁹.
Tóm tắt giải thích toan-kiềm (pH, pCO2 và HCO3⁻)
- Đánh giá pH: Trên 7,45 = Nhiễm kiềm Dưới 7,35 = Nhiễm toan
- Đánh giá tình trạng thông khí (pCO2) và chuyển hóa (HCO3⁻):
pH và pCO2 thay đổi cùng hướng = Rối loạn chuyển hóa
pH và pCO2 thay đổi ngược hướng = Rối loạn hô hấp - Xác định xem có rối loạn hỗn hợp hay không:
Bù trừ thận hoặc phổi có xảy ra khi dự kiến không?
Có: có lẽ là rối loạn đơn thuần Không: có lẽ là rối loạn hỗn hợp
HCO3⁻ và pCO2 có thay đổi theo hướng ngược nhau không? Có: có lẽ là rối loạn hỗn hợp
Các xét nghiệm khác có gợi ý một rối loạn toan-kiềm khác đang hiện diện không?
K, Cl, AG, Lactate, Creatinine, delta gap/tỷ lệ. - Tiền sử của bệnh nhân có chỉ ra một rối loạn toan-kiềm khác đang hiện diện không?
Ví dụ ca bệnh toan-kiềm phức tạp⁹
Được rồi các bạn, vì tất cả các bạn đều nên là chuyên gia về kiến thức khí máu vào lúc này, một ví dụ tốt về cách đánh giá một ca toan-kiềm phức tạp được cung cấp bởi Emmett và cộng sự⁹. Nó minh họa một số khái niệm: (1) thách thức của việc đánh giá đáp ứng bù trừ trong rối loạn toan-kiềm hô hấp vì chúng phụ thuộc vào thời gian; (2) các biểu đồ khác nhau có thể hữu ích như một hướng dẫn, nhưng phải được giải thích thận trọng trong các rối loạn toan-kiềm phức tạp; và (3) tầm quan trọng của việc đánh giá tiền sử của bệnh nhân. Đây là kết quả toan-kiềm:
pH: 7,27 pCO2: 70 mmHg (9,3 kPa) HCO3⁻: 31 mmol/L
pH thấp và pCO2 tăng cho thấy người này bị toan hô hấp. Theo Hình 2.2, đối với pCO2 70 mmHg, HCO3⁻ bù trừ nên khoảng 27 mmol/L cho toan hô hấp cấp tính hoặc khoảng 36 mmol/L cho toan hô hấp mạn tính. Vì HCO3⁻ đo được nằm giữa hai nồng độ này, một rối loạn toan-kiềm hỗn hợp có khả năng xảy ra. Đây là bốn giải thích có thể:
- Toan hô hấp mạn tính + toan chuyển hóa. Đây có thể là một bệnh nhân bị bệnh phổi tắc nghẽn mạn tính đã phát triển toan chuyển hóa do tiêu chảy hoặc suy giảm chuyển hóa oxy trong nhiễm trùng huyết. Chẩn đoán đúng có thể được xác định nếu tiền sử của bệnh nhân xác nhận tiêu chảy gần đây, hoặc nếu nồng độ lactate của họ tăng cao do nhiễm trùng huyết.
- Một bệnh nhân bị toan hô hấp mạn tính đã phát triển toan hô hấp cấp tính chồng lên. Bệnh nhân có thể đã có pCO2 55 mmHg (7,3 kPa) với HCO3⁻ bù trừ thích hợp là 31 mmol/L, sau đó phát triển viêm phổi làm tăng đột ngột pCO2 lên 70 mmHg.
- Toan hô hấp cấp tính + kiềm chuyển hóa. Đây có thể là một người phát triển suy giảm hô hấp cấp tính do uống thuốc an thần, sau đó phát triển kiềm chuyển hóa do nôn hoặc uống thuốc lợi tiểu làm tăng HCO3⁻ từ 27 lên 31 mmol/L.
- Toan hô hấp cấp tính đang tiến triển thành toan hô hấp mạn tính. Điều này có thể xảy ra khoảng 1-3 ngày sau khi đợt cấp tính bắt đầu.
Đối với ví dụ này, tiền sử lâm sàng của bệnh nhân rất quan trọng. Nếu bệnh nhân có tiền sử bệnh phổi tắc nghẽn mạn tính và đến khám vì khó thở tăng lên, chẩn đoán khả năng nhất là toan hô hấp mạn tính với toan hô hấp cấp tính chồng lên. Nếu bệnh nhân không có tiền sử bệnh phổi mạn tính và có tiền sử nôn nhiều, chẩn đoán có thể là toan hô hấp cấp tính với kiềm chuyển hóa.
Ví dụ này minh họa tầm quan trọng của việc đánh giá kỹ lưỡng tiền sử lâm sàng và các xét nghiệm bổ sung khi giải thích rối loạn toan-kiềm phức tạp. Các biểu đồ và công thức có thể hữu ích như hướng dẫn, nhưng không nên được sử dụng một cách cứng nhắc, đặc biệt trong các trường hợp phức tạp.
Kết luận
Đánh giá tình trạng toan-kiềm là một phần quan trọng trong chăm sóc bệnh nhân nặng. Nó đòi hỏi sự hiểu biết về sinh lý bệnh của các rối loạn toan-kiềm khác nhau, cũng như khả năng giải thích các kết quả xét nghiệm trong bối cảnh lâm sàng của bệnh nhân. Việc xác định chính xác rối loạn toan-kiềm có thể giúp hướng dẫn điều trị và cải thiện kết quả cho bệnh nhân.
Các điểm chính cần nhớ bao gồm:
- Luôn đánh giá pH, pCO2 và HCO3⁻ cùng nhau khi giải thích rối loạn toan-kiềm.
- Xem xét khả năng có rối loạn hỗn hợp, đặc biệt khi bù trừ dự kiến không xảy ra hoặc khi các thông số thay đổi theo hướng ngược nhau.
- Sử dụng các công cụ bổ sung như khoảng trống anion, delta gap và tỷ lệ delta để hỗ trợ chẩn đoán.
- Đánh giá tiền sử lâm sàng và các xét nghiệm bổ sung để hỗ trợ giải thích kết quả khí máu.
- Nhớ rằng các biểu đồ và công thức là hướng dẫn hữu ích, nhưng không nên được áp dụng một cách cứng nhắc, đặc biệt trong các trường hợp phức tạp.
Với thực hành và kinh nghiệm, việc đánh giá rối loạn toan-kiềm sẽ trở nên dễ dàng hơn và có thể cung cấp thông tin quý giá để hướng dẫn quản lý bệnh nhân.
TÀI LIỆU THAM KHẢO

BÌNH LUẬN